萝卜硫素通过Notch 通路抑制结肠癌SW480 细胞增殖、侵袭、迁移
2022-01-04邢明远赖志亨马萌
邢明远 赖志亨 马萌
(海南省中医院 1 肿瘤科,海南 海口 570203;2 肛肠科;3 陕西中医药大学附属医院肿瘤科)
结肠癌原发于结肠黏膜上皮,恶性程度高,其是消化系统常见的恶性肿瘤,也是临床上癌症相关死亡的主要原因,且近几年随着我国经济的迅速发展,快节奏的生活方式和不良的生活习惯,导致结肠癌的发病率逐年提高,严重威胁人们的生命健康〔1~3〕。随着对中医学的深入研究,发现中医在临床治疗肿瘤中发挥重要作用,为临床上治疗肿瘤扩展了新思路。萝卜硫素又称为菜菔子素,作为提取于十字花科蔬菜中的一种异硫氰酸酯类天然活性物质,其能够诱导产生Ⅱ型解毒酶,从而调控癌细胞生物学进程,防止乳腺癌等扩散与蔓延〔4〕。Notch 信号通路在癌症中受到广泛关注,其能够调控Hes1 等下游因子表达进而介导细胞增殖、凋亡等生理病理过程〔5〕。研究发现,Notch 信号通路与结肠癌的发生发展密切相关〔6〕,其中Notch1 在人结肠癌组织中呈高表达,结肠癌SW480 细胞增殖受抑制同时,Notch1、Hes1 mRNA 和蛋白表达水平亦显著下调〔7〕。此外,杨正宏等〔8〕研究发现萝卜硫素能抑制结肠癌HT-29 细胞增殖、血管形成并促进细胞凋亡,可能与抑制Notch1 表达有关。本研究将以结肠癌SW480 细胞为研究对象,基于Notch 信号通路探究萝卜硫素对SW480 细胞增殖、侵袭、迁移的影响,以期为结肠癌治疗提供新思路。
1 材料与方法
1.1 细胞、试剂与仪器 人结肠癌SW480 细胞(货号:C4115,美国ATCC 公司),萝卜硫素(≥98%,货号:BP0219,成都格纯生物医药有限公司),胰酶溶液(货号:C0201,杭州碧云天生物研究所),胎牛血清(FBS)、RPMI1640 培养基、四甲基偶氮唑蓝(MTT)试剂(货号:KL-NXQ05、KL-S764、KL-S0050,上海康朗生物科技有限公司),兔抗人Notch1、Notch3、Hes1、β-actin 抗 体(货 号:K10957-JRY、K21355-RPK、K17548-MTX、K10085-OZI,北京百奥莱博科技有限公司),兔抗人Ki-67、增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-9、E-钙黏蛋白(E-cadherin)抗体(货号:FNab09788、FNab06217、FNab05247、FNab10112,武汉菲恩生物科技有限公司),山羊抗兔IgG(H+L)辣根过氧化物酶(HRP)(货号:BM3894,武汉博士德生物工程有限公司)。CO2培养箱(型号:INC108,德国Heraeus 公司),流式细胞仪(型号:FACSCanto Ⅱ,美国BD 公司),蛋白电泳及电转移装置(型号:AU5800,北京市六一仪器厂),酶联免疫分析仪(型号:EVO75,澳大利亚Techan 公司)。
1.2 实验方法
1.2.1 细胞培养 将人结肠癌SW480 细胞接种于RPMI1640 培养液(RPMI1640 培养基中添加1%青链霉素双抗和10% FBS)中,在37℃、5% CO2、98%相对湿度的培养箱中常规培养。观察细胞状态,当细胞的融合度达70%~80%时,胰酶溶液消化传代,收集对数期细胞进行后续实验。
1.2.2 MTT 比色法筛选萝卜硫素对SW480 细胞的作用浓度 SW480 细胞密度调整为5×104个/ml,随后以每孔200 μl 接种到96 孔板上,常规培养过夜后弃培养液,加入含不同浓度萝卜硫素〔终浓度分别为0(对照)、1、2、5、10、20、40 μmol/L〕的RPMI1640 培养液,每个浓度设置6 个复孔。继续培养48 h 后每孔添加25 μl MTT 溶液(5 mg/ml),再继续培养4 h 后弃上清液,每孔加入150 μl 二甲基亚砜(DMSO)溶液,于摇床上低速振荡10 min,使结晶物充分溶解,最后用酶标仪(波长490 nm)测定各孔吸光度(OD 值),计算SW480 细胞增殖抑制率,并绘制细胞生长曲线。细胞增殖抑制率(%)=(OD 值对照组-OD 值实验组)/OD 值对照组×100%。
1.2.3 细胞分组及处理 将SW480 细胞分为对照组、低、中、高浓度组,其中对照组不进行药物处理,低、中、高浓度组分别采用1、2、5 μmol/L 萝卜硫素处理。
1.2.4 平板克隆实验测定SW480 细胞集落形成能力 取对数期SW480 细胞,胰蛋白酶消化制备单细胞悬液,接种于6 孔板中,按照1.2.3 分组处理细胞,静置培养2 w 后,当培养皿中出现肉眼可见的克隆时,终止培养,弃去上清液,甲醇固定、结晶紫染色,洗去染色液,洗涤后在显微镜下计数细胞个数≥50 的单克隆集落,计算集落形成率(表示SW480 细胞集落形成能力)。集落形成率(%)=集落数/接种数×100%。
1.2.5 Transwell 侵袭实验测定SW480 细胞侵袭能力 将200 μg/ml 基质胶以200 μl/cm2铺在Transwell 小室上室,待其凝固,备用。用RPMI1640 培养液(不含FBS)将SW480 细胞调整为1×105个/ml的细胞悬液,取200 μl 细胞悬液接种到Transwell 上室,600 μl 含10% FBS 的RPMI1640 培养液加入下室,待SW480 细胞贴壁后弃上清液,按照1.2.3 分组处理细胞(RPMI1640 培养液不含FBS),每组设置6 个复孔。继续培养48 h 后取出Transwell 小室,磷酸盐缓冲液(PBS)洗涤3 次后用棉球轻擦上室滤膜表面残存细胞,在4℃下10%甲醛固定10 min,PBS 洗涤后室温下0.1%结晶紫染色30 min,PBS 再次洗涤。倒置显微镜下观察染色细胞,随机选择6个视野计数(即侵袭细胞数,表示SW480 细胞侵袭能力),结果取平均值。
1.2.6 划痕实验测定SW480 细胞迁移能力 将SW480 细胞接种于6 孔板,当其单层平铺底部时,用灭菌后的200 μl 枪头垂直于底部,均匀划出一道划痕,随后用PBS 洗涤3 次,用倒置显微镜观察划痕并拍照(记录为0 h 划痕距离),接着按照1.2.3分组处理细胞(RPMI1640 培养液不含FBS),每组设置6 个复孔。继续培养48 h 后用倒置显微镜观察细胞划痕情况并拍照(记录为48 h 划痕距离),计算划痕愈合率(表示SW480 细胞迁移能力)。划痕愈合率(%)=(0 h 划痕距离-48 h 划痕距离)/0 h划痕距离×100%。
1.2.7 Western 印迹法测定SW480 细胞中Notch 通路相关蛋白、增殖相关蛋白及迁移侵袭相关蛋白表达水平 将SW480 细胞接种于6 孔板,按照1.2.3分组处理细胞48 h 后收集细胞,用细胞裂解液充分裂解后离心,以提取各组SW480 细胞总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。各组取50 μg 蛋白上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转至聚偏氟乙烯(PVDF)膜上,5% BSA 室温封闭1 h 后加入兔抗人Notch1、Notch3、Hes1、Ki-67、PCNA、MMP-9、E-cadherin 及内参β-actin 抗体(稀释比例均为1 ∶1 000)作为一抗,4℃孵育过夜,PBS 洗涤3 次后加入HRP 标记的山羊抗兔IgG(稀释比例1 ∶1 000)作为二抗,室温孵育30 min,PBS 洗涤后ECL 显色,Tanon 凝胶分析系统扫描图像,分析各条带灰度。
1.3 统计学分析 采用SPSS25.0 软件进行t检验、单因素方差分析、SNK-q检验。
2 结果
2.1 萝卜硫素对SW480 细胞作用浓度的筛选结果 与0 μmol/L 萝卜硫素处理SW480 细胞后,细胞增殖抑制率〔(2.01±0.91)%〕相比,1、2、5、10、20、40 μmol/L 萝卜硫素处理SW480 细胞后,细胞增殖抑制 率〔(7.29 ± 2.06)%,(13.09 ± 4.28)%,(27.18±4.54)%,(37.98 ± 5.91)%,(55.84 ±7.53)%,(79.85±8.54)%〕均显著升高,并呈浓度依赖性(均P<0.05)。当萝卜硫素浓度≤5 μmol/L时,作用48 h后SW480 细胞增殖抑制率均<30%,即此时细胞相对活力>70%,故选取萝卜硫素浓度为1、2、5 μmol/L进行后续实验,以防止细胞活力过低影响Transwell 侵袭实验和划痕实验结果。
2.2 萝卜硫素对SW480 细胞集落形成能力的影响 与对照组SW480 细胞集落形成率〔(77.16 ±6.14)%〕相比,低、中、高浓度组〔(63.04 ±4.98)%,(51.18±6.79)%,(39.44±6.08)%〕显著降低;且呈浓度依赖性(均P<0.05)。见图1。
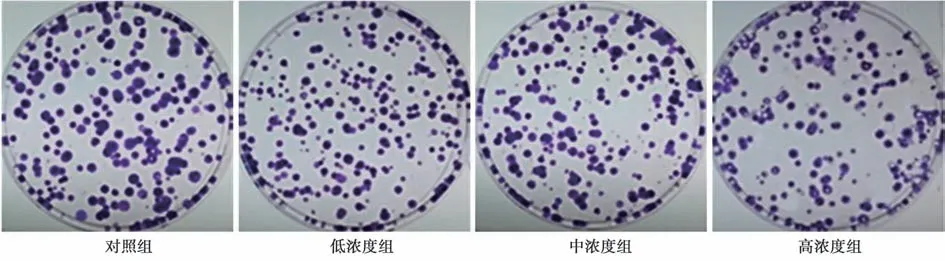
图1 萝卜硫素对SW480 细胞集落形成能力的影响(结晶紫染色,×40)
2.3 萝卜硫素对SW480 细胞侵袭能力的影响 与对照组SW480 细胞侵袭细胞数〔(85.26±9.19)个〕相比,低、中、高浓度组〔(69.09±8.95)个,(53.68±7.78)个,(39.94±6.26)个〕显著减少且呈浓度依赖性(P<0.05)。见图2。

图2 萝卜硫素对SW480 细胞侵袭能力的影响(结晶紫染色,×200)
2.4 萝卜硫素对SW480 细胞迁移能力的影响 与对照组 SW480 细 胞划痕愈 合率〔(94.47 ±10.56)%〕 相 比,低、中、高浓度 组〔(76.48 ±9.17)%,(61.17±9.69)%,(42.85±7.46)%〕显著降低,且呈浓度依赖性(均P<0.05)。见图3。

图3 萝卜硫素对SW480 细胞迁移能力的影响(×100)
2.5 萝卜硫素对SW480 细胞中Notch 通路的影响 与对照组相比,低、中、高浓度组SW480 细胞中Notch 通路相关蛋白Notch1、Notch3、Hes1 相对表达量均显著降低,且呈浓度依赖性(均P<0.05)。见表1,图4。
表1 萝卜硫素对SW480 细胞中Notch 通路、Ki-67、PCNA、MMP-9、E-cadherin 蛋白表达的影响(,n=6)
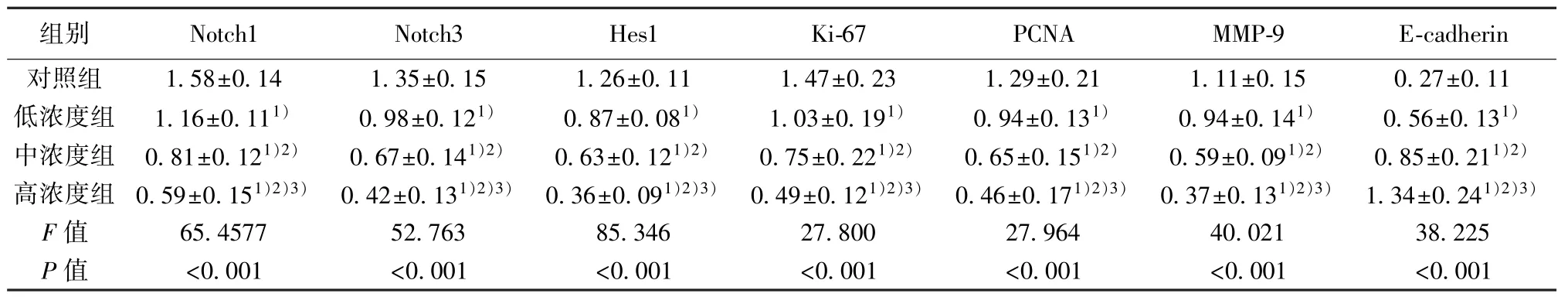
表1 萝卜硫素对SW480 细胞中Notch 通路、Ki-67、PCNA、MMP-9、E-cadherin 蛋白表达的影响(,n=6)
与对照组比较:1)P<0.05;与低浓度组比较:2)P<0.05;与中浓度组比较:3)P<0.05
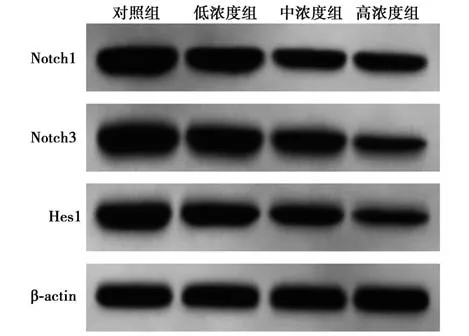
图4 萝卜硫素对SW480 细胞中Notch 通路的影响
2.6 萝卜硫素对SW480 细胞中增殖及迁移侵袭相关蛋白表达的影响 与对照组相比,低、中、高浓度组SW480 细胞中Ki-67、PCNA、MMP-9 蛋白相对表达量显著降低,E-cadherin 蛋白相对表达量显著升高,且均呈浓度依赖性(均P<0.05)。见表1,图5。
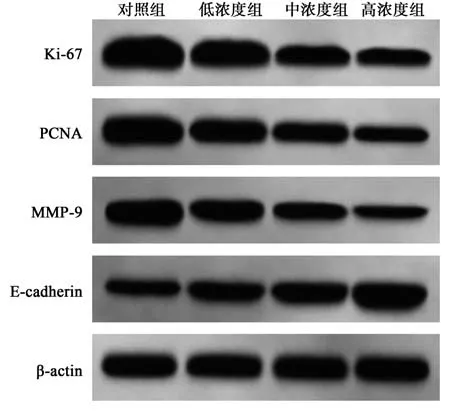
图5 萝卜硫素对SW480 细胞中Ki-67、PCNA、MMP-9、E-cadherin 蛋白表达的影响
3 讨论
结肠癌的发病率和死亡率仍呈逐年上升趋势,手术切除、放疗、化疗、生物治疗或分子靶向治疗是其常用临床治疗方式,随着科学技术的进步、综合治疗的发展,结肠癌患者的预后虽有一定程度改善,但肿瘤浸润深或有淋巴结转移的结肠癌患者生存率仍较低,且放疗、化疗副作用大,严重影响患者的生活质量〔9,10〕。
研究发现,萝卜硫素能够抑制人结肠癌HT-9细胞、SW620 细胞增殖,并诱导其凋亡,且抑制SW620 细胞侵袭及转移的机制可能与其降低MMP-2、MMP-9 蛋白表达有关〔11,12〕。顾文燕等〔13〕发现,萝卜硫素可通过上调Bax 表达促使结肠癌SW480细胞凋亡,并增强5-氟尿嘧啶对癌细胞化疗耐受的能力。本研究结果提示在1~40 μmol/L 浓度范围内,萝卜硫素能显著抑制SW480 细胞增殖,能呈浓度依赖性降低SW480 细胞集落形成、侵袭、迁移能力。Ki-67、PCNA 均与细胞增殖活性相关,研究发现,下调结肠癌HT-29 细胞裸鼠皮下移植瘤组织细胞中PCNA、Ki-67 的表达,可抑制移植瘤细胞增殖〔14〕;MMP 能够降解细胞外基质和基底膜促进肿瘤细胞侵袭和迁移,研究发现,下调MMP-9 表达能够显著抑制结肠癌LoVo 细胞的迁移和侵袭能力〔15〕;E-cadherin 作为一种钙依赖性黏附分子,其表达缺失可降低细胞黏附能力、增强其分散能力,研究发现,结肠癌HCT116 细胞的转移受抑制可能与上调E-cadherin 表达相关〔16〕。本研究结果提示萝卜硫素能够通过下调Ki-67、PCNA、MMP-9 蛋白表达,上调E-cadherin 蛋白表达,进而抑制SW480 细胞增殖、侵袭和迁移,与既往研究结果类似〔14~16〕。
Notch 信号通路作为高度保守的信号转导途径,其异常激活与肿瘤细胞增殖、侵袭、转移密切相关,目前发现该通路存在Notch1、Notch2、Notch3、Notch4 4 个受体,Hes1 为其常见的经典下游基因。研究表明,抑制过度激活的Notch1/Hes1 信号通路可抑制HT29 和HCT116 细胞等结肠癌细胞生长〔17〕。高蕊等〔7〕在SW480 细胞中发现,芦丁可以通过抑制Notch1 与Hes1 介导的细胞增殖分化途径实现对结肠癌的治疗作用。Wang 等〔18〕发现MicroRNA-206 可通过靶向下调Notch3 表达,进而抑制结直肠癌SW480 和SW620 细胞增殖和迁移。本研究结果提示萝卜硫素能明显抑制Notch 信号通路相关受体Notch1、Notch3 及下游基因Hes-1 蛋白表达,抑制Notch 信号通路激活。
