白花丹素通过调控Wnt 信号通路抑制肝癌MHCC97-H 细胞增殖、迁移和侵袭
2022-01-04郭丽赵虹张俊涛刘志贞弓韬于保锋
郭丽 赵虹 张俊涛 刘志贞 弓韬 于保锋
(1 临汾职业技术学院,山西 临汾 041000;2 山西医科大学生物化学与分子生物学教研室)
肝癌分为原发性和继发性两大类,其中原发性肝癌最为常见。肝细胞癌属于原发性肝癌,占所有肝癌病例的90%以上。肝癌在世界范围内具有较高的患病率,是全球癌症相关死亡率的第三大原因〔1〕。肝癌具有高度侵袭性、高复发率及高死亡率等特征,导致患者预后不良〔2〕。目前肝癌的治疗主要包括外科手术、放疗和化疗等综合治疗方式,但患者5 年生存率仍不能令人满意〔3〕。考虑到传统化疗和放疗的细胞毒性及对患者的毒副作用,因此亟需寻找低毒、高效且毒副作用较小的药物用于肝癌的治疗。近几十年来,中药在肿瘤治疗中展现出其独特的优势,已受到广大学者的广泛关注〔4〕。白花丹素(PLB)是从天然中药白花丹根部提取的有效活性成分,具有抗炎、镇痛、消肿等多种药理学功能。近期研究发现,白花丹素在抗肿瘤中扮演重要角色,包括前列腺癌、乳腺癌和舌鳞状细胞癌等〔5,6〕。目前尚未有报道阐明PLB 对肝癌MHCC97-H 细胞增殖、迁移和侵袭的影响及机制。Wnt 信号通路是机体中重要的信号转导通路,在多种疾病中发挥重要作用,包括肿瘤〔7〕。研究显示,Wnt 信号通路的异常激活与肝癌的发生和发展密切相关〔8〕。因此,本研究旨在探究PLB 对人肝癌MHCC97-H 细胞增殖、迁移和侵袭的影响及对Wnt 信号通路的调控作用。
1 材料与方法
1.1 细胞株和主要试剂 人肝癌MHCC97-H 细胞株(中国科学院上海细胞库);PLB、Wnt 激活剂氯化锂(LiCl,美国Sigma 公司);DMEM 培养基、胎牛血清(美国Gibco 公司);胰蛋白酶(美国Corning Cellgro 公司);CCK-8 试剂(日本同仁化学研究所);孔径为8 μm 的Transwell 小室、基质胶(美国BD 公司);除抗体外Western 印迹检测所需试剂(上海碧云天生物技术研究所);基质金属蛋白酶(MMP)-2、MMP-9、酶联免疫吸附试验(ELISA)检测试剂盒(上海江莱生物科技有限公司);Wnt1、β-连环蛋白(β-catenin)和生存素(Survivin)抗体及二抗(美国CST 公司)。
1.2 方法
1.2.1 细胞培养 人肝癌MHCC97-H 细胞复制后培养在含10%胎牛血清的DMEM 培养液中,放置在饱和湿度、体积分数为5%CO2、37℃恒温培养箱中,每隔2 d 更换1 次新的培养液,待MHCC97-H 细胞呈单层铺满培养瓶底90%以上时,使用0.25%胰蛋白酶消化细胞,以1 ∶3的比例进行传代,取生长状态良好的MHCC97-H 细胞用于后续研究。
1.2.2 CCK-8 法检测PLB 对MHCC97-H 细胞增殖的影响 对数生长期的MHCC97-H 细胞消化后计数,调整细胞浓度为5×104个/ml,取200 μl 细胞悬液接种到96 孔板中,置37℃恒温培养箱常规培养,待细胞贴壁后除去旧培养液,更换成含不同浓度(0.0、0.1、1.0、5.0、10.0、20.0 μmol/L)PLB 的培养液,其中0.0 μmol/L 设为空白对照(Blank 组),于37℃培养箱分别孵育24、48、72 h,每个浓度的每个时间点设置3 个复孔,在各个时间点向各孔细胞中加入10 μl CCK-8 溶液,继续孵育4 h,使用酶标仪测定波长在450 nm 处细胞的吸光度值,分别计算PLB 对MHCC97-H 细胞增殖抑制率和干预48 h 半数抑制浓度(IC50)。
1.2.3 细胞分组 将对数增殖期的MHCC97-H 细胞随机分为4 组:Blank 组、PLB 组、激活剂(LiCl)组和PLB+激活剂(PLB+LiCl)组。Blank 组MHCC97-H 细胞不作任何处理;PLB 组MHCC97-H 细胞以终浓度为4 μmol/L PLB 干预48 h;LiCl 组MHCC97-H细胞以浓度为20 nmol/L Wnt 激活剂LiCl 干预48 h;PLB+LiCl 组MHCC97-H 细胞以 终浓度 为4 μmol/L PLB 和浓度为20 nmol/L LiCl 干预48 h。
1.2.4 克隆形成实验检测MHCC97-H 细胞克隆形成能力 对数期的MHCC97-H 细胞按1.2.3 方法分组和处理后,以胰蛋白酶消化,按5×102/孔均匀的种植在6 孔板中,常规培养,每3 d 更换1 次新的培养液,14 d 后取出6 孔板,细胞用95%乙醇固定30 min,随后用4 g/L 结晶紫染色15 min,用蒸馏水洗去染液,风干后统计每孔中细胞克隆形成数,分别计算各组MHCC97-H 细胞克隆形成率,克隆形成率(%)=克隆形成数/接种细胞数×100%。
1.2.5 Transwell 实验检测MHCC97-H 细胞侵袭能力 Matrigel 基质胶融化后用无血清的培养液稀释成50 mg/L,铺于Transwell 小室的上室基底膜进行包被。各组MHCC97-H 细胞以胰酶消化,用无血清培养液饥饿处理12 h,将3×105个细胞接种到Transwell 小室的上室,下室缓慢加入600 μl 含15%胎牛血清的培养液,于常规培养箱继续孵育48 h,取出小室,用棉签擦去未穿过基底膜的细胞,以甲醇固定细胞,结晶紫染色,洗去染液,随后在倒置显微镜下观察穿膜细胞,分别计数各组穿膜细胞数。
1.2.6 划痕实验检测MHCC97-H 细胞迁移能力 对数期的MHCC97-H 细胞接种到6 孔板中,于37℃培养箱继续培养,待细胞单层铺满底部约90%时,用灭菌的枪头进行划痕,再用磷酸盐缓冲液(PBS)洗涤细胞,将划落的细胞洗去,随后按照1.2.3 方法分组和处理48 h,分别在处理0 h 和48 h 时在显微镜下拍照,计算各组MHCC97-H 细胞相对迁移率,相对迁移率(%)=(0 h 划痕距离-48 h 划痕距离)/0 h 划痕距离×100%。
1.2.7 ELISA 检测上清液中MMP-2 和MMP-9 含量 MHCC97-H 细胞按1.2.3 法分组和处理48 h,分别收集各组细胞上清液,参照ELISA 检测试剂盒使用说明书对MMP-2 和MMP-9 含量进行测定。
1.2.8 Western 印迹检测MHCC97-H 细胞中Wnt1、β-catenin 和Survivin 蛋白水平 MHCC97-H 细胞按1.2.3方法分组和处理48 h,收集细胞,加入RIPA裂解液提取总蛋白,使用BCA 蛋白浓度检测试剂盒对蛋白进行定量测定,蛋白加热变性,配制10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),取等量蛋白上样,行电泳分离蛋白,随后电转至聚偏氟乙烯(PVDF)膜上,在封闭液中孵育2 h,洗涤后加入稀释的相应一抗,Wnt1、β-catenin 和Survivin 一抗均为1 ∶800 稀释,4 ℃杂交过夜,洗涤后再加入1 ∶3 000稀释的二抗,室温孵育2 h,洗涤后采用电化学发光(ECL)显影,随后获取图像,以β-actin 进行标定,分别计算各组MHCC97-H 细胞中目的蛋白相对表达水平。
1.3 统计学方法 采用SPSS21.0 软件进行单因素方差分析、SNK-q检验。
2 结果
2.1 PLB 对MHCC97-H 细胞增殖抑制作用 不同浓度的PLB 对MHCC97-H 细胞增殖有不同程度的抑制作用,且呈浓度依赖性(均P<0.05)。见表1。与24 h 和72 h 相比,PLB 在干预48 h 时对MHCC97-H 细胞增殖抑制作用的随浓度的升高而快速增强,且未出现平台期,后续选取干预48 h 作为实验干预时间。计算获得PLB 干预MHCC97-H 细胞48 h 的IC50 为8.25 μmol/L,选取约1/2 IC50 浓度4 μmol/L 作为后续实验干预浓度。
表1 PLB 对MHCC97-H 细胞增殖抑制率的影响(,n=9,%)
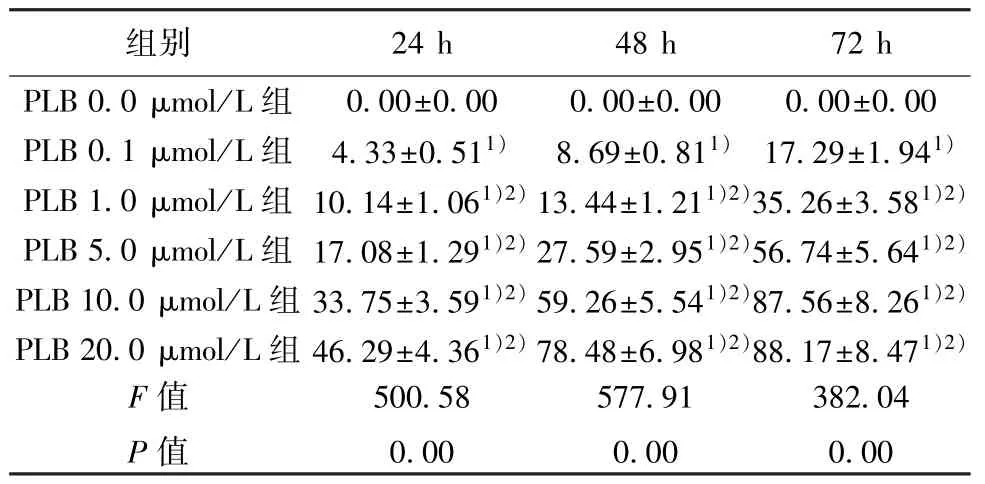
表1 PLB 对MHCC97-H 细胞增殖抑制率的影响(,n=9,%)
与PLB 0 μmol/L 组比:1)P<0.05;与同一时刻前一组比较:2)P<0.05
2.2 PLB 对MHCC97-H 细胞克隆形成能力的影响 与Blank 组比较,PLB 组MHCC97-H 细胞克隆形成率明显降低(P<0.05),而LiCl 组克隆形成率升高(P<0.05);与PLB 组比较,PLB+LiCl 组MHCC97-H细胞克隆形成率明显升高(P<0.05)。见表2。
表2 各组MHCC97-H 细胞克隆形成率、相对迁移率、穿膜MHCC97-H 细胞数、MMP-2 及MMP-9 水平比较(,n=9)
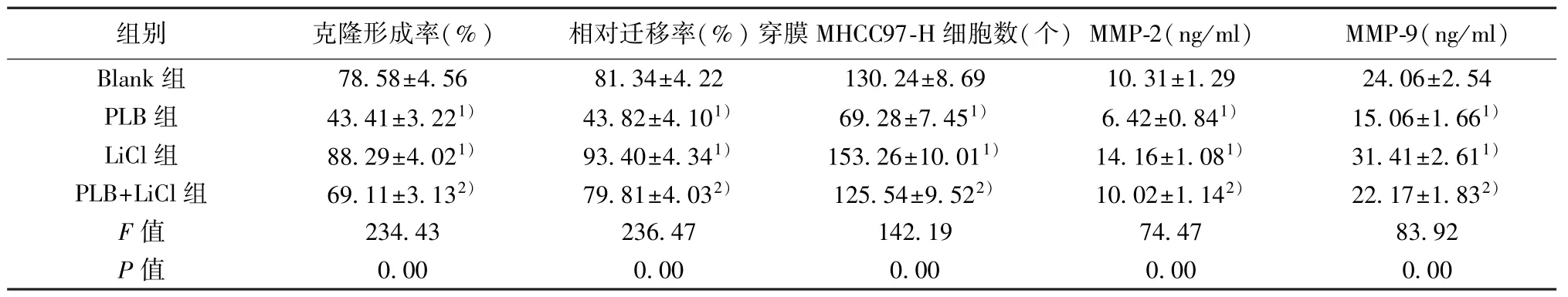
表2 各组MHCC97-H 细胞克隆形成率、相对迁移率、穿膜MHCC97-H 细胞数、MMP-2 及MMP-9 水平比较(,n=9)
与Blank 组比较:1)P<0.05;与PLB 组比较:2)P<0.05
2.3 PLB 对MHCC97-H 细胞迁移能力的影响 与Blank 组比较,PLB 组MHCC97-H 细胞相对迁移率明显降低(P<0.05),而LiCl 组MHCC97-H 细胞相对迁移率升高(P<0.05);与PLB 组比较,PLB+LiCl组MHCC97-H 细胞相对迁移率明显升高(P<0.05)。见表2。
2.4 PLB 对MHCC97-H 细胞侵袭能力的影响 与Blank 组比较,PLB 组穿膜MHCC97-H 细胞数明显减少(P<0.05),而LiCl 组穿膜MHCC97-H 细胞数增多(P<0.05);与PLB 组比较,PLB+LiCl 组穿膜MHCC97-H 细胞数明显增多(P<0.05)。见表2。
2.5 PLB 对MHCC97-H 细胞上清中MMP-2 和MMP-9 水平的影响 与Blank 组比较,PLB 组MHCC97-H 细胞上清液中MMP-2 和MMP-9 水平明显降低(P<0.05),而LiCl 组中MMP-2 和MMP-9 水平升高(P<0.05);与PLB 组比较,PLB+LiCl 组中MMP-2 和MMP-9 明显升高(P<0.05)。见表2。
2.6 PLB 对MHCC97-H 细胞中Wnt 信号活化的影响 与Blank 组比较,PLB 组MHCC97-H 细胞中Wnt1、β-catenin 和Survivin 蛋白表达水平明显下调(P<0.05),而LiCl 组中Wnt1、β-catenin 和Survivin蛋白表达水平明显上调(P<0.05);与PLB 组比较,PLB+LiCl 组中Wnt1、β-catenin 和Survivin 蛋白表达水平明显上调(P<0.05)。见图1、表3。
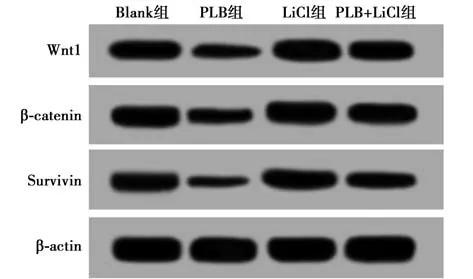
图1 Western 印迹检测MHCC97-H 细胞中Wnt1、β-catenin 和Survivin 蛋白的表达
表3 各组MHCC97-H 细胞中Wnt1、β-catenin 和Survivin 蛋白表达水平比较(,n=9)
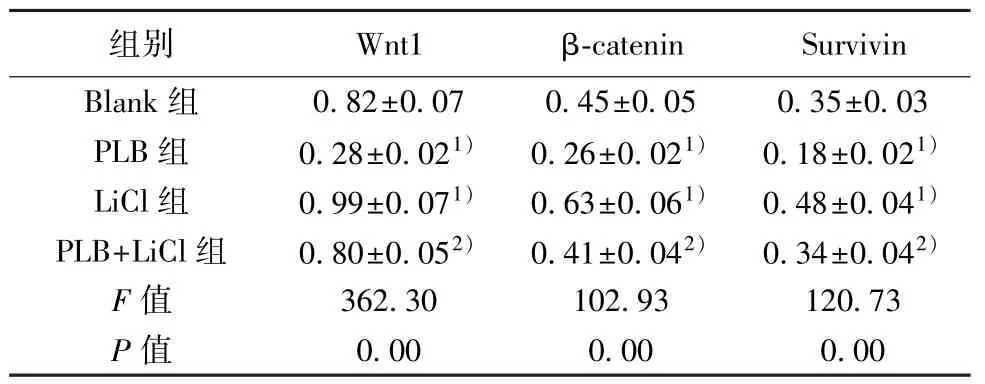
表3 各组MHCC97-H 细胞中Wnt1、β-catenin 和Survivin 蛋白表达水平比较(,n=9)
与Blank 组比较:1)P<0.05;与PLB 组比较:2)P<0.05
3 讨论
肝癌是全球癌症相关死亡的主要原因之一〔9〕。目前肝癌的治疗策略包括手术、化疗和放疗,由于化疗药物和电离辐射存在非特异性细胞毒性,在杀伤癌细胞的同时对正常细胞也产生毒害作用,因此导致其对患者的毒副作用较大;加之患者产生耐药性和化疗耐受性大大影响了肝癌的治疗效果〔10〕。中药用于临床治疗各种癌症包括肝癌,可延缓并发症的发生,提高患者的生活质量〔11〕。多项研究表明,PLB 对黑色素瘤、胃癌和食管癌等多种恶性肿瘤细胞有明显的抑制作用〔12,13〕。研究显示,PLB 处理通过抑制PI3K/Akt 途径降低人舌鳞状细胞癌CAL27细胞活力和集落形成,并增加细胞凋亡〔14〕。研究显示,PLB 通过减少STAT3 的磷酸化抑制食管鳞状细胞癌细胞的生长〔15〕。Kang 等〔16〕研究发现,PLB 通过抑制由FAK/AKT 途径介导的Rho 相关激酶途径降低了骨桥蛋白诱导的非小细胞肺癌A549 细胞的侵袭,抑制骨桥蛋白诱导的Balb/c 小鼠肺转移。朱德强等〔17〕研究发现,PLB 能抑制索拉菲尼耐药细胞HepG2R 增殖,促进细胞凋亡,通过提高HepG2R 细胞中活性氧(ROS)含量来改善对索拉菲尼的耐药性。然而,PLB 对肝癌MHCC97-H 细胞增殖、迁移和侵袭的影响及分子机制尚不清楚。
本研究提示PLB 在肝癌中发挥抗肿瘤的作用,这与以往研究〔18〕相符。MMP-2 和MMP-9 均通过降解细胞外基质成分赋予细胞转移能力,在肿瘤侵袭和迁移中发挥重要作用〔19〕。本研究结果提示PLB可通过调控MMP-2 和MMP-9 的表达抑制MHCC97-H 细胞迁移和侵袭。Wnt 信号通路在正常胚胎发育和中枢神经系统中起关键作用,此外,它还调节细胞生长、迁移和分化等多种生物学行为〔20〕。研究表明,Wnt 信号通路在多种类型的癌症中激活失调,因此,阻断Wnt 信号传导途径是癌症治疗的策略〔21,22〕。β-catenin 在Wnt 信号传导途径中起关键作用,细胞质中β-catenin 通常通过蛋白酶体降解维持在较低水平。Wnt1 蛋白与卷曲蛋白受体的结合导致未磷酸化的β-catenin 积累,其转移到细胞核中并激活Wnt 靶基因的表达,包括Survivin〔23,24〕。Survivin 是主要抗癌靶标之一,其属于凋亡抑制因子,参与细胞分裂和凋亡抑制,可与β-catenin 相互作用调控肿瘤细胞的增殖〔25〕。本研究结果提示PLB 能抑制Wnt 信号通路的激活。此外,本研究结果表明PLB 可通过调控Wnt 信号通路抑制MHCC97-H 细胞增殖、迁移和侵袭。
综上,PLB 可抑制肝癌MHCC97-H 细胞增殖、迁移和侵袭能力,其作用机制可能与阻断Wnt 信号通路的激活有关。然而,在Wnt 信号通路中存在多个上游及下游靶基因,并且在肝癌靶向中存在复杂的调控网络,因此有待后续实验深入探究。
