微管不稳定蛋白在肺腺癌中的临床及生物学意义
2022-01-04王清王宋平曾超龙
王清 王宋平 曾超龙
(1 西南医科大学附属医院呼吸一科,四川 泸州 646000;2 成都市龙泉驿区龙泉平安社区卫生服务中心住院部;3 成都市温江区天府街道社区卫生服务中心)
肺腺癌是常见的肺脏原发恶性肿瘤之一〔1〕,恶性程度高,疾病进展速度快,现有的治疗手段尚不能取得满意的远期疗效〔2〕。因此,探究肺腺癌的分子疾病特征对提高我国肺癌治疗水平有重要价值。微管不稳定蛋白(Stathmin)是一种进化上高度保守的可溶性蛋白质〔3〕,研究发现Stathmin 在骨肉瘤〔4〕、食管癌〔5〕中有促癌作用。但Stathmin 在肺腺癌中的表达、临床价值及生物学功能尚未见报道。本研究通过临床数据分析及体外细胞学实验等方法,旨在初步探索Stathmin 在肺腺癌中的临床价值及对肺腺癌细胞迁移和侵袭能力的影响。
1 材料与方法
1.1 材料 收集2015 年1 月1 日至2017 年1 月1日西南医科大学附属医院胸外科行手术切除的肺腺癌组织及对应癌旁组织标本50 例,患者年龄45~72 岁,中位年龄为54 岁。兔抗人SP 免疫组化试剂盒购自北京中杉金桥生物科技有限公司;A549 细胞购自苏州思瑞坦细胞公司;Stathmin 一抗(ab52630)购自美国Abcam 公司;RNA 提取试剂Trizol(#15596026)、转染试 剂 LipofectamineTM3000(#L3000015)及RT-PCR 试剂盒(#10928042)均购自美国Invitrogen 公司;SYBR Green 实时荧光定量聚合酶链反应(PCR)试剂盒(#1725120)购自美国BIO-RAD 公司;Stathmin 引物(上游5'-TGATTCTCAGCCCTCGGT-3';下 游5'-TCAAGACTTCCGCCTCAT-3'),GAPDH 引物(上游5'-CCAGGGCTGCTTTTAACTCT-3';下 游5'-GGACTCCACGACGTACTCA-3');Transwell 小室购自美国康宁公司;基质胶购自美国B&D 公司;Stathmin shRNA 质粒及阴性对照质粒购自广州复能基因有限公司。
1.2 免疫组化检测组织中Stathmin 表达 甲醛固定-石蜡包埋的组织切片常规脱蜡、水化及微波抗原修复,分别用3%过氧化氢及10%山羊血清封闭切片。用磷酸盐缓冲液(PBS)溶液按1 ∶100 比例配制Stathmin 一抗工作液,覆盖组织切片,4℃摇晃、孵育过夜。PBS 溶液洗净未结合一抗后,使用辣根过氧化物酶标记的山羊抗兔二抗结合相应一抗,DAB 法显示阳性蛋白。按文献〔6〕方法计算切片染色得分:无阳性染色细胞为0 分,<25%为1 分,25%~50%为2 分,51%~75%为3 分,>75%为4 分。
1.3 逆转录实时荧光定量(qRT)-PCR 检测Stathmin 表达 使用Trizol 试剂按操作指南提取A549细胞总RNA。取等量RNA 配制20 μl 的逆转录反应体系合成cDNA。cDNA 稀释10 倍后取5 μl 配制实时荧光定量PCR 体系,按如下条件进行PCR:95℃预变性30 s,1 循环;95℃变性5 s,60℃退火延伸30 s,40 循环。以GAPDH 作为内参,采用2-△△Ct法计算Stathmin mRNA 的相对表达量。
1.4 质粒瞬时转染 A549 细胞以过夜培养达50%~70%密度接种于6 孔板中。Stathmin 质粒转染分组:阴性对照(sh-ctrl)组每孔加入4.0 μg 的阴性对照质粒及10 μl 转染试剂,Stathmin(sh-Stathmin)组每孔加入4.0 μg 的Stathmin shRNA 质粒及10 μl 转染试剂;以无血清DMEM 培养基调整终体积为2 ml/孔。转染48 h 后进行下一步试验。
1.5 Transwell 迁移与侵袭小室实验 收集转染48 h后的A549 细胞,以无血清DMEM 培养基重悬后调整细胞密度为1×105/ml,按250 μl 每孔接种于Transwell 小室上室中,24 孔板内每孔加入750 μl 含10%胎牛血清(FBS)的DMEM 培养基。培养箱内培养24 h 后弃去上室内培养基,PBS 洗涤2 遍后采用4%多聚甲醛固定,结晶紫染色,棉棒擦去上室面残余细胞,在200×显微镜下观察下室面细胞并计数迁移细胞数目。用1×DMEM 按8 ∶1稀释50 mg/L 的基质胶,按100 μl 每孔包被Transwell 小室底膜上室面,4℃风干后放入24 孔板内,重复上述步骤,计数侵袭细胞数目。
1.6 统计学方法 采用SPSS22.0 软件进行χ2检验、t检验、Kaplan-Meier 检验。
2 结果
2.1 Stathmin 在肺腺癌组织中的表达及临床意义 肺腺癌组织Stathmin 平均表达水平(3.82±0.39)明显高于对应癌旁组织(1.23±0.41,t=6.228,P=0.004)。见图1。以肺腺癌组织Stathmin 平均表达值为截断点,分为Stathmin 高表达组和Stathmin 低表达组。Stathmin 高表达与肿瘤淋巴结转移密切相关(P=0.036)。见表1。Kaplan-Meier 分析显示,高表达Stathmin 的肺癌患者术后总体生存期(HR=2.333,P=0.004)及无病生存期(HR=2.125,P=0.006)均较短。见图2。

图1 Stathmin 在肺腺癌组织中表达(DAB,×400)
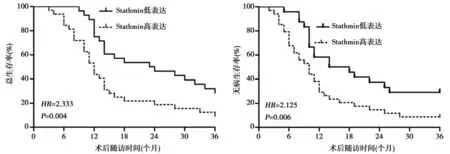
图2 Stathmin 表达水平对肺腺癌患者预后的影响
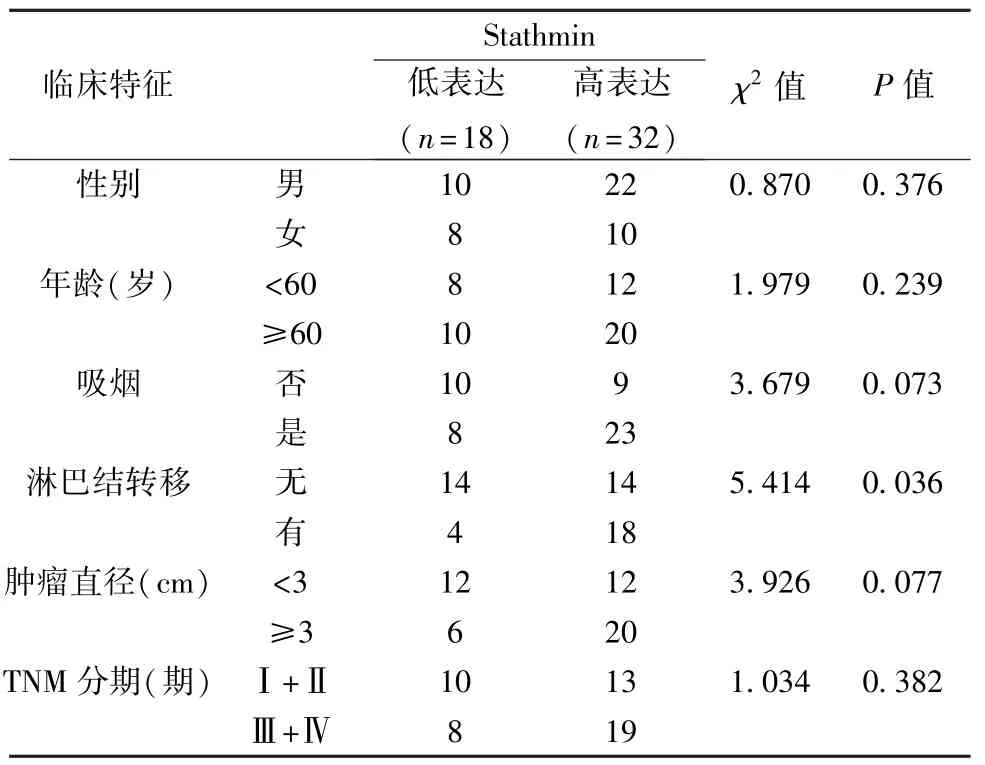
表1 Stathmin 异常表达在肺腺癌中的临床意义〔n(%)〕
2.2 沉默Stathmin 抑制A549 细胞迁移和侵袭 sh-ctrl 组A549 细胞内Stathmin 表达水平(0.86±0.24)明显高于sh-Stathmin 组(0.21±0.11,t=4.414,P=0.013)。见图3。sh-Stathmin 组迁移细胞数目〔(21.11±3.25)个〕明显低于sh-ctrl 组〔(42.38±5.01)个,t=2.511,P=0.032〕;sh-Stathmin 组侵袭细胞数目〔(10.29 ±2.04)个〕 明显低于sh-ctrl组〔(23.46±3.18)个,t=2.623,P=0.028〕。见图4。

图3 Western 印迹检测各组Stathmin 的表达
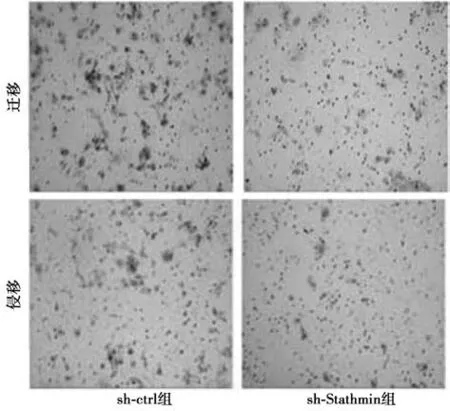
图4 沉默Stathmin 表达影响A549 细胞迁移及侵袭(结晶紫,×200)
3 讨论
生物学文献〔7〕表明,Stathmin 是一种对生物体器官发育有关键调控作用的基因,其基因的突变、异常修饰及缺失将引起多种先天性疾病的发生。本研究结果证实Stathmin 高表达与肿瘤淋巴结转移及患者不良预后密切相关。研究显示,Stathmin 高表达的宫颈癌患者临床分期及淋巴结转移率更高、5 年生存率更低〔8〕,在胃癌〔9〕和结肠癌〔10〕中也有相似的研究结果。提示Stathmin 可能是一种潜在的肿瘤标志物。研究还显示,Stathmin 在动物体内还有抑制肿瘤增殖的能力〔11〕。综上,Stathmin 表达下调与肺腺癌恶性临床特征密切相关,其作为一种促癌基因,在抗肺腺癌细胞转移的过程中发挥重要作用。研究〔12,13〕结果指出miRNA 的异常表达可能是Stathmin 在肿瘤细胞中高表达的原因之一,值得在今后的研究中进一步探索。
