花鲈性腺分化组织学及性别相关基因cyp11b和cyp19a1a的表达分析*
2022-01-04李冰玉温海深王灵钰李金库
李冰玉 温海深 王灵钰 李金库 齐 鑫 李 昀
花鲈性腺分化组织学及性别相关基因和的表达分析*
李冰玉 温海深 王灵钰 李金库 齐 鑫 李 昀①
(中国海洋大学 海水养殖教育部重点实验室 山东 青岛 266003)
以花鲈() 1~214 dph (day post hatching)的仔稚鱼、幼鱼以及18月龄的雌鱼和雄鱼为研究对象,研究了花鲈早期性腺发生、发育和分化情况;分析了性腺分化过程中性别相关基因(和)的表达及与性别之间的关系。结果显示,在30 dph [全长为(1.28± 0.10) cm],首次在中肾管前端的腹腔膜周围观察到原始生殖细胞(primordial germ cells, PGCs),说明30 dph前是花鲈胚后PGCs迁移至生殖嵴的关键时期;在55 dph [全长为(2.45±0.19) cm],观察到一对呈对称分布的原始性腺已经形成,说明花鲈幼鱼的原始性腺在30~55 dph (全长为1.28~2.45 cm)之间发生;55~180 dph时(全长为2.45~12.28 cm),原始性腺不断发育变大,并且一直处于未分化状态;180 dph后性腺开始分化;在195 dph [全长(14.54±1.54) cm]观察到精巢开始分化,卵巢于205 dph [全长为(15.86±0.94) cm]开始分化,且性腺的解剖学分化要早于细胞学分化;18月龄的花鲈幼鱼性腺发育到Ⅱ期。性别分化相关基因在花鲈卵巢中的表达量高于同期精巢,说明其在卵巢的分化及维持中发挥更关键的作用,而在18月龄幼鱼Ⅱ期精巢中的表达量显著高于同时期的卵巢及Ⅰ期精巢,说明其主要在精巢的分化及维持中扮演重要角色。本研究结果不仅可以丰富花鲈的繁殖生理学资料,也为其性别调控技术的研究提供了科学依据。
花鲈;性别分化;组织学;;
原始生殖细胞(primordial germ cells, PGCs)作为鱼类生殖细胞系的祖先,在胚胎发育的早期阶段从体细胞中分化出来(宋卉等, 2004)。在组织学上,PGCs呈现体积大、圆形或椭圆形、具有一个大且明亮的圆形细胞核、细胞质为嗜酸性等生物学特征(游秀容, 2012)。在胚胎发育过程中,PGCs按照特定的迁移路线到达生殖嵴的位置,与周围体细胞共同发育形成原始性腺,即未分化的性腺。在硬骨鱼类中,雌雄异体型是最常见的性腺分化类型,具有双向分化潜力的未分化性腺直接发育为卵巢或精巢,此后性别保持终身不变(杨阳, 2018)。
鱼类作为低等脊椎动物,具有多种性别决定方式,主要为基因型性别决定、环境型性别决定和基因–环境相互作用型性别决定(Strüssmann, 2002)。随着分子生物技术的快速发展,鱼类性别决定基因或相关基因也被不断鉴定,主要有、、、以及芳香化酶基因等(李云航等, 2011; 路畅等, 2014; 文爱韵等, 2008)。性别相关基因又可进一步分为精巢分化相关基因和卵巢分化相关基因。其中,性腺芳香化酶基因通常在卵巢分化过程中呈高表达,因为编码的性腺芳香化酶可将雄激素转化为雌激素,从而促进卵巢分化(Kishida, 2001; Kobayashi, 2010; Tang, 2010; Si, 2016)。而其旁系同源基因则属于精巢分化相关基因,编码的11β-羟化酶可促进雄激素的合成,从而阻碍卵巢的分化,导致精巢分化(Blázquez, 2009; Driscoll, 2020)。

1 材料与方法
1.1 实验材料
2019年10—11月在山东省东营市利津县双瀛水产苗种有限责任公司,对来自黄渤海的花鲈亲鱼群体进行人工催产及人工授精,获取同批次受精卵,受精卵孵化后的花鲈仔稚鱼培育参考温海深等(2019)的方法进行。培养条件:水温为15℃~20℃,盐度为28~30,pH为7.5~8.0,溶解氧>5.0 mg/L,总氨氮<1.0 mg/L。
1.2 样品采集
自初孵仔鱼开始,每隔10 d左右取样1次,每次随机选取20尾鱼。取样时,先用适量MS-222 (200 mg/L)麻醉,测量全长及体长。当全长<2 cm时,全鱼固定于波恩氏液中;当全长为2~10 cm时,取含性腺的躯干部分固定;当全长>10 cm,性腺可以单独剥离时,取其中一部分性腺用波恩氏液固定,另一部分置于液氮中快速冷冻,‒80℃保存,用于RNA提取。
1.3 石蜡组织切片
含性腺的组织经波恩氏液固定24 h后,经70%~ 100%梯度乙醇脱水(70%乙醇40 min,80%乙醇40 min,95%乙醇35 min×2,100%乙醇25 min×2),二甲苯透明(1/2乙醇+1/2二甲苯混合液15 min,二甲苯15 min×2),浸蜡(石蜡20 min×3),石蜡包埋,然后连续切片为5~ 7 μm的组织片,经苏木精–伊红(HE)染色,中性树脂封片后镜检观察。
1.4 总RNA提取及cDNA合成
使用Trizol法提取性腺总RNA,并利用核酸测定仪(OSTC, 中国)检测提取后的OD值及RNA浓度。同时进行1.5%琼脂糖凝胶电泳,检测RNA的完整性。将RNA浓度调至500 ng/µL,使用反转录试剂盒[HiScript®Ⅲ RT SuperMix for qPCR (+gDNA wiper)] (诺唯赞, 中国)反转录为cDNA,反应体系和反应条件:(1)去除基因组DNA:总RNA 1 µL,4× gDNA wiper Mix 4 μL, RNase-free ddH2O加至16 µL,在42℃反应2 min;(2)反转录:上述反应产物16 μL,5×HiScript Ⅲ qRT SuperMix 4 μL,37℃反应15 min后,85℃反应5 s。
1.5 实时荧光定量PCR
(MN685653)和(MN685656)基因序列来源于NCBI (https://www.ncbi.nlm.nih.gov/)。利用Primer Premier 5软件设计引物,并由华大基因Oligo合成,所用引物序列见表1。使用ChamQTMSYBR®qPCR Master Mix (High ROX Premixed)试剂盒(诺唯赞, 中国),StepOnePlusTMReal-Time PCR系统(Applied Biosystems, 美国)进行实时荧光定量PCR (RT-qPCR),20 μL反应体系:2 µL cDNA,10 µL ChamQTMSYBR Color qPCR Master Mix,上下游引物各0.4 µL,7.2 µL ddH2O。qPCR扩增反应条件:95℃预变性30 s;95℃ 10 s,60℃ 30 s,72℃ 30 s,40个循环。RT-qPCR实验均包括4个生物学重复和3个技术学重复。以18S作为花鲈内参基因(Wang, 2018),使用2‒ΔΔCt方法进行数据计算,采用SPSS 21.0统计软件进行单因素方差分析(one-way ANOVA),当<0.05时为差异显著。
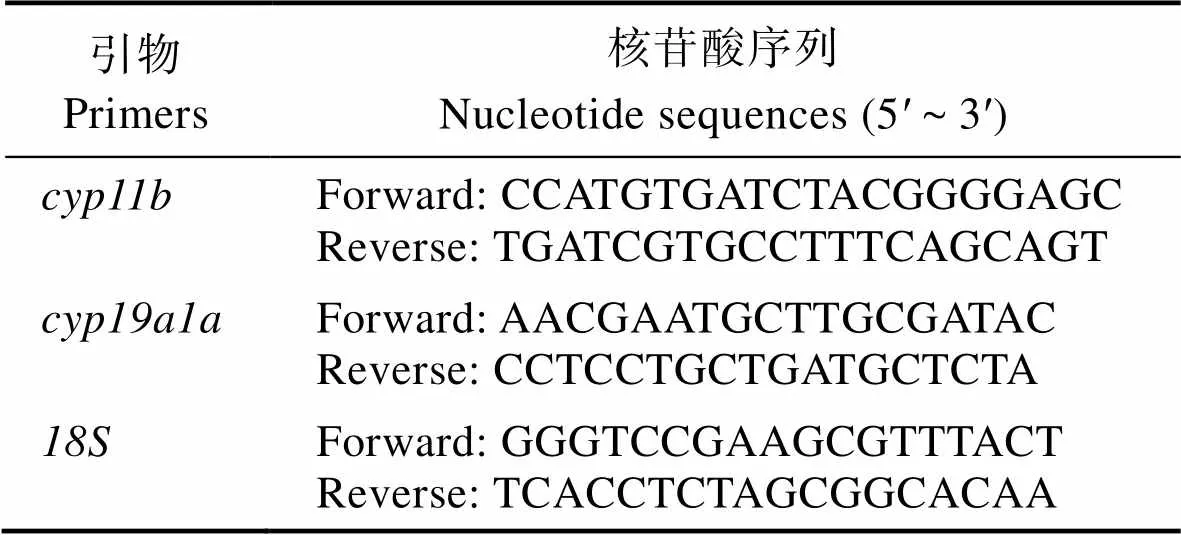
表1 qPCR特异性引物
2 结果
2.1 花鲈性腺形成及分化
取样期间,随着天数的增加,花鲈全长呈平稳增长趋势。在180 dph (days post hatching),花鲈平均全长为(12.28±1.30) cm,此前性腺处于未分化状态,自此性腺开始出现组织学分化(图1)。

图1 花鲈全长与孵化后天数之间的关系
2.1.1 原始性腺的形成和未分化性腺的发育 30 dph,仔鱼平均全长为(1.28±0.10) cm。如图2A所示,PGCs迁移到中肾管前端的腹腔膜周围。PGCs呈圆形或椭圆形,直径处于(6.48~7.26) μm之间,具有一个大且明亮的圆形细胞核,被苏木精浓染成紫色,而细胞质呈嗜弱酸性,着色较浅。

图2 花鲈原始性腺和未分化性腺的发育
55 dph,稚鱼平均全长为(2.45±0.19) cm。此时观察到PGCs已迁入生殖嵴中,并且一对原始性腺已经形成,呈对称分布,从腹腔后侧的肠系膜出发向前延伸。原始生殖细胞在原始性腺中排列较稀疏,周围有丰富的结缔组织(图2B)。
80 dph,幼鱼平均全长为(4.33±0.34) cm。牵引性腺一端的系膜变长,另一端持续向腹部延伸,体积明显增大,呈梨形,其中生殖细胞数量显著增加(图2C)。
125 dph,幼鱼平均全长为(6.83±0.49) cm。性腺继续生长,横切面平均长度为(100.45±9.20) μm,宽度为(38.90±4.15) μm (图2D)。
180 dph,幼鱼平均全长为(12.28±1.30) cm,原始性腺横切面平均长度增长至(187.36±19.18) μm,宽度为(49.02±4.32) μm (图2E)。此时伴随着有丝分裂的不断进行,性原细胞逐渐被体细胞包绕形成生殖细胞囊,散布在整个性腺中。
2.1.2 精巢和卵巢的早期分化 195 dph,花鲈幼鱼平均全长为(14.54±1.54) cm,在靠近背部的区域出现裂缝状的输精管,表明在解剖学上精巢已经开始分化,此时为Ⅰ期精巢。Ⅰ期精巢的横切面为三角形,通过系膜与鳔组织相连,并且周围结缔组织丰富;在靠近腹部的边缘区域观察到数个精原细胞(图3A)。当精巢发育至205 dph时,靠近腹部的区域已被隔膜分割成很多小叶状结构,但排列较稀松(图3B)。215 dph,精巢继续发育,伴随着精原细胞强烈的有丝分裂,精小叶的排列变得紧密,形状不规则。精小叶由一圈精原细胞囊构成,每个生殖细胞囊周围都由1个或多个着色很深的sertoli前体细胞围绕;精小叶中间形成一个空腔即小叶腔,待精子成熟后可将其排出体外。精原细胞呈圆形或椭圆形,细胞核大而圆,占整个胞体体积的4/5,并且有一个着色很深的核仁,相反细胞质不易着色(图3C)。
205 dph,花鲈幼鱼平均全长为(15.86±0.94) cm。如图3D~E所示,此时在性腺中部出现一条较整齐的细长条裂缝,将来发育为卵巢腔,这标志着组织学上卵巢的分化。Ⅰ期卵巢的横切面呈弯曲的梨形,靠近背部丰富的结缔组织和血管组织,卵原细胞分散的排列在性腺中。此时,仅凭大小和形态上的区别不能将卵原细胞和精原细胞区分开。
215 dph,幼鱼平均全长为(17.20±1.28) cm。在卵巢中,随着性腺的分化,卵巢腔逐渐向外围延伸形成完整的腔体结构,此时产卵板开始形成,逐渐向卵巢腔内延伸,产卵板外侧分布着卵原细胞。卵原细胞形态同精原细胞一样呈圆形或椭圆形,胞质较少,着色浅,大而圆的细胞核呈嗜碱性着色较深(图3F)。

图3 花鲈精巢和卵巢的早期分化
2.2 18月龄花鲈幼鱼Ⅱ期精巢和卵巢的发育
18月龄花鲈幼鱼性腺发育到Ⅱ期。Ⅱ期精巢在解剖镜下观察到与Ⅰ期精巢组织结构相似,但血管组织增多。此阶段管腔内的生殖细胞主要包括精原细胞和初级精母细胞,与精原细胞相比,初级精母细胞体积明显缩小,但细胞核的嗜碱性增强(图4A~B)。
Ⅱ期卵巢与Ⅰ期卵巢相比,产卵板变宽变长,呈大小不一的细长板状紧密排列在卵巢腔四周。此阶段仍有少量的卵原细胞,但大部分已停止有丝分裂,进入初级卵母细胞的小生长期阶段,此时的卵母细胞体积明显大于卵原细胞,核膜清晰,胞质增多且呈强嗜碱性,被染成深紫色,而细胞核则不易被染色,但核内有数个染成蓝紫色的核仁(图4C~D)。

图4 花鲈Ⅱ期精巢和卵巢
2.3 cyp11b和cyp19a1a基因的表达
利用RT-qPCR技术测定了花鲈芳香化酶基因和在性别分化初期幼鱼Ⅰ期精巢和卵巢以及18月龄幼鱼Ⅱ期精巢和卵巢中的相对表达水平,结果如图5所示。
在性别分化初期幼鱼的Ⅰ期性腺中,在精巢中的表达量显著高于卵巢。随着性腺的发育,在18月龄幼鱼Ⅱ期精巢中,的表达量显著高于同时期的卵巢及Ⅰ期精巢(图5A)。相反,在性别分化初期幼鱼的Ⅰ期卵巢中的表达量显著高于同时期精巢,在Ⅱ期卵巢中的表达量高于同时期的精巢,但明显低于Ⅰ期卵巢(图5B)。
3 讨论
3.1 性腺的发生及分化
PGCs作为鱼类生殖细胞系的祖先,在胚胎发育的早期阶段就已经形成(宋卉等, 2004),然后按照特定的迁移路线到达生殖嵴的位置,与周围体细胞共同发育形成原始性腺。在不同鱼类中,原始性腺发生的时间各不相同。红鳍东方鲀()于12 dph观察到一对原始性腺的形成(胡鹏等, 2015);大黄鱼()于20 dph观察到由系膜悬挂在腹膜上皮上的原始性腺(游秀容, 2012);牙鲆()的原始性腺于22 dph形成于肾脏腹腔后方(杨阳, 2018);许氏平鲉()的原始性腺于25 dpb (day post birth)起逐渐发育(王孝杰等, 2019)。在花鲈中,30 dph首次在性腺原基区域观察到PGCs的出现,55 dph观察到线形原始性腺已经形成,因此,推测30 dph前是花鲈胚后PGCs迁移至生殖嵴的关键时期,原始性腺发生在30~55 dph之间。
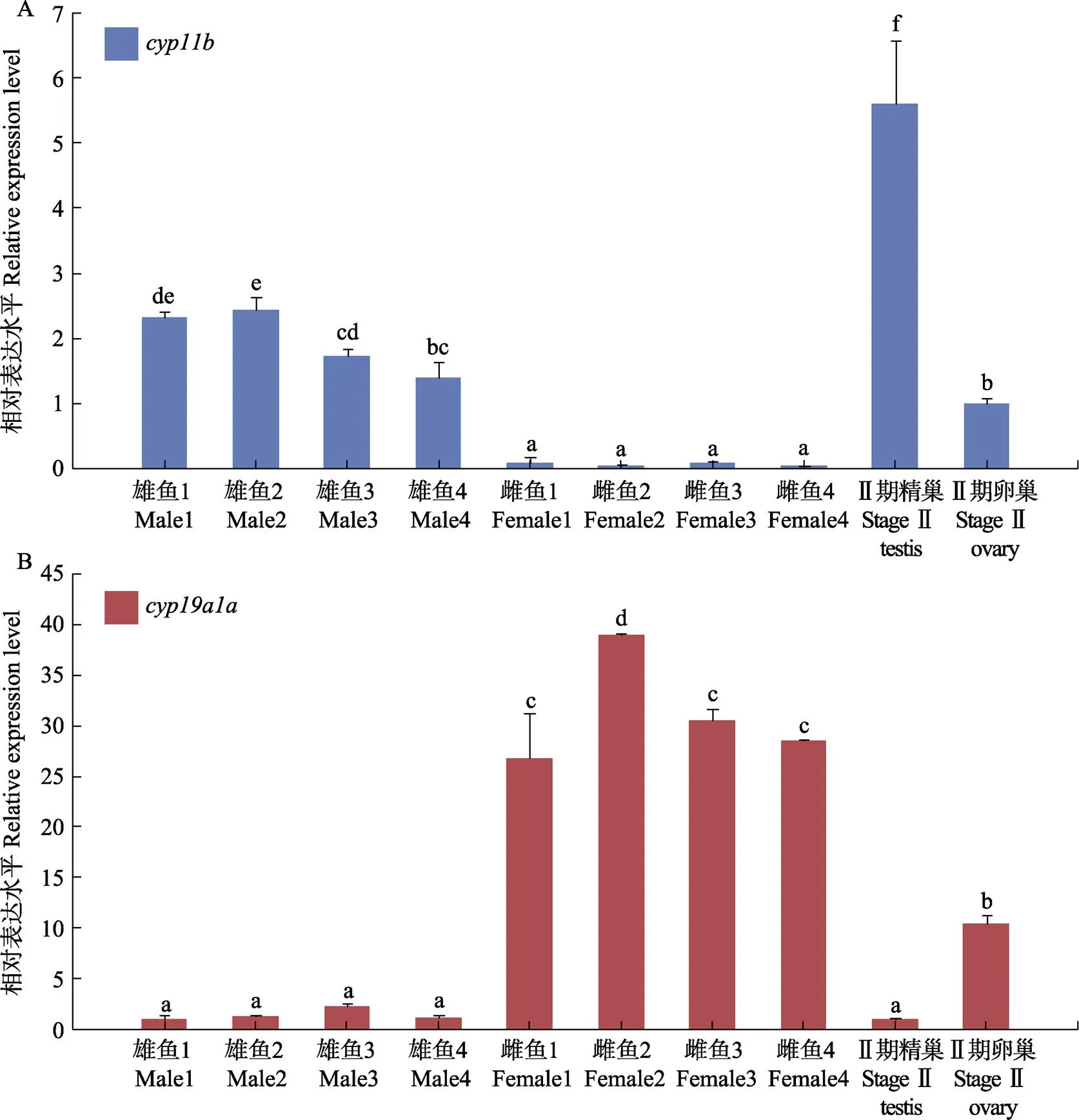
图5 cyp11b和cyp19a1a在性别分化初期(Ⅰ期)及Ⅱ期精巢和卵巢中的相对表达水平
在硬骨鱼类中,雌雄异体型是最常见的性腺分化类型,大多数雌雄异体的鱼类未分化性腺将直接分化为卵巢或精巢(Devlin, 2002)。鱼类的性腺分化包括解剖学分化和细胞学分化2个方面,解剖学分化是指卵巢腔、输精管和血管的形成等组织形态的变化,细胞学分化的标志为生殖细胞开始进入减数分裂(宋卉等, 2004)。一般解剖学分化早于细胞学分化 (党广成等, 2011; 杨阳, 2018)。不同鱼类的性腺分化时间存在较大差异,即使是同一物种,雌性和雄性的性腺分化时间也不同。在许氏平鲉中,35 dpb时卵巢腔开始形成,68 dpb时输精管开始形成(王孝杰等, 2019)。大黄鱼卵巢的解剖学分化开始于55日龄,精巢的解剖学分化开始于95日龄(游秀容, 2012)。在圆斑星鲽()中,60日龄的雌鱼性腺开始出现卵巢腔,而同时期的雄鱼没有明显的性腺分化特征(杨珍珍等, 2020; 张乐乐, 2018)。在斑石鲷()中,120日龄观察到输精管原基的出现,150日龄观察到卵巢腔的出现(赵玉柱等, 2020)。花鲈幼鱼在180 dph时,性腺还处于未分化状态(图2E),随后在195 dph时观察到输精管的出现,表明精巢在解剖学上开始分化,于207 dph观察到卵巢腔的形成,表明卵巢解剖学分化已经开始,在此阶段雌雄性腺均未出现细胞学分化的标志。这说明与大多数鱼类一样(杨阳, 2018; 游秀容, 2012; 张乐乐, 2018),花鲈性腺的解剖学分化要早于细胞学分化。
3.2 cyp11b和cyp19a1a在精巢和卵巢中的表达
在鱼类性别决定和分化过程中,性类固醇激素发挥重要作用。芳香化酶基因属于细胞色素P450超家族的成员,这种复合酶可将雄激素转化为雌激素,而雌激素是促进卵巢分化的重要因子(Simpson, 2002)。在鱼类中,存在性腺芳香化酶和脑芳香化酶 2种类型,分别由和编码(Kishida, 2001)。基因在脊椎动物中以高度保守的方式在性别决定的早期表现出性别二态性,在雌性性腺中呈现高表达,这使得该基因成为性别决定和卵巢分化的关键因子(王金等, 2014; Driscoll, 2020)。在尼罗罗非鱼() (Ijiri, 2008)、齐口裂腹鱼() (Yan, 2019)、茅耙丽鱼() (Driscoll, 2020)等多种鱼类卵巢中的表达量显著高于精巢,都表明其在卵巢发育中发挥更重要作用,而其在精巢中也存在低表达,是因为通过芳构化产生的低水平雌激素对精子形成是必要的(Schulz, 2010)。细胞色素P450家族的另一个成员11β-羟化酶基因()是催化11-酮基睾酮(11-KT)合成所必需的,而11-KT是硬骨鱼类内源性的雄激素,对阻碍卵巢分化并导致精巢的分化及维持有重要作用(王婷茹, 2013; Driscoll, 2020)。在尼罗罗非鱼(Ijiri, 2008; 康恺等, 2020)、虹鳟() (Vizziano, 2007)、日本鳗鲡() (Jianga, 1996)等多种硬骨鱼的精巢分化早期阶段都被检测到高表达。更重要的是,在与花鲈进化关系很近的欧洲鲈中,和的表达差异可在组织学水平性别分化迹象前1个月检测到,它们分别与未来的雌雄表型有明显的相关性,因此,它们可作为组织学上未分化欧洲鲈表型性别预测的早期分子标记(Blázquez, 2009)。本研究表明,在花鲈性别分化初期(Ⅰ期)以及性腺发育到Ⅱ期的雌鱼和雄鱼中,在Ⅰ期和Ⅱ期精巢中的表达都显著高于卵巢,相反,在Ⅰ期和Ⅱ期卵巢中的表达都显著高于精巢,与在其他硬骨鱼中的表达趋势一致。结果说明,在性腺分化及维持期间,在精巢中扮演更重要的角色,而主要是在卵巢中发挥作用。由于目前在花鲈中尚缺乏性别相关的遗传分子标记,所以不能确定在组织学上的性别分化标志出现之前,和的表达趋势是否可以预测未来卵巢和精巢的分化。但是,根据欧洲鲈的研究结论,结合本研究结果,有理由推测,在花鲈性腺分化的第1个组织学特征明显之前,和在性腺中的差异表达或许可能成为预测未来分化成卵巢和精巢的分子依据。
BLÁZQUEZ M, NAVARRO-MARTÍN L, PIFERRER F. Expression profiles of sex differentiation-related genes during ontogenesis in the European sea bass acclimated to two different temperatures. Journal of Experimental Zoology, Part B: Molecular and Developmental Evolution, 2009, 312B(7): 686‒700
CHENG Q T, ZHENG B S. Fish system retrieval of China. Beijing: Science Press, 1987, 327‒332 [成庆泰, 郑葆珊. 中国鱼类系统检索. 北京: 科学出版社, 1987, 327‒332]
CHI M L. Cloning of reproductive genes and their expressive manipulation analysis in male spotted sea bass (). Doctoral Dissertation of Ocean University of China, 2015 [迟美丽. 花鲈繁殖相关基因的克隆及其在雄性个体中的表达调控分析. 中国海洋大学博士研究生学位论文, 2015]
DANG G C, LIU Y Q, FU P S,. Effect of high-temperature treatment on sex differentiation and growth in Nile tilapia. Progress in Fishery Sciences, 2011, 32(5): 32‒37 [党广成, 刘羽清, 付佩胜, 等. 高温诱导对尼罗罗非鱼性别分化及生长的影响. 渔业科学进展, 2011, 32(5): 32‒37]
DEVLIN R H, NAGAHAMA Y. Sex determination and sex differentiation in fish: An overview of genetic, physiological, and environmental influences. Aquaculture, 2002, 208(3/4): 191‒364
DRISCOLL R M H, FABER-HAMMOND J J, O'ROURKE C F,. Epigenetic regulation of gonadal and brain aromatase expression in a cichlid fish with environmental sex determination. General and Comparative Endocrinology, 2020, 296(15): 113538
HAN F. The indoor artificial breeding and developmental morphology of larva and juvenile in. Master´s Thesis of Ocean University of China, 2016 [韩枫. 花鲈室内人工繁育与仔稚鱼形态学研究. 中国海洋大学硕士研究生学位论文, 2016]
HU P, LIU X F, LIU B,. Histological observation on the gonadal differentiation of tiger puffer (). Periodical of Ocean University of China (Natural Science), 2015, 45(10): 25‒30 [胡鹏, 刘新富, 刘滨, 等. 红鳍东方鲀性腺的组织学分化. 中国海洋大学学报(自然科学版), 2015, 45(10): 25‒30]
IJIRI S, KANEKO H, KOBAYASHI T,. Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish, the Nile tilapia. Biology of Reproduction, 2008, 78(2): 333‒341
JIANGA J Q, KOBAYASHI T, GE W,. Fish testicular 11β-hydroxylase: cDNA cloning and mRNA expression during spermatogenesis. FEBS Letters, 1996, 397(2/3): 250‒252
KANG K, WU J, YUAN L Y,. Establishment and optimization of an isolation and culture system for sertoli cells of Nile tilapia. Progress in Fishery Sciences, 2020, 41(1): 119‒126 [康恺, 吴江, 苑麟勇, 等. 尼罗罗非鱼精巢支持细胞分离培养体系建立及优化. 渔业科学进展, 2020, 41(1): 119‒126]
KISHIDA M, CALLARD G V. Distinct cytochrome P450 aromatase isoforms in zebrafish () brain and ovary are differentially programmed and estrogen regulated during early development. Endocrinology, 2001, 142(2): 740‒750
KOBAYASHI Y, HORIGUCHI R, MIURA S,. Sex- and tissue- specific expression of P450 aromatase () in the yellowtail clownfish,. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2010, 155(2): 237‒244
LI Y H, SUN P. The progress in fish sex determination and its mechanisms.Modern Fisheries Information, 2011, 26(12): 10‒15 [李云航, 孙鹏. 鱼类性别决定机制及相关基因研究进展. 现代渔业信息, 2011, 26(12): 10‒15]
LU C, SU L N, ZHU B K. Advances on the genes related with sex determination and differentiation of fish. Hubei Agricultural Sciences, 2014, 53(13): 2981‒2986 [路畅, 苏利娜, 朱邦科.鱼类性别决定及分化相关基因研究进展. 湖北农业科学, 2014, 53(13): 2981‒2986]
SCHULZ R W, DE FRANÇA L R, LAREYRE J J,. Spermatogenesis in fish. General and Comparative Endocrinology, 2010, 165(3): 390‒411
SIMPSON E R, CLYNE C, RUBIN G,. Aromatase: A brief overview. Annual Review of Physiology, 2002, 64(1): 93‒ 127
SI Y F, DING Y X, HE F,. DNA methylation level ofandgene related to their expression patterns and reproduction traits during ovary development stages of Japanese flounder (). Gene, 2016, 575(2): 321‒330
Song H, Wang SY. Progress in fish primordial germ cells. Progress in Veterinary Medicine, 2004, 25(5): 22‒23 [宋卉, 王树迎. 鱼类原始生殖细胞的研究进展. 动物医学进展, 2004, 25(5): 22‒23]
STRÜSSMANN C A, NAKAMURA M. Morphology, endocrinology and environmental modulation of gonadal sex differentiation in teleost fishes. Fish Physiology and Biochemistry, 2002, 26(1): 13‒29
SUN G Y, ZHU Y Y, ZHOU Z L,. The reproductive biology ofin the Yangtze River estuary and Zhejiang offshore waters. Journal of Fisheries of China, 1994, 18(1): 18‒23 [孙帼英, 朱云云, 周忠良, 等. 长江口及浙江沿海花鲈的繁殖生物学. 水产学报, 1994, 18(1): 18‒23]
TANG B, HU W, HAO J,. Developmental expression of steroidogenic factor-1, cyp19a1a and cyp19a1b from common carp (). General and Comparative Endocrinology, 2010, 167(3): 408‒416
VIZZIANO D, RANDUINEAU G, BARON D,. Characterization of early molecular sex differentiation in rainbow trout,. Developmental Dynamics, 2007, 236(8): 2198‒2206
WANG H, WEN H, LI Y,. Evaluation of potential reference genes for quantitative RT-PCR analysis in spotted sea bass () under normal and salinity stress conditions. PeerJ, 2018, 6(19): e5631
WANG J, WEN C G, ZHAO Y,. The prokaryotic expression and the protein purification of Nile tilapiagene. Progress in Fishery Sciences, 2014, 35(4): 45‒50 [王金, 文春根, 赵燕, 等. 尼罗罗非鱼()原核表达与蛋白纯化. 渔业科学进展, 2014, 35(4): 45‒50]
WANG X J, ZHANG S M, LI J F,. Studies on histology and gene expression pattern of primitive gonadal differentiation and sex hormo hormone level of black rockfishPeriodical of Ocean University of China (Natural Science), 2019, 49(S2): 8‒20 [王孝杰, 张思敏, 李吉方, 等. 许氏平鲉早期性腺分化组织学与性激素水平、性腺分化相关基因表达特征. 中国海洋大学学报(自然科学版), 2019, 49(S2): 8‒20]
WANG T R. Antibody preparation and expression of Dmrt1, Amh and Cyp11b2 in gonads of Nile tilapia during normal development and sex reversal. Master's Thesis of Southwest University, 2013 [王婷茹. 尼罗罗非鱼Dmrt1、Amh和Cyp11b2抗体制备及其在正常发育和性逆转性腺中的表达研究. 西南大学硕士研究生学位论文, 2013]
WEN A Y, YOU F, XU Y L,. Research progress on the study of sex determination and differentiation relateds to gene of fish. Marine Sciences, 2008, 32(1): 74‒80 [文爱韵, 尤锋, 徐永立, 等. 鱼类性别决定与分化相关基因研究进展. 海洋科学, 2008, 32(1): 74‒80]
WEN H S, LI J F, ZHANG M Z,. Physiology and breeding technology of sea bass in mariculture. Beijing: China Aquaculture Press, 2019, 346‒347 [温海深, 李吉方, 张美昭, 等. 海水养殖鲈鱼生理学与繁育技术. 北京: 中国农业出版社, 2019, 346‒347]
YAN T M, CAI Y P, HE J Y,. Characterization and expression profiles ofin the schizothoracine fish. Tissue and Cell, 2019, 58: 70‒75
YANG Y. Study on the mechanism and patteren of germ cell proliferation and differentiation in Japanese flounder (). Doctoral Dissertation of University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2018 [杨阳. 牙鲆生殖细胞增殖、分化规律及分子机制的研究. 中国科学院大学(中国科学院海洋研究所)博士研究生学位论文, 2018]
YANG Z Z, BIAN L, ZHANG Y,. Cloning and expression of thegene in the spotted halibut (). Progress in Fishery Sciences, 2020, 41(2): 103–112 [杨珍珍, 边力, 张岩, 等. 圆斑星鲽基因的克隆与表达分析. 渔业科学进展, 2020, 41(2): 103–112]
YOU X R. Histological studies on the origin and migration of the primordial germ cells and gonadal sex differentiation in large yellow croaker. Master´s Thesis of Jimei University, 2012 [游秀容. 大黄鱼原始生殖细胞发生、迁移及性腺性别分化的组织学研究. 集美大学硕士研究生学位论文, 2012]
ZHANG L L. The study of gonadal differentiation process and sex-related gene,of spotted halibut. Master's thesis of Shanghai Ocean University, 2018 [张乐乐. 圆斑星鲽性腺分化过程及性别相关基因、的研究. 上海海洋大学硕士研究生学位论文, 2018]
ZHAO Y Z, CHEN Z F, MA T,. Histological observation of gonad development in spotted knifejaw (). Journal of Shanghai Ocean University, 2020, 30(4): 675–683 [赵玉柱, 陈张帆, 马腾, 等. 斑石鲷性腺发育的组织学观察. 上海海洋大学学报, 2020, 30(4): 675–683]
Histology of Gonadal Differentiation and Expression Analysis of Sex-Related Genes,in Spotted Sea Bass ()
LI Bingyu, WEN Haishen, WANG Lingyu, LI Jinku, QI Xin, LI Yun①
(Ocean University of China, Key Laboratory of Mariculture, Ministry of Education, Qingdao, Shandong 266003,China)
The gonadogenesis, the development and differentiation of larvae and juveniles from 1~214 days post hatching (dph) and 18-month-old female and male spotted sea bass () were studied. The relationship between the expression of sex-related genes (and) and sex in the process of gonadal differentiation was discussed. The results showed that at 30 dph [(1.28±0.10) cm], primordial germ cells (PGCs) were first observed around the peritoneal membrane at the front end of the mesorenic duct, indicating that the time before 30 dph was the critical period for PGCs to migrate to the genital ridge. At 55 dph [(2.45±0.19) cm], a pair of symmetrically distributed primitive gonads was observed, indicating that the primitive gonads of the juvenile spotted sea bass were formed between 30 and 55 dph [(1.28~2.45) cm]. Between 55~180 dph [(2.45~12.28) cm], the primordial gonads continued to grow and remained in an undifferentiated state. After 180 dph, the gonads began to differentiate; at 195 dph [(14.54±1.54) cm], we observed that the testis began to differentiate, while the ovary began to differentiate at 205 dph [(15.86±0.94) cm]. The anatomical differentiation of the gonads was earlier than the cytological differentiation in spotted sea bass. The gonad of 18-month-old spotted sea bass developed to stageⅡ. The expression level of the sex differentiation-related genein the ovary of spotted sea bass was higher than that of the contemporaneous testis, indicating that it played a key role in the differentiation and maintenance of the ovary. The expression level ofat stageⅡ testis of 18-month-old juveniles was significantly higher than in the contemporaneous ovary and stage Ⅰ testes, suggesting that it played a crucial part in the differentiation and maintenance of testes. The results not only enriched our understanding of the reproductive physiology of spotted sea bass, but also provided a scientific basis for the study of sex selection technology.
; Gonad differentiation; Histology;;
LI Yun, E-mail: yunli0116@ouc.edu.cn
S917.4
A
2095-9869(2021)06-0185-09
10.19663/j.issn2095-9869.20201215001
http://www.yykxjz.cn/
李冰玉, 温海深, 王灵钰, 李金库, 齐鑫, 李昀. 花鲈性腺分化组织学及性别相关基因和的表达分析. 渔业科学进展, 2021, 42(6): 185–193
LI B Y, WEN H S, WANG L Y, LI J K, QI X, LI Y. Histology of gonadal differentiation and expression analysis of sex-related genesandin spotted sea bass (). Progress in Fishery Sciences, 2021, 42(6): 185–193
李 昀,副教授,E-mail: yunli0116@ouc.edu.cn
2020-12-15,
2021-01-08
*财政部和农业农村部: 国家现代农业产业技术体系资助 [This work was supported by China Agriculture Research System of MOF and MARA].李冰玉,E-mail: 1032566031@qq.com
(编辑 马璀艳)
