调控Dicer1影响宫颈癌细胞的肿瘤生物学特征
2022-01-04赵璨何登
赵璨 何登
宫颈癌是目前最为常见的妇科恶性肿瘤之一,占全球女性肿瘤发病率和死亡率第4位,2018年统计全球新发病例570 000例,死亡近311 000例[1-2]。宫颈癌在35~55岁为高发年龄段,高危型人乳头瘤病毒(human papilloma virus, HPV)感染是其发病的主要原因,而疾病的转移及复发仍为患者的主要死亡原因,因此我们需要进一步探查相应潜在生物标志物和作用位点,为宫颈癌诊治提供相应的新思路。
Dicer1作为双链RNA 特异性核酸内切酶,在miRNAs生成过程中起到关键作用[1]。Dicer1可将双链RNA(dsRNA)和pre-miRNA剪切成小片段干扰RNA和miRNA而发挥相应功能。既往研究表明Dicer1在恶性肿瘤的发生、发展过程中具有重要作用,能够参与肿瘤组织的生成以及癌细胞增殖、凋亡、侵袭、迁移等生物学行为,Dicer1表达的变化与肺癌、直肠癌、食管癌、乳腺癌以及前列腺癌等恶性肿瘤的发展和预后均密切相关[1]。本实验组在前期研究结论的基础之上,继续通过对宫颈肿瘤组织和细胞进行质粒转染调控 Dicer1,观察Dicer1表达变化对宫颈肿瘤组织和细胞生物学的影响,为进一步研究 Dicer1 在宫颈癌发生、发展中的作用及分子机制提供相应依据。
材料与方法
一、细胞株培养
宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)细胞W12和S12 细胞用含10% 3T3细胞上清的 DMEM/F12(1∶1)培养;CaSki和C33A均用含10%胎牛血清的DMEM培养。所有培养液均购自美国Gibco公司。
二、组织标本及抗体选择
选取华中科技大学同济医学院附属同济医院手术标本,包括 25例各级别CIN组织,病理标本均由两位以上病理学家诊断和审核。Anti-Dicer1抗体购自Abcam公司(货号ab14601),Western blot按 1∶500 稀释于5%脱脂牛奶,免疫组化按1∶100 稀释于0.2 mol/L磷酸盐缓冲液。
三、RT-PCR检测Dicer1 mRNA表达
收集W12和S12细胞沉淀,加入1 ml TRIzol试剂(Invitrogen公司),应用苯酚氯仿抽提总RNA,Nanodrop仪器测定 RNA浓度。使用逆转录酶M-MLV(TaKaRa公司,货号K4707)逆转录mRNA成cDNA,置-20 ℃待用。引物序列:Dicer1上游为5′-TCGAGCCTCCATTGTTGGTC-3′,下游为5′-TAGC-ACTGCCTTCGTTTCGT-3′;GAPDH上游为5′-CC-ACTCCTCCACCTTTGAC-3′,下游为5′-ACCCTGTTGCTGTAGCCA-3′。All-in-one TM-qPCR Mix试剂盒(Genecopoeia公司,货号B24WY0203)实时定量PCR检测Dicer1基因表达。
四、Western blot检测细胞系中Dicer1表达
收集W12与S12细胞沉淀,RIPA裂解液裂解细胞,冰浴30 min,裂解后12 000 r/min 离心,取上清提取细胞总蛋白,BCA法测定蛋白浓度。配制8% SDS-PAGE凝胶,50 μg蛋白样品上样,SDS-PAGE凝胶电泳,电泳后将蛋白转移至聚偏二氟乙烯膜(PVDF膜)。Anti-Dicer1抗体按1∶500稀释, GAPDH抗体按 1∶1 000 稀释; 辣根过氧化氢酶标记的兔抗鼠二抗按1∶1 000稀释。在Bio-Rad凝胶成像仪下电化学发光(ECL)试剂盒对PVDF膜进行图像采集与分析。
五、免疫组化测定宫颈病变组织Dicer1表达
取宫颈疾病谱组织组合芯片CR602和组织石蜡切片置烤箱 68 ℃烤片过夜,从环保脱蜡液至70%乙醇梯度脱水,0.01 mol/L 柠檬酸缓冲液抗原修复。Anti-Dicer1抗体(按1∶100稀释)4 ℃孵育过夜;按兔鼠通用组化试剂盒步骤操作,DAB显色5 min;苏木素染核,中性树脂封片;倒置相差显微镜观察Dicer1表达情况并评分。评分标准:无着色0分,淡黄色1分,浅黄色2分,棕黄色3分和棕褐色4分。
六、CCK-8法测定细胞增殖水平
制备S12细胞悬液,PBS漂洗细胞后更换为内含10% FBS的DMEM/F12培养液,加CCK-8,37 ℃培养箱孵育4 h。细胞纯化和培养后的S12细胞及Dicer1基因沉默S12细胞分别于48 h及72 h检测450 nm吸光度水平。
七、细胞侵袭与迁移实验
取对数生长期的细胞,用无血清培养液制成密度为2×10个/ml的单细胞悬液,将Transwell小室置于24孔板中。取Matrigel胶与无血清RPMI-1640培养液以1∶8比例稀释包被于Transwell小室底部膜的上室面,置于37 ℃培养箱30 min使其凝固,水化后加入制备好的无血清细胞悬液200 μl,下室加入10%胎牛血清培养液600 μl,置37 ℃、5% CO2培养箱中孵育0、12、24、36、48、72 h后取出固定染色,倒置显微镜观察穿过Transwell小室底部膜的下室面细胞,随机选取5个低倍视野并计数。
取对数生长期的细胞用无血清培养液制成密度为2×10个/ml的单细胞悬液,将Transwell小室置于24孔板中。Transwell小室上室加入制备好的细胞悬液200 μl,下室加入带血清培养液600 μl,置37 ℃、5% CO2培养箱中孵育0、12、24、36、48、72 h后取出固定染色,倒置显微镜观察穿过Transwell小室底部膜的下室面细胞,随机选取5个低倍视野并计数。
八、统计学方法
用SPSS 23.0软件对数据进行分析,采用Graphpad Prism 5软件作图,计量资料采用Fisher精确检验及t检验,P<0.05表示差异有统计学意义。
结 果
一、CIN组织Dicer1与HPV L1蛋白表达差异
本研究收集了25例宫颈癌前病变患者宫颈局部病变组织,通过免疫组化分别测定患者Dicer1及HPV L1表达量,发现15例患者同时存在Dicer1和HPV L1表达,7例患者Dicer1和HPV L1均为阴性,2例患者Dicer1阴性而HPV L1阳性,1例患者Dicer1和HPV L1均为阴性。通过卡方检验χ2=10.45,P=0.001,Fisher精确检验P=0.000 5。提示Dicer1蛋白表达量与HPV感染具有相关性(图1)。
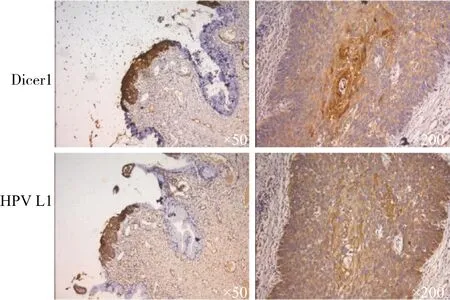
图1 CIN组织Dicer1表达与HPVL1蛋白表达相关(苏木素染核,×50,×200)
二、CIN组织HPV感染程度与Dicer1表达量相关性
通过免疫组化检查,我们发现HPV阳性患者的宫颈CIN组织Dicer1表达量明显高于HPV阴性及病变旁宫颈组织(图2A),且随着CIN等级逐渐上升,Dicer1表达量逐渐增加(图2B)。
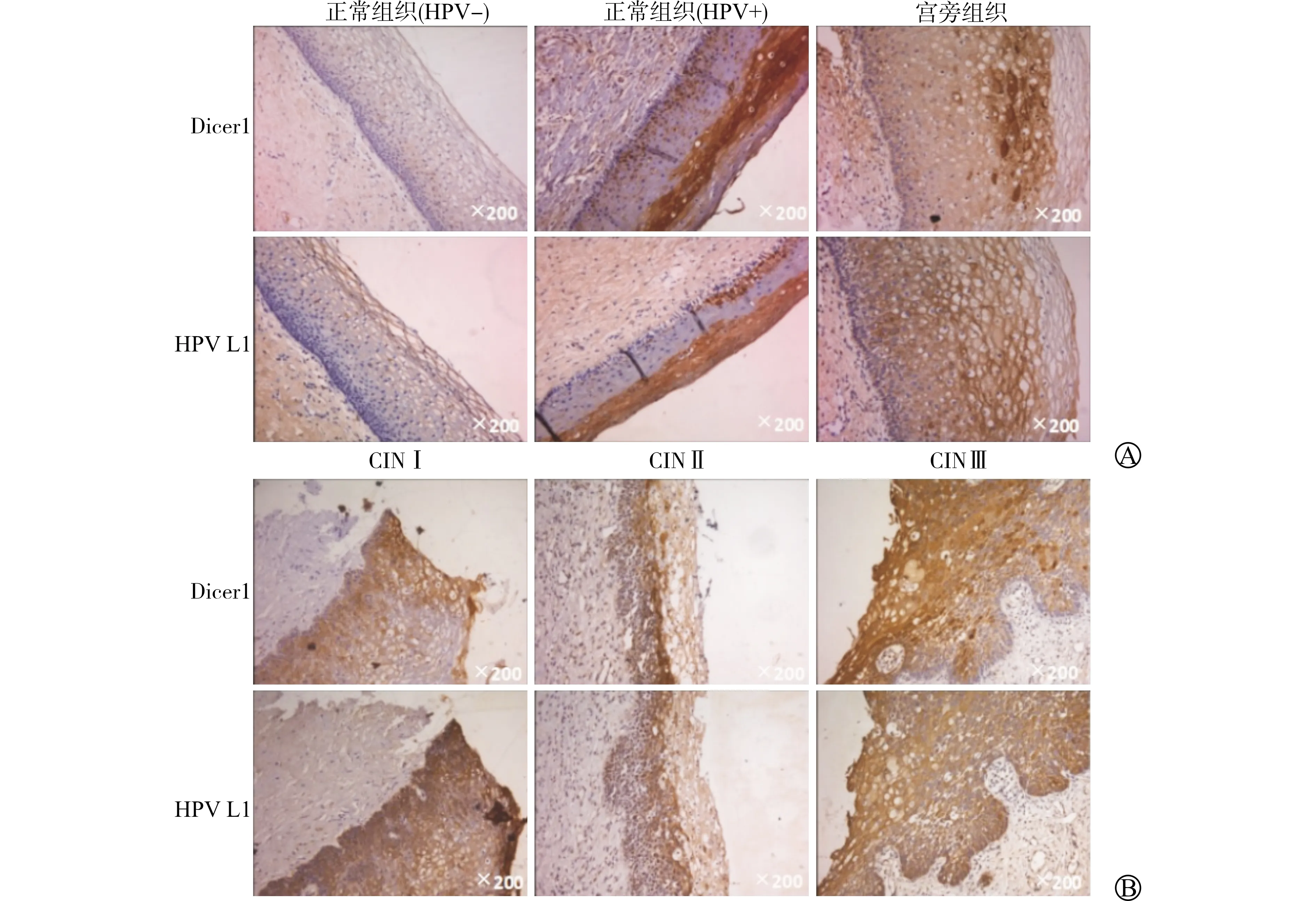
A:HPV阳性患者的CIN组织Dicer1表达量明显高于HPV阴性患者;B:随着CIN级别增加,Dicer1表达量亦逐渐增加。
三、质粒转染CIN细胞系(W12、S12)及宫颈癌细胞系(CaSki、C33A)下调Dicer1基因结果
抑制Dicer1基因可明显增加W12细胞HPV E2和E6 mRNA蛋白表达,提示W12恶性程度增加,抑制Dicer1后,W12细胞HPV E2 mRNA表达量前后分别为0.31±0.05、0.59±0.11,t=-4.58,P=0.04。提示Dicer1对宫颈组织具有一定保护作用(图3A)。当S12、CaSki、C33A细胞系的Dicer1基因下调时,沉默后(Shdicer水平)相对沉默前(NC水平),S12、CaSki细胞系E6蛋白表达量明显增加,而C33A中E6表达量无明显差异,此外S12、CaSki细胞系抑癌基因P53、Rb和P21相应蛋白表达量明显降低,而在C33A中表达亦无明显差异(图3B)。抑制S12细胞系Dicer1基因可下调P53、P21 mRNA表达,其对Rb mRNA表达无统计学意义,此外E6及E7 mRNA表达量亦明显降低(图3C)。Dicer1抑制前后,S12细胞Rb mRNA表达量分别为0.98±0.02、1.02±0.10,t=-0.63,P=0.59;P53 mRNA 表达量分别为1.01±0.16、0.59±0.09,t=11.27,P=0.008;P21 mRNA表达量分别为0.64±0.09、0.47±0.04,t=9.47,P=0.001;HPV E6 mRNA表达量分别为1.01±0.46、0.58±0.02,t=2.14,P=0.03;HPV E7 mRNA表达量分别为1.10±0.17、0.32±0.11,t=26.43,P=0.002。
四、CIN细胞系S12增殖、侵袭及转移实验
通过CCK-8实验发现,抑制S12细胞系Dicer1基因,随着时间增加,S12细胞系A450逐渐增加,Dicer1抑制48 h前后S12细胞A450分别为0.31±0.08、0.41±0.12,t=-0.45,P=0.05;而72 h水平S12细胞A450前后分别为0.46±0.11,0.94±0.27,t=-5.196,P=0.04。提示细胞的恶性程度有所提高,且在48 h和72 h与沉默前相比差异均有统计学意义(图3D),图3E结果提示抑制S12细胞Dicer1可明显增强细胞的侵袭性及转移能力。
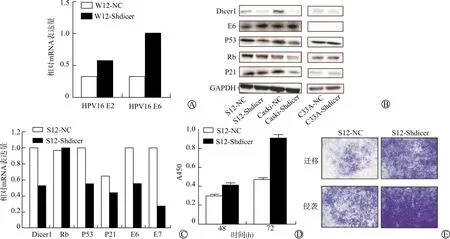
A:RT-PCR检测抑制Dicer1对W12细胞HPV E2和E6的影响;B:Western blot检测抑制Dicer1对宫颈肿瘤细胞HPV E6及抑癌基因的作用;C:RT-PCR检测S12细胞下调Dicer1对抑癌基因和HPV E6、E7在mRNA水平的影响;D:抑制Dicer1基因对S12细胞增殖的影响;E:抑制Dicer1基因对S12细胞侵袭性和迁移性的作用(结晶紫染色,×50)
讨 论
宫颈癌是女性较常见的疾病,随着宫颈脱落细胞筛查、HPV检查和HPV疫苗逐渐普及,宫颈癌的发病率及死亡率已逐渐降低。尽管我们的诊治能力提高,但超过一半的患者在发现时已出现局部浸润扩散或者远处转移,其5年生存率仍低于20%[1-2]。因此进一步探究宫颈癌的发病机制仍是认识这一疾病的关键。
高危型HPV病毒与宫颈宿主细胞整合是宫颈癌病理发生和进展的关键过程,其涉及多阶段和多基因异常调控[2],其作用机制是HPV病毒整合到宿主细胞基因组后干扰E2基因表达,削弱E2基因对E6、E7基因转录抑制作用,使P53和Rb失活,同时使E6、E7致癌基因过表达[3],从而破坏细胞内相应信号传导通路,此外E5癌蛋白参与细胞免疫调节损害作用,也影响感染细胞凋亡过程,最终导致细胞永生化引起癌变[4]。
HPV感染宫颈宿主细胞包括多种miRNA调节变化[5]。在细胞代谢、增殖、分化和凋亡的信号分子调节过程中miRNA极为重要,其可识别相应目标mRNA,且在转录后通过靶mRNA的降解下调以及抑制翻译过程而负反馈调控目的基因表达,从而形成类似癌基因或抑癌基因的功能,参与各类肿瘤的病理学机制。目前发现宫颈癌组织中有97类miRNA表达上调,而同时有47类miRNA表达下调或沉默。miRNA表达差异有助于临床区分肿瘤和正常组织类型,亦能鉴别肿瘤类型、分期以及其他临床特征[5-6]。Dicer1作为核糖核酸酶Ⅲ家族成员,可将dsRNA和 pre-miRNA剪切成小片段干扰RNA和miRNA。miRNA在宫颈癌的临床意义显著,然而Dicer1在宫颈癌病理发生、发展的分子机制及临床意义的研究较少。Dicer1突变或缺失可引起胸膜肺母细胞瘤、囊性肾肿瘤、横纹肌肉瘤、结节性甲状腺肿瘤、卵巢支持细胞-间质细胞肿瘤等[7-9]。Dicer1表达对肺癌、食管癌和卵巢癌等多种肿瘤的预后有显著影响,然而Dicer1在宫颈癌细胞和组织的表达研究较少且存有一定争议。有研究认为Dicer1 mRNA在宫颈癌和癌旁组织中的表达较正常宫颈组织低[10]。此外也有文献报道,宫颈癌组织中Dicer1的蛋白水平和mRNA水平亦不一致,该研究在蛋白水平上揭示了FIGO分期Ⅰ-Ⅱ和Ⅲ-Ⅳ期宫颈癌组织中Dicer1蛋白表达水平的差异有统计学意义,Dicer1表达亦与远处转移和复发相关[11]。
本研究前期也发现正常宫颈上皮组织中Dicer1蛋白表达较低,同时在宫颈癌分化程度较好的组织中表达较高,然而在恶性程度更高的宫颈癌组织中反而表达较低,提示基因mRNA和蛋白表达水平不一致也是常见的分子现象。另外我们先前曾报道了Dicer1表达与宫颈癌组织病理分级相关,在宫颈鳞状细胞癌组织中恶性程度越高其表达越低[7]。正常宫颈上皮中,Dicer1表达量较低,而HPV感染的宫颈上皮Dicer1表达量增加,并随着CIN的进展,其表达量逐渐增加。据此分析Dicer1表达量可能与HPV感染密切相关,HPV感染宫颈上皮后,Dicer1蛋白可能直接或间接(生成 miRNA)参与防御HPV病毒感染。本文在上述研究基础之上进一步发现Dicer1蛋白表达量与HPV L1感染具有相关性,此外质粒转染CIN细胞系(W12、S12)及宫颈癌细胞系(CaSki、C33A)下调Dicer1基因结果为:抑制Dicer1可明显增加W12细胞HPV E2和E6 mRNA蛋白表达,W12细胞恶性程度增加,P53、Rb及P21基因在Dicer1下调后均有降低,提示Dicer1与抑癌基因可能具有协同作用,而Dicer1对宫颈组织具有一定保护作用,而且通过CCK-8实验发现,抑制S12细胞系Dicer1基因,随着时间增加,S12细胞系A450逐渐增加,提示细胞侵袭性、迁移性均提高。因此,我们考虑在宫颈恶性肿瘤发病过程中,Dicer1基因具有抵抗肿瘤细胞进展的作用,本文为研究Dicer1在宫颈癌中的作用及分子机制提供一定依据,我们下一步研究将增加样本量、补充临床资料和肿瘤分子生物学研究。
