长链非编码RNA小核仁RNA宿主基因7调控卵巢癌细胞迁移和侵袭的机制研究
2022-01-04于利张明王迪
于利,张明,王迪
卵巢癌是女性恶性肿瘤,其死亡率在妇科恶性肿瘤中排名首位[1]。研究显示,卵巢癌不仅早期发病隐匿、发展速度快,其还具有转移能力强、恶性程度高等特点,积极寻找有效手段治疗卵巢癌是目前亟待解决的问题[2]。随着分子生物学及各种实验技术的不断发展和成熟,生物靶向治疗肿瘤逐渐成为现阶段研究的热点。卵巢癌的发生与组织中基因的表达改变有关,这些基因调控着肿瘤细胞的生长和转移,是肿瘤恶性进展的关键因子。长链非编码RNA(lncRNA)是一个非编码RNA,其不具备编码蛋白质的功能,在人体内的各个组织中表达,参与调控众多生理过程[3]。lncRNA还与人类的疾病发生有关,目前已知其参与心肌损伤、肺炎、关节炎等疾病进程,lncRNA还有望成为疾病治疗的靶点[4]。在人类肿瘤中发现多种lncRNA的表达变化,这些lncRNA与肿瘤的转移相关[5]。lncRNA小核仁RNA宿主基因7(SNHG7)在人类的不同组织中的表达水平不同,其是一个肿瘤调控因子,在胰腺癌、肺癌、乳腺癌等肿瘤中发现SNHG7具有促肿瘤进展的作用,下调SNHG7可以抑制肿瘤细胞的恶性生长和转移[6-8]。本研究于2019年6—12月探讨下调SNHG7对卵巢癌SK-OV-3细胞侵袭以及迁移的影响和机制,为靶向分子治疗卵巢癌提供可能。
1 材料与方法
1.1 材料卵巢癌SK-OV-3细胞购自美国ATCC;波形蛋白(Vimentin)抗体购自武汉艾美捷科技有限公司;Lipofectamine 2000购自美国Invitrogen;实时定量PCR试剂购自宝生物工程(大连)有限公司;引物由北京安必奇生物科技有限公司合成;上皮钙黏蛋白(E-cadherin)抗体购自美国Proteintech。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 细胞转染卵巢癌SK-OV-3细胞中分别转染SNHG7干扰表达质粒(SNHG7 shRNA)和阴性对照质粒(shRNA),将转染以后的细胞分别命名为Sh-SNHG7和Sh-NC组,常规培养的细胞为对照(Control)组。SNHG7 shRNA、shRNA阴性对照均由和元生物技术(上海)股份有限公司构建。
1.3 SNHG7表达水平测定用实时定量PCR方法测定细胞中SNHG7表达变化,步骤如下:收集培养24 h后的Control、Sh-NC、Sh-SNHG7组细胞,用Trizol试剂提取细胞总RNA,进行逆转录反应,逆转录体系为10 μL,包括:0.5 μL的核糖核酸酶抑制剂(RNase Inhibitor)、0.5 μL的dNTP混合物(dNTP mixture)、2 μL的5×PCR缓冲液、0.5 μL的寡核苷酸dT引物(Oligo dT Primer)、1 μL的RNA、5.5 μL的无RNA酶水(RNase free),逆转录条件为:37℃、15 min,85℃、5 s,4℃保存。根据以下体系进行PCR反应,包括:0.2 μL的染料(DYE)Ⅰ、3.4 μL的荧光DNA结合染料(SYBR Green)、0.2 μL的正反向引物、1 μL的cDNA、5 μL的RNase free水,PCR反应条件为:95℃30 s,95℃5 s,60℃34 s,40个循环。设置甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,按照常规2-ΔΔCt法计算SNHG7表达量。GAPDH正向引物5,-GAAGGTGAAGGTCGGAGTC-3,,反向引物5,-GAAGATGGTGATGGGATTTC-3,;SNHG7正 向 引 物5,-CAACTGCCTGAAACCCCATCT-3,,反 向 引 物5,-CGGGTTCAAGCGATTCTCCT-3,。
1.4 细胞增殖能力测定用MTT方法测定细胞增殖能力,细胞增殖能力以A值代表,A值越大,细胞增殖能力也就越强,MTT步骤简述如下:在96孔板中按照每孔2×103个细胞将Control、Sh-NC、Sh-SNHG7组细胞分别接种,每孔中添加100 μL的细胞培养液,培养24 h,添加10 μL MTT溶液,孵育4 h后添加150 μL二甲基亚砜(DMSO),酶标仪上测定A470nm值。
1.5 细胞克隆形成能力测定用平板克隆实验检测细胞克隆形成能力,步骤简述如下:将Control、Sh-NC、Sh-SNHG7组细胞分别接种到6 cm的细胞培养皿内,每个培养皿中加200 μL的浓度为1×103个细胞∕mL的细胞悬浮液,然后添加细胞培养液至5 mL,放在培养箱中培养14 d,此时肉眼可见明显的细胞集落。将细胞培养液吸掉,加磷酸盐缓冲液(PBS)洗涤3次细胞,以4%的多聚甲醛固定,0.1%结晶紫染色,干燥以后,显微镜下观察细胞克隆数目。
1.6 细胞侵袭和迁移能力测定将Control、Sh-NC、Sh-SNHG7组细胞用不含血清的细胞培养液悬浮,侵袭实验前用基质胶将Transwell小室包被,迁移实验则不加基质胶。取200 μL上述细胞悬浮液接种到Transwell上室,培养24 h,用棉签擦除没有穿膜的细胞,结晶紫染色后,在显微镜下观察计数。
1.7 细胞中Vimentin、E-cadherin蛋白表达水平测定用Western blotting方法检测Vimentin、E-cadherin蛋白表达,步骤简述如下:收集培养24 h后的Control、Sh-NC、Sh-SNHG7组细胞,将上清溶液弃掉,添加含有苯甲基磺酰氟(PMSF)的放射免疫沉淀分析裂解液(RIAP),放在冰上充分裂解,转移到离心管内,在4℃条件下以12 000g离心20 min,吸取上清,用二辛可宁酸(BCA)方法测定浓度。按照常规方法分别制备实验用分离胶以及浓缩胶,设置分离胶中电泳电压为100 V,浓缩胶中电泳电压为80 V。染料进入到分离胶的底部以后将电源关闭。取出凝胶,在4℃转膜,转膜电压设置为60 V,转膜持续40 min。转膜结束后取出聚偏二氟乙烯膜(PVDF),经过5%牛血清白蛋白封闭以后,分别与一抗、二抗依次结合后,用电化学发光液(ECL)方法显色,设置GAPDH作为内参,分析Vimentin、E-cadherin蛋白表达量。
1.8 SNHG7靶向关系预测和鉴定用starbase生物信息软件发现SNHG7和miR-34a有互补结合位点,二者可能互为靶向关系。以荧光素酶报告系统鉴定靶向关系,分别将SNHG7野生型荧光素酶报告质粒(SNHG7-WT)、突变型荧光素酶报告质粒(SNHG7-MUT)同miR-34a模拟物(miR-34a mimics)及阴性对照(mimics control)共转染到SK-OV-3细胞中,24 h后检测荧光素酶活性变化,步骤同荧光素酶活性检测试剂盒。SNHG7-WT、MUT分别为含有SNHG7的结合序列和含有突变以后的SNHG7结合序列的荧光素酶报告载体,载体由中洪博元生物集团有限公司构建。miR-34a mimics、mimics control购自上海吉玛制药技术有限公司。收集培养24 h后的Control、Sh-NC、Sh-SNHG7组细胞,用实时定量PCR方法测定细胞中miR-34a表达变化,步骤同1.3,内参为核小分子RNA(U6)。
1.9 miR-34a inhibitor对下调SNHG7影响卵巢癌细胞的作用检测卵巢癌SK-OV-3细胞中分别共转染SNHG7 shRNA+miR-34a抑制剂(miR-34a inhibitor)和SNHG7 shRNA+miR-34a抑制剂阴性对照(inhibitor control),依次命名为Sh-SNHG7+anti-miR-34a和Sh-SNHG7+anti-miR-NC组,按照1.4(MTT)、1.5(克隆形成实验)、1.6(Transwell小室)、1.7(Western blotting)中方法测定细胞增殖、克隆、侵袭迁移和Vimentin、E-cadherin蛋白表达。
1.10 统计学方法用SPSS 21.0软件分析,计量资料用±s表示,两组数据间比较经成组t检验,多组差异比较用单因素方差析,多组间两两比较采用SNK-q检验的方法,P<0.05为差异有统计学意义。
2 结果
2.1 SNHG7 shRNA对卵巢癌细胞增殖、克隆、侵袭、迁移和Vimentin、E-cadherin蛋白表达影响与Sh-NC组比较,Sh-SNHG7组卵巢癌细胞中SNHG7表达水平降低,细胞增殖(A值)降低,克隆数目减少,侵袭和迁移数目减少,Vimentin蛋白表达量减少,E-cadherin蛋白表达量升高,见图1和表1。SNHG7 shRNA下调卵巢癌细胞中SNHG7表达水平,降低卵巢癌细胞增殖、克隆、迁移以及侵袭能力。
表1 SNHG7 shRNA转染后的卵巢癌细胞中SNHG7水平、增殖、克隆、侵袭、迁移和Vimentin、E-cadherin蛋白表达水平比较∕±s

表1 SNHG7 shRNA转染后的卵巢癌细胞中SNHG7水平、增殖、克隆、侵袭、迁移和Vimentin、E-cadherin蛋白表达水平比较∕±s
注:SNHG7为小核仁RNA宿主基因7,Control为对照组,Sh-NC为转染SNHG7阴性对照质粒组,Sh-SNHG7为转染SNHG7干扰表达质粒组,A值为吸光度值,Vimentin为波形蛋白,E-cadherin为上皮钙黏蛋白。①与Sh-NC比较,P<0.05。
?
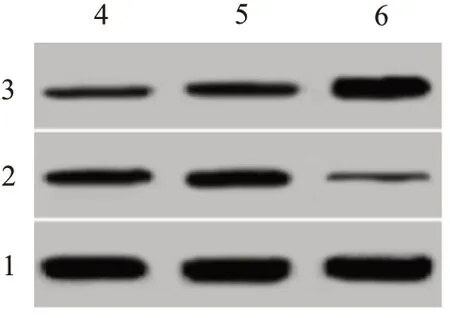
图1 Western blotting检测SNHG7 shRNA转染后的卵巢癌细胞中Vimentin、E-cadherin蛋白表达
2.2 SNHG7靶向调控miR-34aSNHG7和miR-34a有碱基互补结合位点,miR-34a mimics和SNHG7-WT共转染后的卵巢癌细胞荧光素酶活性下降(0.48±0.05)比(1.00±0.11),t=12.91,P<0.001。SNHG7靶向调控miR-34a。见图2。

图2 SNHG7和miR-34a碱基互补结合位点
2.3 下调SNHG7促进卵巢癌细胞中miR-34a表达Control、Sh-NC、Sh-SNHG7组细胞中miR-34a水平分别为(1.00±0.11)、(0.98±0.10)、(2.64±0.21)。与Sh-NC组比较,Sh-SNHG7组卵巢癌细胞中miR-34a水平升高(P<0.05)。下调SNHG7促进卵巢癌细胞中miR-34a表达。
2.4 miR-34a inhibitor对下调SNHG7的卵巢癌细胞增殖、克隆、迁移、侵袭以及Vimentin、E-cadherin蛋白表达影响与Sh-SNHG7+anti-miR-NC组比较,Sh-SNHG7+anti-miR-34a组卵巢癌细胞中miR-34a水平降低,SK-OV-3细胞增殖能力升高,SK-OV-3细胞克隆形成数、侵袭以及迁移数增多,Vimentin蛋白表达水平升高,E-cadherin蛋白表达水平下降,见图3,表2。
表2 miR-34a inhibitor和SNHG7 shRNA共转染后卵巢癌细胞中miR-34a水平、增殖、克隆、侵袭、迁移和Vimentin、E-cadherin蛋白表达水平比较∕±s

表2 miR-34a inhibitor和SNHG7 shRNA共转染后卵巢癌细胞中miR-34a水平、增殖、克隆、侵袭、迁移和Vimentin、E-cadherin蛋白表达水平比较∕±s
注:miR-34a为微小RNA-34a,SNHG7为小核仁RNA宿主基因7,Vimentin为波形蛋白,E-cadherin为上皮钙黏蛋白,Sh-SNHG7+anti-miR-NC为共转染SNHG7 shRNA和miR-34a抑制剂阴性对照,Sh-SNHG7+anti-miR-34a为共转染SNHG7 shRNA和miR-34a抑制剂,A值为吸光度值。①与Sh-SNHG7+anti-miR-NC比较,P<0.05。
?

图3 Western blotting检测miR-34a inhibitor和SNHG7 shRNA共转染后卵巢癌细胞中Vimentin、E-cadherin水平
3 讨论
lncRNA是不能编码蛋白质的RNA分子,其长度大于200 bp,在细胞增殖、个体发育等多种生物学过程中发挥调控作用[9]。lncRNA参与肿瘤进展,可能是肿瘤分子靶向治疗的生物靶标[10]。SNHG7是在人体组织中发现的lncRNA,其在不同组织中的表达不同,并且参与人体多种肿瘤的进展,目前在膀胱癌、非小细胞肺癌等组织中发现SNHG7异常表达,SNHG7表达改变影响细胞的生长以及转移过程,SNHG7可能是肿瘤治疗的有效靶点[6,11]。本研究结果表明,下调SNHG7后的卵巢癌细胞增殖、克隆能力下降,提示下调SNHG7具有抗卵巢癌细胞生长的作用,这与上述研究结果相符合,进一步说明了SNHG7在癌症中可能发挥类似癌基因的作用。
卵巢癌转移能力极强,其细胞转移是卵巢癌患者死亡的重要原因[12]。研究显示,上皮间质转化(EMT)是肿瘤转移的重要标志,发生EMT后的转移能力大大增加[13]。Vimentin、E-cadherin表达变化是EMT能力改变的可靠指标[14]。Vimentin还可以作为一种癌基因促进肿瘤进展。E-cadherin在肿瘤中表达下调,其表达上调后可以抑制肿瘤恶性转移[15]。本研究结果显示,下调SNHG7后卵巢癌细胞侵袭以及迁移能力降低,Vimentin表达水平减少,E-cadherin表达水平升高,提示上调SNHG7抑制卵巢癌细胞的转移潜能。
lncRNA广泛参与人体生理以及病理进程,并且在不同的组织及生理过程中的作用不同。lncRNA的调控机制复杂,这也是其功能多样的重要原因[16]。lncRNA可以通过不同靶向调控机制影响细胞的生长、组织分化,目前其调控机制还未完全阐明[17]。lncRNA可以通过碱基互补的方式影响miRNA的表达,从而通过多个调控网络影响细胞生物学行为[18]。本次实验表明,SNHG7和miR-34a互为靶向关系,并且下调SNHG7可以靶向促进卵巢癌细胞中miR-34a的表达。miR-34a是一个肿瘤关系密切的miRNA,参与调控肿瘤细胞的转移过程[19]。研究显示,miR-34a在骨肉瘤、肺癌、卵巢癌等中下调表达,影响细胞的生长和转移[20-24]。本实验显示,抑制miR-34a逆转下调SNHG7对卵巢癌细胞生长和转移潜能的抑制作用,提示下调SNHG7可以靶向促进miR-34a的表达阻碍卵巢癌进展。
综上,下调SNHG7表达可以在体外阻碍卵巢癌细胞的生长和转移,作用机制与靶向促进miR-34a的表达有关。我们的实验结果为研究SNHG7在卵巢癌中的网络调控作用提供了资料,为寻找有效的卵巢癌治疗生物靶标提供可思路。
