动态高压微射流对大豆分离蛋白性质和结构的影响
2021-12-31敬思群王德萍周苗苗纵伟
敬思群*,王德萍,周苗苗,纵伟
1. 韶关学院英东食品学院(韶关 512005);2. 新疆大学生命科学与技术学院(乌鲁木齐 830046);3. 郑州轻工业学院食品与生物工程学院,食品生产与安全河南省协同创新中心(郑州 450002)
动态高压微射流技术(DHPM)是一种新型的超高压均质方式,集输送、加压、混合、超微粉碎等的功能原理于一体。处理装置主要包括超微粉碎室、微射流室和超高压泵,料液进入超微粉碎室时,由于高压作用物料受到超微粉碎破坏大分子颗粒形成纳米微粒。其机理主要是结合空穴作用、剪切力和高速率,对样品产生巨大的压力,使物料起着较好的超细化处理效果[1-2]。动态高压微射流技术在食品、药品、生化等方面都有应用,如乳化均质、湿法超微化、大分子改性、灭菌、脂质体的制备等处理[3]。大豆分离蛋白(SPI)是食品加工中的重要原料,具有较高的营养价值和功能特性,大多研究集中于动态高压对大豆分离蛋白功能特性的影响,如起泡性、胶凝性、乳化性等[4-5],鲜见动态超高压对大豆分离蛋白水溶液的微观结构、理化性质和二级结构作用的报道[6]。
试验以20,40,80,120和160 MPa处理大豆分离蛋白溶液,分析动态高压微射流对大豆分离蛋白的粒径分布、Zeta电位、蛋白溶解度、蛋白质的二级结构和形貌变化的影响,为进一步研究动态高压对蛋白与多糖共存体系的影响奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
大豆分离蛋白(纯度达到90%,食品级,哈高科大豆食品有限公司);叠氮化钠;氢氧化钠、考马斯亮蓝、盐酸(均为分析级)。
FPG128000动态高压微射流(英国SFP公司);Nano-ZS90激光散射仪(英国Malern公司);XYFD-18冷冻干燥机(上海欣谕仪器有限公司);JSM-6490LV扫描电镜(日本JEOL公司);Vertex70傅里叶红外光谱仪(美国Bruker公司);T6紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试验方法
1.2.1 大豆分离蛋白水溶液的制备
将大豆分离蛋白加入到去离子水中,在磁力搅拌下配制成浓度2 mg/mL的母液,搅拌20 min后,经胶体磨将其细化及均匀分布,用1 mol/L NaOH调节溶液pH 7.0,在4 ℃下水化过夜,经20 MPa普通均质机均质后,得到大豆分离蛋白水溶液
1.2.2 动态超高压微射流处理
参照敬思群等[7]的方法稍作改动进行对大豆分离蛋白进行处理。采用高压微射流机均质机在均质压力分别为40,80,120和160 MPa对大豆分离溶液进行2次循环处理,以未经任何处理的大豆分离蛋白水溶液作为对照,以20 MPa下的大豆分离蛋白作为阳性对照,加入浓度0.02%的NaN3作为抑菌剂。除直接取样测定粒度分布外,剩余样品冷冻干燥后待测。
1.2.3 粒径和电位
参照Sun等[8]的方法稍作改动测定大豆分离蛋白溶液的粒径和电位。采用Nano-ZS90型激光散射仪同时对不同条件下处理的样品进行粒径和电位分析。
1.2.4 蛋白溶解性测定
参照张晶等[9]的方法稍作改动测定大豆分离蛋白溶解度。样品溶液在10 000 r/min下离心20 min后,取上清液稀释到合适的浓度,取1 mL于试管中,加入5 mL考马斯亮蓝试剂,振荡摇匀后,在595 nm处比色测定吸光度。原样品的总蛋白质含量则使用凯氏定氮法测定。上清液中蛋白质含量与原蛋白含量的比值即为溶解度指数S(%),S(%)表示的是蛋白溶解度。

1.2.5 傅里叶红外分析
根据陈登龙等[10]的方法稍作改动分析大豆分离蛋白功能基团的特征。冷冻干燥的样品与KBr混合,研磨压片,置于傅里叶红外光谱仪中扫描,每个样品扫描34次,检测器为HgCdTe,分辨率为4 cm-1,波数范围4 000~400 cm-1。
1.2.6 SEC扫描电镜分析
将样品冷冻干燥后粘于样品台上并进行喷镀电导层,在高分辨率扫描电子显微镜下观察大豆分离蛋白的形貌变化。
1.2.7 数据处理
采用Origin 8.5进行数据处理,用SPSS 17.0进行方差分析,p<0.05时表示差异性显著。所有试验平行3次,结果表示为均数±标准差。
2 结果与讨论
2.1 动态高压对大豆分离蛋白颗粒尺寸的影响
由图1可知:在常压下,大豆分离蛋白溶液中颗粒尺寸分布不均匀,出现3个峰,其中91.2%的颗粒的粒径达到429.133 nm,5.3%的颗粒的粒径尺寸达到86.27 nm,而3.5%颗粒的尺寸达到5 279.5 nm,总体上0.1 MPa下的大豆分离蛋白的平均粒径尺寸为259.80±19.126 nm。而20,40,80,120和160 MPa的条件下,颗粒的平均粒径分别为202.60±8.591 nm、174.73±3.403 nm、159.13±4.398 nm、153.90±5.237 nm和147.6±2.851 nm。总之粒径体积分数分布随着压力增加向小粒径尺寸移动。这与Sun等[11]研究动态高压微射流对玉米蛋白的粒径分析相似。

图1 动态高压微射流对大豆分离蛋白溶液粒径体积分数的影响

表1 不同压力下大豆分离蛋白粒径尺寸方差分析

表2 不同压力下大豆分离蛋白粒径尺寸多重比较
根据方差分析和多重比较可知,动态高压微射流对大豆分离蛋白的粒径分布有显著影响,120和160 MPa下的大豆分离蛋白与80和40 MPa下的大豆分离蛋白的平均粒径相比,有显著性差异(p<0.05);80和40 MPa下的大豆分离蛋白的平均粒径与20 MPa下的大豆分离蛋白相比,有显著差异性(p<0.05);与0.1 MPa下相比,20 MPa下大豆分离蛋白的平均粒径有显著性差异(p<0.05)。
2.2 动态高压对大豆分离蛋白Zeta电位的影响
在大豆分离蛋白溶液中,其颗粒稳定的存在在水溶液中不仅与颗粒大小有关,还与其表面带点情况有密切的关联。未经动态高压微射流处理大豆分离蛋白水溶液(即0.1 MPa下的大豆分离蛋白)Zeta电位达到-26.30±0.624,20,40,80,120和160 MPa下大豆分离蛋白水溶液的Zeta电位分别为-22.13±0.569,-22.767±1.600,-22.867±1.422,-22.867±1.050和-21.80±0.692,由图2可知,动态高压微射流对大豆分离蛋白水溶液的Zeta电位的影响与常压下的大豆分离蛋白溶液具有显著性差异(p<0.05)。由于Zeta电位均为负值,说明大豆分离蛋白表面带负电荷,即相同电荷的粒子间相互排斥,所以大豆分离蛋白间不易形成聚合体,从而增加蛋白溶液的稳定性。对照组与不同压力下的蛋白溶液相比,在压力作用下,其Zeta电位有所上升,其主要可能是由于动态高压微射流处理大豆分离蛋白破坏蛋白表面结构,导致内部部分带正电荷的物质暴露,导致Zeta电位上升[12]。

图2 动态高压微射流对大豆分离蛋白水溶液Zeta电位的影响
2.3 动态高压微射流对大豆分离蛋白溶解性的影响
以牛血清蛋白为标准蛋白,制作标准曲线,从而进一步测定溶液的蛋白含量,标准曲线标准方程为y=0.158 6x-0.143 9,R2=0.998 3。如图3所示,随着压力升高,大豆分离蛋白溶解性也发生一定变化,压力从0.1 MPa升到40 MPa时,其溶解性呈直线上升,而压力超过40 MPa后其溶解性无显著性变化,即动态高压微射流在一定程度上可以提高蛋白质的溶解性。

图3 动态高压微射流对大豆分离蛋白溶解性的影响
2.4 动态高压微射流对大豆分离蛋白二级结构的影响
傅里叶红外光谱对不同压力下的大豆分离蛋白进行鉴定,由于蛋白质的官能团在红外图谱上表现相应的特征吸收峰,从而来判断动态高压微射流对大豆分离蛋白结构的影响[13]。蛋白质最常见的二级结构分析是酰胺带,酰胺Ⅰ(1 600~1 700 cm-1)其振动频率取决于C=O和N—H之间的氢键性质,酰胺Ⅱ带(1 600~1 500 cm-1)振动频率取决于C—N伸缩振动和N—H面内角变振动,酰胺Ⅲ带(1 300~1 200 cm-1)其振动频率取决于C=O的伸缩振动和N—H面内变角振动,特征振动频率反映了蛋白质的二级结构中的α-螺旋、β-折叠、β-拐角和无规则卷曲[14-16]。如图4所示,大豆分离蛋白在3 267 cm-1处主要是—NH的伸缩振动,其吸收峰主要是(RCORNH)的吸收峰。波数在1 631 cm-1和1 525 cm-1也出现强吸收峰,波数在1 631 cm-1的吸收峰主要是由—C=O的伸缩振动引起,波数1 525 cm-1时是由于N—H面内弯曲振动造成,其谱带为酰胺Ⅱ带,而—CH—亚甲基的对称伸缩振动带和反对称伸缩振动的波数在3 066 cm-1和2 923 cm-1处,—CH弯曲振动的波数在1 446 cm-1和1 397 cm-1处,波数在1 234 cm-1和1 072 cm-1出现的峰分别是由于—CH和—CN的伸缩振动形成的峰。经过动态高压微射流处理后大豆分离蛋白的红外光谱图发生轻微差异。由—NH伸缩振动造成的峰的波数由3 267 cm-1处分别移至3 382,3 276,3 273,3 271和3 276 cm-1,其均有红移趋势,亚甲基对称伸缩振动和反对称伸缩振动在不同压力下也产生不同趋势的红移现象。其中在80 MPa下的大豆分离蛋白在波数1 462 cm-1的位置上峰变化较大,红移16 cm-1,在此峰位置的其他压力下的大豆分离蛋白也发生一定红移趋势,表明动态高压微射流对大豆分离蛋白二级结构中的—CH基团影响较大从而产生弯曲振动。由红外光谱图可知动态高压微射流处理大豆分离蛋白后并没有产生新的化学结构和功能性基团,但吸收峰的波数因压力的变化而变化,均发生不同程度的红移或蓝移现象,并其峰面积也发生一定变化,故大豆分离蛋白分子中的特殊官能团的含量也发生一定变化,造成蛋白质的二级结构的变化,即α-螺旋、β-折叠、β-拐角和无规则卷曲的含量也随之变化,在高压作用下发生相互转化。
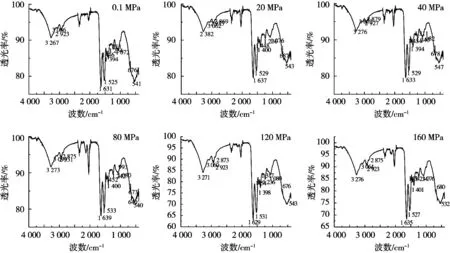
图4 不同压力下大豆分离蛋白的傅里叶红外光谱图
2.5 动态高压微射流对大豆分离蛋白表面特征的影响
由图5可知,0.1 MPa下(未经动态高压处理的常压下)处理的大豆分离蛋白表面光滑,大小不一,并有团聚现象,结构紧密。蛋白质与蛋白质之间易形成聚合体,分布比较集中。20 MPa下的大豆分离蛋白结构明显被破碎,经压力作用下蛋白表面不光滑,有少量被破碎的蛋白出现,结构稍微开始松散,但仍有聚合现象产生。经过动态高压微射流后压力达到40 MPa时,蛋白质与蛋白质之间形成丝状网络结构,并未使蛋白质破碎成小颗粒,丝状蛋白表面光滑细腻,可能是由于大豆分离蛋白经动态超高压微射流两次微射流化,第1次时大豆分离蛋白剧烈破碎,蛋白质分子官能团暴露,经第2次的微射流时由于压力的作用使得蛋白质与蛋白质相互作用从而聚合形成丝状网络结构[17-18]。压力达到80 MPa时,由于过高压力,使得蛋白质与蛋白质不易进行聚合,故形不成聚合物,而蛋白质被破碎成更小微粒。压力达到120 MPa时,其图像与40 MPa下相似,但其丝状网络结构部分被破坏,其粗细不均匀,颗粒较大。160 MPa下的大豆分离蛋白由于超高压力、高剪切力及空穴作用,其形成大量的不规则小颗粒和玻片,其形貌基本与80 MPa压力下的大豆分离蛋白形貌相似。

图5 0.1,20,40,80,120和160 MPa处理大豆分离蛋白的扫描电镜图
上述变化表明,经动态高压微射流处理的大豆分离蛋白的样品颗粒形貌发生较大变化。随着压力升高,大豆分离蛋白的破碎程度发生不同变化,并聚集程度也有所变化。压力达到160 MPa时,大豆分离蛋白彻底被破坏成为细小颗粒,其现象均与大豆分离蛋白的粒度变化和蛋白质的二级结构变化相一致。
3 结论
随着压力升高,大豆分离蛋白的粒径逐渐减小,在不同压力下的大豆分离蛋白平均粒径与常压下(0.1 MPa)大豆蛋白溶液相比有显著性差异(p<0.05),动态高压微射流下的大豆分离蛋白Zeta电位与常压下大豆分离蛋白相比有显著性的差异(p<0.05);随着压力升高,其溶解性也逐渐升高,压力超过40 MPa后,其溶解性不再随压力变化而变化;傅里叶红外光分析发现动态高压微射流处理大豆分离蛋白并没有产生新的化学结构和功能性基团,但分子中的特殊官能团的含量发生变化,造成蛋白质的二级结构的变化;不同压力下的大豆分离蛋白颗粒形貌发生较大变化,随着压力升高,其破碎和聚集程度均发生变化。
