磁共振常规及多b值DWI序列对家兔肢体高压电击伤的诊断
2021-12-31郭威杨凡孙斯琴王潇
郭威,杨凡,孙斯琴,王潇
1.武汉市第三医院(武汉大学附属同仁医院)放射科, 湖北 武汉 430063;2.中国人民解放军中部战区总医院 急诊科,湖北 武汉 430070
引言
高压电击伤会造成接触点和深部组织的损伤,由于电流的产热性,电击出入口常呈现碳样化[1]。电击伤造成的损伤范围深而广,能够对肌肉、肌腱、血管、骨骼以及神经等造成损伤[2]。现阶段电击伤治疗的方式为焦痂、筋膜切开减张术,对伤口的及时清创是电击伤治疗效果的核心影响因素,若清创过早不能确定坏死界限,清创过晚坏死范围增加[3]。对肢体软组织坏死情况的及时判断,是确认机体是否可以开始清创手术的关键。目前,临床上常用彩色多普勒超声、数字减影技术、放射性血池显像法、MRI等技术进行高压电击伤软组织坏死范围的影像学检查[4]。MRI具备参数灵活、多层面扫描、分辨力高等优势,MRI常规序列可一次性提供判断电击伤肢体肌肉、韧带、肌腱、骨骼的影像学信息,配合增强扫描、磁共振扩散加权成像(Diffusion Weighted Imaging,DWI),根据肢体软组织损伤的信号特点和强化程度,可以反映损伤组织的缺血、出血、水肿、坏死等一系列病理变化,为临床清创提供解剖、病理依据[5]。据有关文献报道,b值的选择是DWI中的关键技术,b值增大时DWI成像的扩散权重随之增大;当b值较小时,DWI信号强度受血流灌注的影响增大[6]。因此研究探讨了不同b值作用下,DWI成像效果,并创新性地联合MRI常规,分析不同b值下,家兔肢体高压电击伤的实际诊断情况。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂
戊巴比妥钠溶液(国药集团,中国),欧乃影(钆双胺,GEHealthcare,上海),0.9%生理盐水(武汉市第三医院放射科,中国),HE染色相关试剂(武汉贝茵莱生物科技有限公司,中国)。
1.1.2 实验动物
空腹状态下体重为2.0~3.0 kg的清洁级大白兔30只(华中科技大学动物实验室,中国),雌雄不限,适应性饲养7 d。
1.2 方法
1.2.1 动物及分组
当b值过高时,将会对实验兔相应位置的神经产生一定的刺激作用,造成周围细胞、组织形态的变化,进而影响实验结果的观察。为避免该种影响,研究过程中将30只实验兔随机分为病例组(16只)与影像组(14只),病例组中的大白兔于电击后2、24、48、72 h,分别处死1只兔子,取膝关节以上2 cm和膝关节以下2 cm处的组织做病理切片,行HE染色,观察视野内细胞损伤/坏死的情况;对影像组的14只家兔,电击后2、24、48、72 h,行MRI平扫联合多b值DWI及增强扫描,分别测量了膝关节以上2 cm和膝关节以下2 cm处肌肉损伤区的中心(深层)/浅层/边缘(损伤区边缘)不同b值(b=400、600、800、1000、1200 s/mm2)的表观扩散系数(Apparent Diffusion Coeffecient,ADC)值,同一b值同一位置均测量3次。
1.2.2 实验模型建模
① 所有实验兔按体重1 mL/kg于耳缘静脉注射30 g/L的戊巴比妥钠溶液进行麻醉后,进行MRI相关序列扫描;② 继续饲养2 d直至确认造影剂完全排出;③ 按体重1 mL/kg于实验兔的耳缘静脉注射30 g/L的戊巴比妥钠溶液进行麻醉;④ 采用自制电击设备(电击电压:2000 V,电击时间:0.2 s)构建电击模型。将电击设备的小电极置于实验兔左侧膝关节以下5 cm小腿内侧肌肉处,构成电击入口;将电击设备的大电极置于对应实验兔左侧膝关节以上5 cm大腿内侧肌肉处,构成电击出口。
1.2.3 指标检测
按体重1 mL/kg于实验兔的耳缘静脉注射30 g/L的戊巴比妥钠溶液进行麻醉,麻醉后将兔仰卧位,头固定于16通道头颈专用相控阵线圈,通过1.5 T MR机(GE)行左腿扫描,常规矢状位:T1WI压脂/T2WI、冠状位:T1WI、轴位 T2WI+FS、 多 b值 DWI(b=400、600、800、1000、1200 s/mm2)和左侧腿增强扫描。通过双筒高压注射器经兔耳缘静脉团注射欧乃影,注射剂量为0.2 mmol/kg,流率为1.0 mL/s,随后同样流率注射0.9%生理盐水5 mL冲管。在后处理软件上测量ADC值。选择股骨中段层面的图像,手动勾画感兴趣区(Region of Interest,ROI),ROI=2.5,避开皮下脂肪层、筋膜、血管,每个ROI测量3次,取平均值。
1.3 统计学分析
软件SPSS 20.0进行实验相关数据的统计处理,计量资料以“均值±标准差”表示,通过t检验;计数资料以χ2检验,P<0.05差异有统计学意义。
2 结果
2.1 高压电击后兔肢体软组织损伤情况
根据家兔肢体软组织的MRI扫描结果可知,高压电击烧伤后24 h家兔肢体可见肿胀,损伤处软组织信号表现出弥漫性稍长T2信号,同时信号不均匀;高压电击烧伤后48 h,可见家兔电击损伤位置的软组织中,弥漫性稍长T2信号范围呈现逐渐增长的状态。高压电击烧伤后,家兔肢体出现皮下软组织肿胀、皮下积液、肌间隙内液性渗出,损伤处呈现不均匀的高信号,且高低信号夹杂,见图1~2。
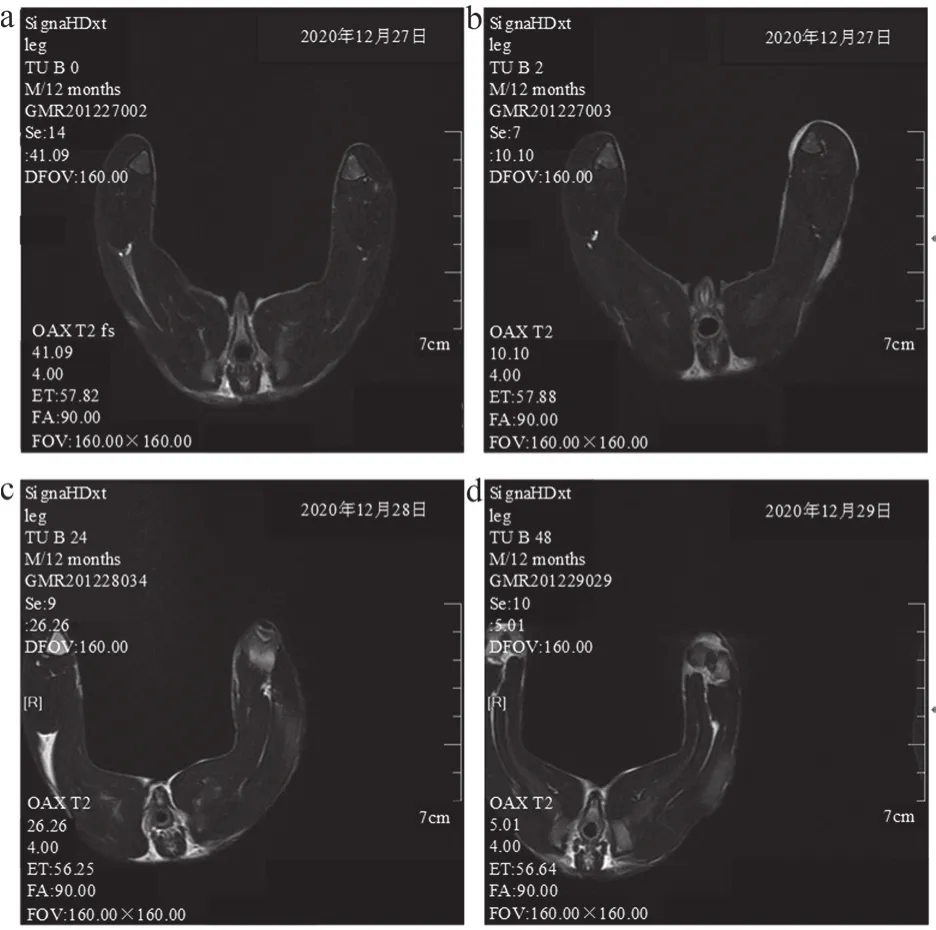
图1 高压电击后兔肢体软组织损伤情况(影像图)

图2 高压电击后兔肢体成像表现
由病例组中家兔的HE染色结果可知,接受高压电击烧伤后的软组织主要分为三种情况(图3): ① 完全坏死的软组织,其中肌肉组织的横纹肌组织凝固,组织间质出现水肿,充血伴片状出血;② 正常细胞与坏死细胞混杂,血管外渗红细胞、小血管周围出现炎性细胞(如图3黑色箭头所示);③ 软组织发生水肿,横纹肌间质水肿,同时有大量炎性细胞浸润。

图3 高压电击后48 h兔肢体软组织病理变化
2.2 高压电击后兔肢体软组织ADC值变化情况
高压电击烧伤后24 h时,检测电击损伤不同位置中的ADC值。随着扩散敏感梯度场参数(b值)的增加,同一位置下的ADC值呈现逐渐减小的趋势。在家兔膝关节肌肉损伤区的中心(深层)处,相比于b=400 s/mm2时对应的 ADC值(1.86±0.30),b=1200 s/mm2时对应的ADC值(1.13±0.45)出现一定幅度的降低,差异有统计学意义(t=3.019,P=0.024)。兔膝关节肌肉损伤区的浅层处,相比于b=400 s/mm2时对应的ADC值(1.40±0.20),b=800、1000、1200 s/mm2时对应的ADC值降低(P=0.021、0.019、0.004)。兔膝关节肌肉损伤区的边缘处,相比于 b=400 s/mm2时对应的ADC值(1.17±0.31),b=800、1000、1200 s/mm2时对应的ADC值降低(t=2.449、3.506、4.507,P=0.044、0.013、0.006)。b=400 s/mm2时,兔膝关节肌肉损伤区的中心(深层)处对应的ADC值高于浅层与边缘(t=2.853、3.577,P=0.029、0.009)。上述结果反映,同一b值下,损伤区的中心(深层)处对应的ADC值最高,其次为浅层、边缘;同一位置随着b值的增大,ADC值不断减小,见图4。

图4 高压电击后24 h不同b值下家兔不同位置的ADC值
高压电击烧伤后48 h时,检测电击损伤不同位置中的ADC值。随着b值的增加,同一位置下的ADC值逐渐减小。无论从膝关节肌肉损伤区的深层、浅层还是边缘等范围上看,相较于b=400 s/mm2时的ADC值,b=600、800、1000、1200 s/mm2时对应的ADC值均减少,差异有统计学意义(P<0.05)。b值相同时,膝关节肌肉损伤区深层的ADC值最高,其次为浅层,最后为边缘。b值为400 s/mm2时,膝关节肌肉损伤区浅层、边缘的ADC值均小于深层,差异有统计学意义(t=5.340、5.711,P=0.001、<0.001)。b值为600、800、1000、1200 s/mm2时,膝关节肌肉损伤区浅层、边缘的ADC值均小于深层,差异有统计学意义(P<0.05),见图5。

图5 高压电击后48 h不同b值下家兔不同位置的ADC值
高压电击烧伤后72 h时,检测电击损伤不同位置中的ADC值。随着b值的增加,同一位置下的ADC值逐渐减小。相较于b=400 s/mm2时的ADC值,同一位置下,b=600、800、1000、1200 s/mm2时对应的ADC值均减少,差异有统计学意义(P<0.05)。膝关节肌肉损伤区深层,相较于b=600 s/mm2时的ADC值,b=800、1000、1200 s/mm2时对应的ADC值均较低,差异有统计学意义(P<0.05),说明高压电击伤后72 h时,膝关节肌肉损伤区深层组织内的水分子运动受限增大,提示肢体软组织坏死情况加重。b值相同时,膝关节肌肉损伤区深层的ADC值最高,其次为浅层,最后为边缘。b值为400s/mm2时,膝关节肌肉损伤区浅层、边缘的ADC值均小于深层,差异有统计学意义(P<0.01)。b值为 600、800、1000、1200 s/mm2时,膝关节肌肉损伤区浅层、边缘的ADC值均小于深层,差异有统计学意义(P<0.05),见图6。
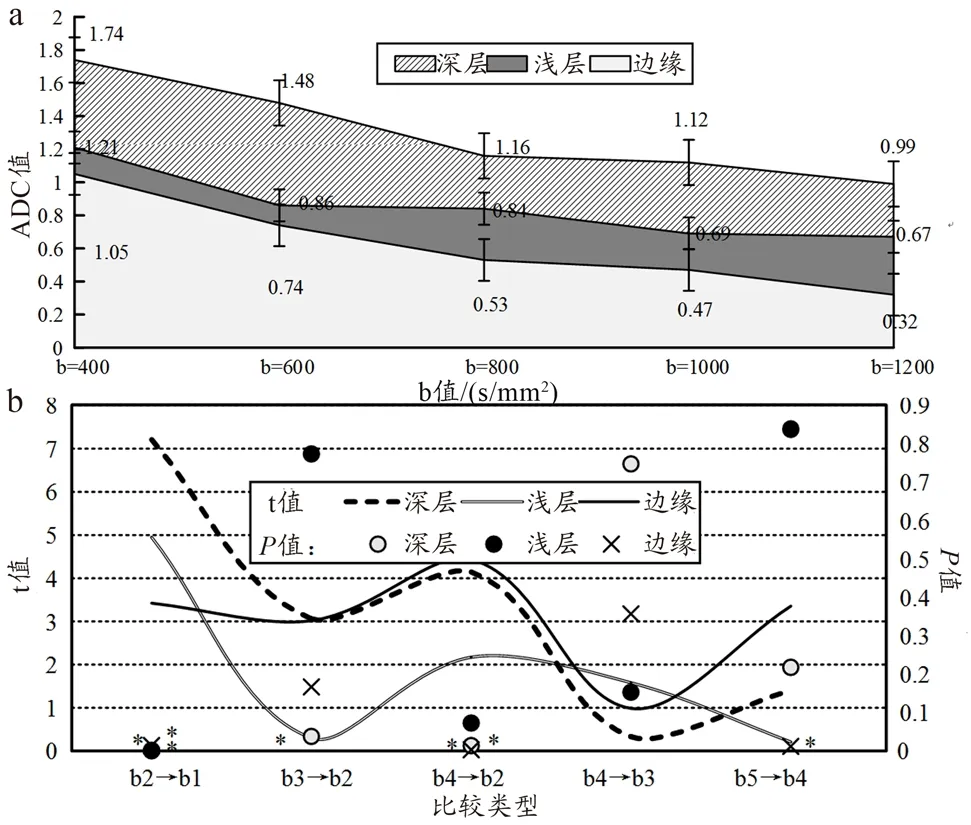
图6 高压电击后72 h不同b值下家兔不同位置的ADC值
当高压电击烧伤后时间相同时,随着b值的增加,家兔膝关节损伤处ADC值逐渐降低。与b=400 s/mm2的ADC值相比,b值取1000 s/mm2、1200 s/mm2的ADC值呈现一定幅度的减少,且高压电击烧伤后24 h的P值依次为0.040、0.015,高压电击烧伤后48 h的P值依次为0.031、0.017,高压电击烧伤后72 h的P值依次为0.035、0.019。相同b值下,高压电击烧伤后24 h的ADC值最高,其次为高压电机烧伤后48 h的ADC值,高压电击烧伤后72 h的ADC值,说明随着高压电击烧伤时间的延长,兔膝关节肌肉组织的损伤程度大幅度加重,提示烧伤范围内的组织、细胞已基本坏死,见图7。
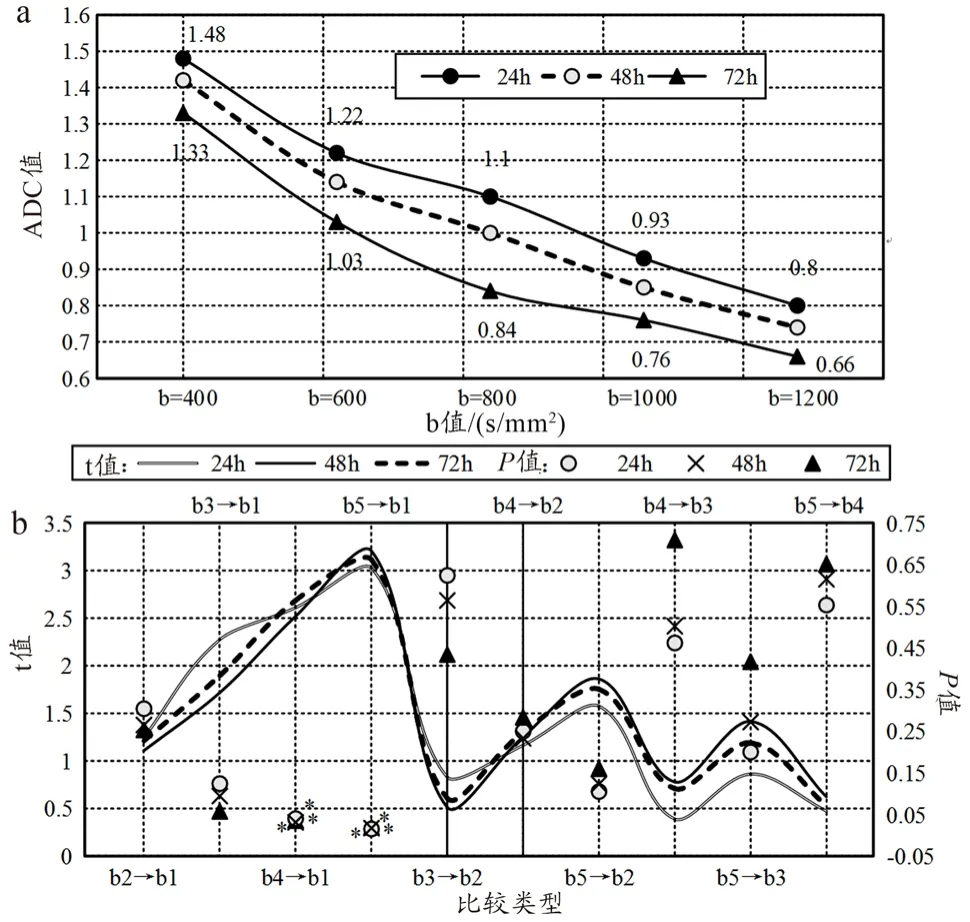
图7 高压电击后不同时间、不同b值下家兔的ADC值
3 讨论
DWI可用于检测活体组织内的水分子扩散情况,其以测量同一组织在施加扩散敏感梯度场前后的信号强度变化,实现对组织中水分子扩散状态的检测,进而反映出组织微观结构的变化[7-8]。其中施加的扩散敏感梯度场参数即为b值,随着b值的增加,病变组织与正常组织的对比度增大,但图像的信噪比降低[9]。鉴于血流灌等形式的水分子运动均会对DWI检测到的扩散系数造成影响,因此DWI检测到的扩散系数为ADC。有文献表明,利用DWI进行超早期脑缺血的诊断时,若DWI上表现为高信号,则说明机体有可能出现细胞毒性水肿,该水肿是由于急性脑缺血缺氧导致的,即DWI可以尽早发现梗塞区的异常信号[10]。
相关文献报道,利用MRI技术对高压电烧伤软组织损伤程度进行临床诊断时,当扫描结果显示软组织出现不均匀异常强化信号、不均匀异常减弱信号时,提示软组织发生肌肉水肿以及肌肉坏死[11-12]。术中对高压电击烧伤后不同时间段的兔子损伤组织作病理切片,切片结果显示,高压电击烧伤后烧伤处软组织呈现完全坏死、部分坏死、软组织水肿等三种程度不同的损伤表现。完全坏死处的肌肉组织的横纹肌组织凝固,组织间质出现水肿,充血伴片状出血;部分坏死处的组织中,正常细胞与坏死细胞混杂,并伴有血管外渗红细胞、炎细胞出现;发生水肿的软组织中,横纹肌间质水肿,并存在大量炎性细胞。磁共振常规扫描结果显示,高压电击烧伤后24 h家兔肢体可见肿胀,损伤处软组织信号表现出弥漫性稍长T2信号;高压电击烧伤后48 h,T2信号范围逐渐增长;家兔肢体出现皮下软组织肿胀、皮下积液、肌间隙内液性渗出,损伤处出现不均匀的高低信号,这与文献结果相符。
电击伤的病理机制较为复杂,细胞膜直接电通透性越高,组织受损程度越重,同时焦耳热作用、非热作用的发生与电压强弱、电流持续时间、电流通路上细胞所处位置均存在关系[13]。肌肉活力的判断在电击伤治疗中至关重要,DWI成像可现实组织内所含水分子的运动状态,活体组织中水分子运动受到限制,病变组织内水分子运动受限程度高于正常组织内,水分子运动受限越大,所检测的ADC值下降趋势明显[14-16]。高压电击烧伤后,ADC值随扩散敏感梯度场参数(b值)的增加而降低;膝关节肌肉损伤区的深层、浅层、边缘的ADC值呈现逐渐降低的趋势,如高压电击伤后24 h、b=400 s/mm2时,兔膝关节肌肉损伤区的中心(深层)处对应的ADC值高于浅层与边缘(t=2.853、3.577,P=0.029、0.009)。这主要是因为高压电击伤时,可在损伤组织内形成强低频电场,增加细胞膜电通透性,进而导致跳跃性损伤或者“夹心样”坏死。高压电击烧伤后48 h时,相较于b=400 s/mm2时的ADC值,b=600、800、1000、1200 s/mm2时对应的ADC值均减少,差异有统计学意义(P<0.05);高压电击烧伤后72 h时,相较于b=400 s/mm2时的ADC值,同一位置下,b=600、800、1000、1200 s/mm2时对应的ADC值均减少,差异有统计学意义(P<0.05)。当高压电击烧伤后时间相同时,随着b值的增加,家兔膝关节损伤处ADC值逐渐降低,即损伤组织的ADC值随施加的扩散敏感梯度场参数的增加而降低;相同b值下,高压电击烧伤后家兔膝关节软组织ADC值由高到低对应的电击后时间依次为24、48、72 h,提示随着高压电击烧伤时间的延长,兔膝关节的肌肉组织、细胞已基本坏死。
综上所述,磁共振常规联合多b值DWI序列能够进行家兔高压电击伤软组织损伤情况的诊断,且定位准确,可辅助进行高压电击伤伤口清创时间的选择,避免多次手术,降低脓毒症发生概率。
