ROCK抑制剂对青光眼术后瘢痕形成的作用机制
2021-12-31刘莉莉招志毅曾招荣
刘莉莉 招志毅 曾招荣
(广西医科大学第四附属医院柳州市工人医院眼科,柳州 545005)
青光眼是由于眼压升高导致的进行性视神经损害、视野缺损的一种不可逆的致盲眼病。青光眼的患病人数较多,在2010年之前全球就已经累计近亿人,且呈上升趋势[1]。据相关报道,我国青光眼患者45 岁以上发病率较高,其中近一半的患者最终发展为眼盲[2]。药物在青光眼中期以后便不能控制眼内压水平,此时需要外部手术来进行治疗,但需要面临手术失败的后果。在手术失败后滤过道愈合的过程中,血小板与凝血级联反应使细胞的炎症因子增加,最后形成瘢痕[3]。临床上一般会应用干扰素等药物提高手术成功率,但药物对机体产生危害。Rho 相关卷曲螺旋形成蛋白激酶(rho associated coiled coil forming protein kinase,ROCK)是一种细胞内的信号通路分子,其不同的表达会影响细胞发育。ROCK 抑制剂是可调节ROCK 活性的复合物[4],有研究者用ROCK 抑制剂治疗术后瘢痕,效果较为明显[5],但其作用机制尚不明确。因此,本研究探讨ROCK 抑制剂对青光眼手术导致瘢痕的影响,分析其对瘢痕形成的作用机制。
1 材料和方法
1.1 实验动物与试剂
健康大鼠28 只购自君科生物公司,鼠龄1~2月,体质量200~250 g,常规饲养,温度在25.6 ℃左右。
氯霉素眼液(长春迪瑞公司);阿托品眼膏(沈阳兴齐公司);10-0 尼龙线(东莞博斯蒂公司);金霉素眼膏(上海通用公司);ROCK 抑制剂Y-27632(上海泽叶公司);胰蛋白酶(南宁庞博生物公司)。
1.2 青光眼模型的建立及分组
28 只健康大鼠术前1 d 采用氯霉素滴眼,均采取右眼为实验眼。0.15 mL/kg 速眠新注射液肌内注射麻醉后,氯霉素冲洗眼结膜,在右眼鼻上端角膜缘为底部的结膜瓣,暴露巩膜,做大小为4 mm×3 mm、深度为1/2 的四方形巩膜瓣,分离至清亮角膜内至少0.5 mm 处,做1 mm×2 mm 大小的小梁组织切除,并做虹膜根部切除;将巩膜复位对合后采用10-0 尼龙线缝合巩膜瓣,8-0 尼龙线缝合结膜瓣。术毕,采用0.5%金霉素眼膏和阿托品眼膏涂抹患眼,术后连续3 d 氯霉素眼药水点眼1~2 次,每次1~2 滴。28 只青光眼模型分为2 组,模型组14 只:青光眼模型大鼠常规饲养;RR 组14只:在青光眼模型建立成功24 h 后,进行玻璃体腔注射ROCK 抑制剂Y-27632(30 μmol/L)5 μL,15 d 后10%水合氯醛(500 mg/kg)麻醉大鼠,取右眼眼球放置-80℃保存备用。
1.3 瘢痕组织成纤维细胞的培养
取各组大鼠滤过道瘢痕组织,置于培养皿内,PBS 漂洗2 次,加入适量胎牛血清(fetal calf serum,FCS),将瘢痕组织剪碎,筛网过滤,将含组织块的FCS 混合液均匀覆盖于50 mL 培养瓶接种面,轻轻翻转培养瓶使组织贴壁面朝上。贴壁4 h后加入含有双抗及10%FCS 的DMEM 培养液,置37℃,5%CO2培养箱内,每周换液2~3 次,待细胞融合后,用0.125%的胰蛋白酶消化,以1∶2 传代,取传至第4~9 代的细胞进行实验。
1.4 MTT 法测定瘢痕组织中成纤维细胞增殖
取对数生长期的成纤维细胞,用胰蛋白酶消化成单细胞悬液,接种于培养板,常规培养24 h。采用酶标仪于490 nm 波长下测定吸光度(A490)值,计算成纤维细胞的抑制率。
1.5 RT-PCR 检测滤过道瘢痕组织转化生长因子-β1(transforing growth factoe-β1,TGF-β1)、ROCK、α 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)mRNA 表达
将术后28 d 的2 组大鼠滤过道瘢痕组织加入胰蛋白酶消化,提取细胞重悬液,冲洗,置入无菌试管中,采用TRIzol 试剂提取RNA,逆转录为DNA,对TGF-β1、ROCK、α-SMA mRNA 进行扩增,β-actin 为内参,引物序列见表1。PCR 反应条件:98 ℃6 min,98 ℃28 s,75 ℃30 s,80 ℃4 min,总计55 个循环,用2-△△Ct法计算2 组大鼠滤过道瘢痕组织中基因的相对表达水平。

表1 引物序列
1.6 免疫组织化学检测滤过道瘢痕组织白介素(interleukin,IL)-1β(IL-1β)、α-SMA 表达
2 组大鼠于第7 周断头处死,取眼部术后瘢痕组织脱蜡、常规切片,胰蛋白酶消化修复抗原,H2O2去除过氧化物酶活性,加 IL-1β、α-SMA 一抗、生物素标记二抗、辣根过氧化物酶标记链霉素工作液,DAB 显色,蒸馏水终止显色;脱水,透明,封片,光学显微镜下观察,以组织中出现棕黄色染色为阳性表达。每组任意选取6 张石蜡切片,拍照记录。
1.7 免疫印迹检测滤过道瘢痕组织IL-1β、IL-6、血管内皮生长因子(vascular endothlial growth factor,VEGF)、α-SMA 蛋白的表达
将青光眼术后瘢痕组织进行裂解,并提取蛋白,并对蛋白的浓度进行测量,分装后,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液按照4∶1 比例混匀,煮沸使蛋白质变性,将蛋白样品(50 μg)转移PVDF 膜上,脱脂奶粉封闭1 h。加入一抗(1∶150)稀释后孵育过夜,TBS 漂洗3 次,每次10 min,最后加入二抗常温孵育。取出PVDF膜,每隔10 min 漂洗1 次,共3 次,DAB 显色后照相。严格按照IL-1β、IL-6、VEGF 试剂盒说明操作,计算各蛋白表达含量。
1.8 统计学处理
采用SPSS 23.0 统计学软件进行分析。计量资料数据以±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ROCK 抑制剂对瘢痕成纤维细胞增殖的影响
MTT 法测定结果显示,模型组成纤维细胞的抑制率为60.12%±5.21%,低于RR 组的抑制率91.12%±0.94%,差异有统计学意义(P<0.05),说明ROCK 抑制剂可抑制瘢痕成纤维细胞的增殖。
2.2 术后滤过道瘢痕组织TGF-β1 mRNA、ROCK mRNA、α-SMA mRNA 的表达
RT-PCR 检测结果显示,建模组大鼠滤过道瘢痕 组 织TGF-β1 mRNA、ROCK mRNA、α-SMA mRNA 的表达均显著高于RR 组,差异均有统计学意义(P<0.05)(表2)。
表2 滤过道瘢痕组织TGF-β1 mRNA、ROCK mRNA、α-SMAmRNA 的表达(n=14,±s)

表2 滤过道瘢痕组织TGF-β1 mRNA、ROCK mRNA、α-SMAmRNA 的表达(n=14,±s)
*P<0.05 vs 模型组
组别 TGF-β1 mRNA ROCK mRNA α-SMA mRNA模型组 1.00±0.00 1.00±0.00 1.00±0.00 RR 组 0.35±0.01* 0.27±0.03* 0.23±0.02*
2.3 滤过道瘢痕组织IL-1β、α-SMA 阳性表达
免疫组织化学检测结果显示,RR 组大鼠滤过道瘢痕组织中IL-1β、α-SMA 的阳性表达低于模型组(P<0.05),说明ROCK 抑制剂可抑制IL-1β、α-SMA 的阳性表达(表3,图1)。
表3 滤过道瘢痕组织IL-1β、α-SMA 的阳性表达(n=14,±s,%)

表3 滤过道瘢痕组织IL-1β、α-SMA 的阳性表达(n=14,±s,%)
*P<0.05 vs 模型组
组别 IL-1β α-SMA模型组 30.12±2.85 60.15±4.21 RR 组 22.47±1.04* 34.26±0.03*

图1 大鼠滤过道瘢痕组织 IL-1β(A1、B1)、α-SMA(A2、B2)阳性表达,免疫组织化学显色,×400
2.4 滤过道瘢痕组织IL-1β、IL-6、VEGF、α-SMA蛋白表达
免疫印迹检测结果显示,模型组大鼠滤过道瘢痕组织IL-1β、IL-6、VEGF、α-SMA 的表达水平高于RR 组,差异有统计学意义(P<0.05),说明ROCK 抑制剂可使IL-1β、IL-6、VEGF、α-SMA的表达降低(表4、图2)。
表4 滤过道瘢痕组织IL-1β、IL-6、VEGF、α-SMA蛋白的表达(n=14,±s)

表4 滤过道瘢痕组织IL-1β、IL-6、VEGF、α-SMA蛋白的表达(n=14,±s)
*P<0.05 vs 模型组
组别 IL-1β IL-6 VEGF α-SMA模型组 1.42±0.18 1.30±0.13 1.26±0.11 1.56±0.21 RR 组 0.32±0.03* 0.41±0.05* 0.35±0.04 0.47±0.07
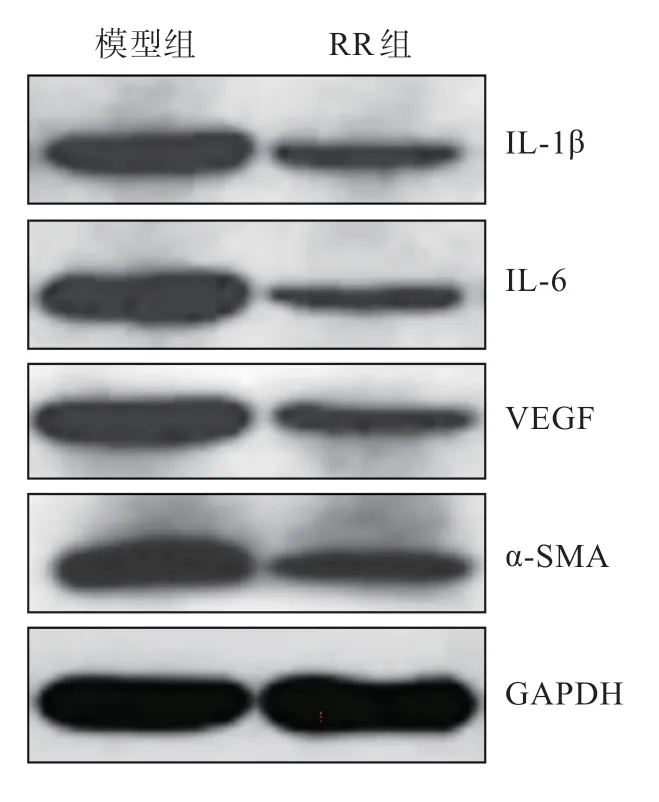
图2 大鼠滤过道瘢痕组织IL-1β、IL-6、VEGF、α-SMA 蛋白表达免疫印迹电泳图
3 讨论
青光眼滤过道术失败后,手术区可形成瘢痕,瘢痕的形成与成纤维细胞的增殖以及TGF-β1、VEGF 的异常表达有着密切的联系。近年来的研究表明,ROCK 抑制剂可降低成纤维细胞增殖,改善血流动力学,增加眼部血供,减少炎症因子的表达,抑制眼部神经细胞的凋亡,加速神经元生长,对眼部神经起到一定保护作用[6-9]。因此,抑制瘢痕形成在青光眼滤过术治疗中具有重要作用。
本研究结果表明,ROCK 抑制剂可抑制青光眼术后瘢痕成纤维细胞增殖。青光眼滤过性手术后,由于血-房水屏障的破坏以及手术区的炎症反应,使得成纤维细胞大量增殖,导致结膜下组织纤维化和滤过道瘢痕形成。蒋鹏飞等[10]研究表明,青光眼有效成分通过抑制胶原纤维、成纤维细胞特异性蛋 白1(fibroblast-specific protein 1,FSP-1)、结缔组织生长因子(connective tissue growth factor,CTGF)的表达,降低肌成纤维细胞的增殖,从而减少滤过道瘢痕组织的增生。ROCK 抑制剂具有抗炎、抗瘢痕等作用,可以特异性抑制酪氨酸蛋白激酶(tyrosine protein kinase,TPK),阻碍细胞膜受体与血小板源性生长因子结合,降低成纤维细胞增殖率[11]。RKI-1447 是一种高效的ROCK 抑制剂。孙琳[12]研究表明,RKI-1447 可有效抑制外源性TGF-β1 诱导的大鼠尿道成纤维细胞的增殖、表型转化、迁移和细胞外基质成分合成等细胞生物学变化。本研究与上述研究结果一致。
本研究结果表明,ROCK 抑制剂可抑制TGF-β1 mRNA、ROCK mRNA、IL-1β、IL-6、VEGF、α-SMA 的表达。TGF-β1 主要通过激活成纤维细胞内Smad 家族蛋白3(Smad3)启动胶原基因转录和表达,促进胶原形成,使成纤维细胞增加,进而使瘢痕形成[13]。欧阳云等[14]通过对兔进行研究显示,青光眼可降低TGF-β/Smad 细胞信号转导,抑制滤过道瘢痕形成。ROCK 是蛋白激酶的一种,接受RhoA 信号后,参与氨基酸磷酸化,从而使其表达升高,进而调节细胞运动。根据有关研究表明RhoA/ROCK 信号在青光眼瘢痕中表达升高,表示RhoA/ROCK 参与了瘢痕发生发展[15]。陈晓柳等[16]研究表明血栓通、丝裂霉素等可以通过抑制ROCK的表达进而抑制成纤维细胞的活性,从而阻碍瘢痕的形成。IL-1β 是由成纤维细胞分泌的细胞因子,增加炎症反应,使术后愈合时间延长及成纤维细胞增加。张康玉等[17]通过对大白兔建立青光眼术后瘢痕研究表明,可通过抑制IL-1β 进而抑制成纤维细胞的增殖,从而抑制瘢痕的产生。IL-6 是一种免疫调节因子,在多种纤维化疾病中可通过对靶细胞的调控进而抑制成纤维细胞的增殖,阻碍瘢痕的形成。蔡海丰等[18]研究显示,通过磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)激动剂降低TGF-1β及IL-6的表达,可抑制成纤维细胞增加,阻碍人皮肤异常瘢痕的形成。VEGF可促进血管内皮细胞的增殖,进而促进新生血管的生成;还可通过诱导炎症细胞的增殖进而促进成纤维细胞的增殖,在青光眼滤过手术修复过程中具有修复作用。卞新海[19]对兔建立耳瘢痕实验显示,点阵CO2激光联合积雪苷霜软膏通过抑制TGF-β1和VEGF的表达,可抑制瘢痕组织的增生。α-SMA是成纤维细胞的特异性标志物之一,可通过自身的高表达进而使成纤维细胞活化,使其合成胶原的能力提升,导致瘢痕形成[20]。黄学思等[21]运用丝裂霉素C以及青光安混悬液等药物治疗青光眼术后瘢痕实验研究表明,通过降低胶原纤维、α-SMA及纤维黏连蛋白的水平,可抑制青光眼术后瘢痕的形成。本研究结果与上述研究结果相似。
综上所述,ROCK 抑制剂可通过降低TGF-β1 mRNA、ROCK mRNA、IL-1β、IL-6、VEGF、α-SMA的表达进而抑制成纤维细胞的增殖,从而提高手术的成功率,阻碍青光眼术后瘢痕的形成。
