黄芪甲苷调控p62-Nrf2通路对抗小鼠淋巴细胞白血病耐药株的机制研究*
2021-12-31王晓玲杨小娟郑倩倩侯梦雪王旭汪涛
王晓玲,杨小娟,郑倩倩,侯梦雪,王旭,汪涛
(天津中医药大学中西医结合学院,天津 301617)
白血病是一类源于骨髓造血干/祖细胞异常克隆增殖性疾病,其发病率与病死率均居于恶性肿瘤前列[1]。化疗是临床首选方法,但常出现耐药,这已成为临床难以突破的瓶颈,且是白血病复发的主因,寻找具有减毒增效、逆转耐药作用的药物有重要意义。当临床使用顺铂(DDP)长期治疗时,肿瘤细胞会激活核因子红细胞样2相关因子2(Nrf2)通路,促进其下游抗氧化基因如醌氧化还原酶1、血红素氧化酶1(HO-1)及药物转运体蛋白的表达产生耐药。肿瘤细胞耐药过程十分复杂,常涉及多个通路,包括Nrf2 通路与自噬、核因子 κB(NF-κB)等,而多功能衔接蛋白p62可能是信号通路交互作用的枢纽[2]。
白血病致病因素较多,多因虚致病,因病致虚,邪盛正虚,虚实夹杂,邪毒入髓伤血。“扶正祛邪,固本培元”是抗肿瘤的基本治则。黄芪是抗肿瘤常用扶正配方药味之一,黄芪甲苷(AST Ⅳ)是其主要药效成分,具有抗肿瘤、抗炎、抗氧化、免疫调节等多种功效。AST Ⅳ是否可协同DDP联合抗肿瘤,发挥减毒增效、逆转耐药等作用,尚不明确。本实验旨在基于p62-Nrf2通路探讨AST Ⅳ对抗白血病细胞耐药的干预机制。
1 材料与方法
1.1 细胞及试剂 小鼠淋巴细胞白血病顺铂耐药细胞株(L1210/DDP)购自美轩生物技术有限公司;AST Ⅳ标准品购自甄准生物公司;DDP购自Sigma公司;胎牛血清、RPMI1640培养基购自Gbico公司;荧光探针 2’,7’-二氯二氢荧光素(DCFH-DA)、细胞计数试剂盒-8(CCK-8)购自碧云天生物技术有限公司;Nrf2通路抑制剂ML-385购自Med Chem Express公司;盐酸维拉帕米(VER)购自美仑生物技术有限公司;总RNA提取试剂盒、反转录试剂盒、荧光适时定量聚合酶链式反应(Real time PCR)试剂盒和引物购自宝生物工程有限公司;细胞周期及凋亡检测试剂盒购自三箭生物技术有限公司;蛋白定量试剂盒、蛋白裂解液购自索莱宝科技有限公司;p62、Nrf2、HO-1、B 淋巴细胞瘤-2基因(bcl-2)及半胱氨酸蛋白酶-3(Caspase-3)一抗购自CST公司、bcl-2相关蛋白X(bax)一抗购自Abcam公司。
1.2 细胞培养及分组 在37℃5%二氧化碳(CO2)条件下,L1210/DDP细胞用含10%胎牛血清的RPMI1640培养基培养 1~2 d,继而用含 4、6、8 μg/mL DDP的完全培养基先后培养细胞1~2 d,再脱药培养1~2 d,进行后续实验。
将细胞分成空白组(blank,L1210/DDP)、模型组(model,L1210/DDP+8 μg/mL DDP)、黄芪甲苷组(AST Ⅳ,model组+100 μg/mL AST Ⅳ)、盐酸维拉帕米(VER,model组+70 μg/mL VER)、Nrf2 通路抑制剂(ML385,model组+2 μmol/L ML385)组及抑制剂与黄芪甲苷组(ML385+AST Ⅳ,ML385组+100 μg/mL AST Ⅳ)6组。
1.3 CCK-8法检测细胞对DDP的敏感性 将L1210/DDP细胞以5×105个/mL种于96孔板,待生长至对数期,按blank、model、AST Ⅳ及VER实验组进行药物干预48 h,每孔加入10 μL CCK-8溶液,摇匀培养3 h后,酶标仪检测OD值,细胞增殖抑制率=(1-药物组OD值/对照组OD值)×100%。
1.4 流式细胞仪检测细胞的ROS水平 将L1210/DDP细胞以1×106个/mL种于6孔板,待生长至对数期,按blank、model、AST Ⅳ及VER实验组进行药物干预48 h,收集细胞后磷酸缓冲盐溶液(PBS)洗涤 2 次,1 000 r/min,离心 5 min,离心半径 10 cm,弃上清,用含 DCFH-DA 探针的培养基(1∶1 000)悬浮细胞,37℃孵育20 min,每隔3~5 min颠倒混匀一下,PBS洗涤3次后悬浮细胞,上机检测。
1.5 流式细胞仪检测细胞周期、凋亡率的变化 将L1210/DDP细胞以1×106个/mL种于6孔板,依实验6个分组培养48 h后,PBS洗涤2次,1 000 r/min,离心5min,离心半径10cm,弃上清液。取1×105个/mL细胞分别加入 500 μL Binding Buffer、5 μL 膜联蛋白 Annexin V-FITC、5 μL 碘化丙锭(PI)混匀,室温避光反应15 min后,上机检测凋亡率变化,并设空白对照与单染组。其余细胞逐滴加入70%预冷乙醇固定,4℃过夜保存,100 μL RNaseA溶液重悬细胞,37℃水浴30 min后加入400 μL PI混匀,4℃避光孵育30 min后上机检测细胞周期变化。
1.6 Real time PCR检测实验各组细胞p62-Nrf2通路节点基因的表达变化 从GenBank中查找到小鼠的 β-actin、p62、Nrf2、HO-1、bcl-2、bax 及 Caspase-3基因序列,用Primer5.0软件设计引物。依试剂盒操作说明提取实验6组细胞的总RNA,并将总RNA反转录为cDNA,以cDNA产物用作定量PCR扩增的模板,进行PCR扩增反应。数据采用2-ΔΔCT相对定量法分析。见表1。

表1 各检测基因的引物序列Tab.1 Primer sequences of each detected gene
1.7 蛋白免疫印迹(Western Blot)检测实验各组细胞p62-Nrf2通路节点基因的蛋白表达变化 收集实验6个组细胞后,用RIPA裂解液提取蛋白,BCA试剂盒检测细胞蛋白浓度。每组分别取20 μg蛋白,12%SDS-PAGE分离,湿转法将蛋白转移到PVDF膜上,用5%的脱脂奶粉室温封闭,4℃过夜,缓冲液洗去未结合一抗,加入二抗室温封闭2 h,滴加显色液,凝胶成像系统曝光显影,Image J软件对显影条带进行定量分析。
1.8 统计学方法 采用SPSS 24.0统计软件进行统计学处理,数据均以均数±标准差(±s)表示,计量资料多组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 耐药细胞L1210/DDP对DDP敏感性的变化 与model组相比,AST Ⅳ、VER组L1210/DDP细胞增殖抑制率明显上升,差异有统计学意义(P<0.05),而AST Ⅳ组与VER组细胞增殖抑制率比较无统计学意义。见表2。
表2 耐药细胞增殖抑制率及ROS的变化(±s)Tab.2 Changes of proliferation inhibition rate and ROS in drug-resistant cells(±s)

表2 耐药细胞增殖抑制率及ROS的变化(±s)Tab.2 Changes of proliferation inhibition rate and ROS in drug-resistant cells(±s)
注:与 blank 组相比,*P<0.05;与 model组相比,#P<0.05;与 AST Ⅳ组相比,△P<0.05。
组别 n A值 增殖抑制率(%) ROS(%)blank 组 6 1.302±0.046#△ 0 96.340±1.431 model组 6 1.187±0.060*△ 8.83 96.917±0.174 AST Ⅳ组 6 1.084±0.029*# 16.74 93.563±0.566 VER 组 6 1.076±0.031*# 17.36 95.513±0.110#
2.2 耐药细胞L1210/DDP ROS水平的变化 与model组相比,AST Ⅳ、VER组ROS水平呈下降趋势,以VER 组下降显著,差异有统计学意义(P<0.05)。见表2。
2.3 耐药细胞L1210/DDP细胞周期的变化 与model组相比,除blank组,实验各组G0/G1期细胞百分比呈减少趋势,AST Ⅳ、VER组S期细胞百分比呈增加趋势,出现S期阻滞,同时AST Ⅳ组G2/M期细胞百分比也呈增加趋势,表现为G2/M期阻滞;与AST Ⅳ组相比,实验各组G0/G1期细胞百分比有增加趋势,S期细胞百分比则均有减少趋势,但除VER组外,而G2/M期细胞百分比以ML385及AST Ⅳ+ML385 组明显减少,具有统计学差异(P<0.05)。见图1。
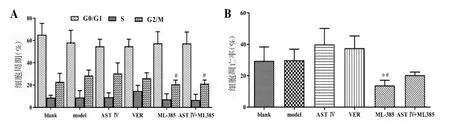
图1 流式细胞仪检测细胞周期及凋亡率的变化(±s)Fig.1 Changes of cell cycle and apoptosis rate were detected by flow cytometry(±s)
2.4 耐药细胞L1210/DDP凋亡率的变化 与model组相比,AST Ⅳ、VER组凋亡率呈升高趋势,ML385组细胞凋亡率明显减少,差异有统计学意义(P<0.05)。与AST Ⅳ组相比,ML385组凋亡率显著下降,差异有统计学意义(P<0.05),而 AST Ⅳ+ML385 组的细胞凋亡率较ML385组有所上升,见图1。
2.5 耐药细胞 L1210/DDP p62、Nrf2、HO-1、bcl-2、bax及Caspase-3等基因mRNA表达变化 与model组相比,实验各组细胞p62 mRNA相对表达量均有下调趋势,ML385 组作用效果显著(P<0.05);HO-1 mRNA 表达均显著减少(P<0.05);bcl-2/bax mRNA表达量除AST Ⅳ+ML385组外均显著下调(P<0.05);AST Ⅳ组、VER 组 Caspase-3 mRNA 表达均上调,AST Ⅳ组更明显(P<0.05),而 ML385 组、AST Ⅳ+ML385组的Caspase-3 mRNA表达有下调趋势。与AST Ⅳ组相比,AST Ⅳ+ML385组的HO-1 mRNA表达显著减少(P<0.05);ML385 组、AST Ⅳ+ML385 组的Caspase-3 mRNA表达显著下调,差异有统计学意义(P<0.05),见表3。
表3 p62-Nrf2通路各关键基因mRNA表达情况(±s)Tab.3 The mRNA expression of the key genes in p62-Nrf2 pathway(±s)
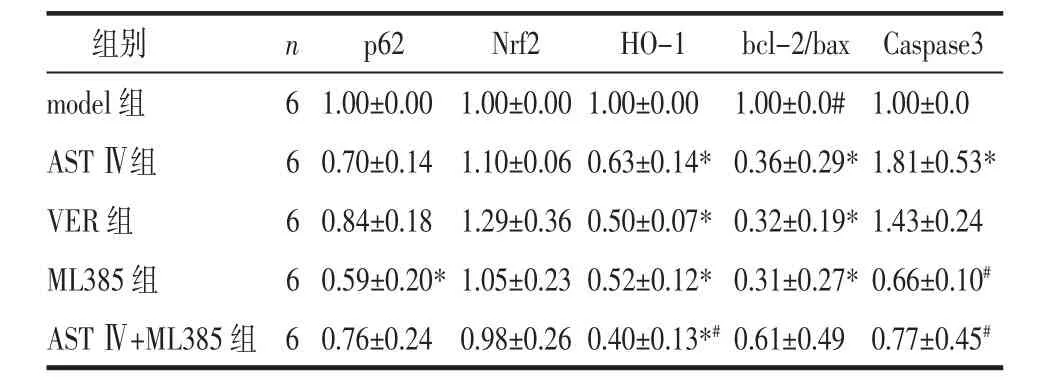
表3 p62-Nrf2通路各关键基因mRNA表达情况(±s)Tab.3 The mRNA expression of the key genes in p62-Nrf2 pathway(±s)
注:与 model组比较,*P<0.05;与 AST Ⅳ组比较,#P<0.05。
组别 n p62 Nrf2 HO-1 bcl-2/bax Caspase3 model组 6 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.0# 1.00±0.0 AST Ⅳ组 6 0.70±0.14 1.10±0.06 0.63±0.14*0.36±0.29*1.81±0.53*VER 组 6 0.84±0.18 1.29±0.36 0.50±0.07*0.32±0.19*1.43±0.24 ML385 组 6 0.59±0.20*1.05±0.23 0.52±0.12*0.31±0.27*0.66±0.10#AST Ⅳ+ML385 组 6 0.76±0.24 0.98±0.26 0.40±0.13*#0.61±0.49 0.77±0.45#
2.6 耐药细胞 L1210/DDP p62、Nrf2、HO-1、bcl-2、bax及Caspase-3等蛋白表达变化 与model组相比,其他各组p62蛋白表达量均有减少趋势;Nrf2蛋白表达量均有上调趋势,且VER、AST Ⅳ+ML385组显著上调,差异具有统计学意义(P<0.05);HO-1、bcl-2/bax蛋白的表达均呈下调趋势;除ML385组外,凋亡相关蛋白Caspase-3的表达均有上升趋势。与AST Ⅳ组相比,Nrf2蛋白表达量VER组、AST Ⅳ+ML385 组均明显上调,差异具有统计学意义(P<0.05),见图2。
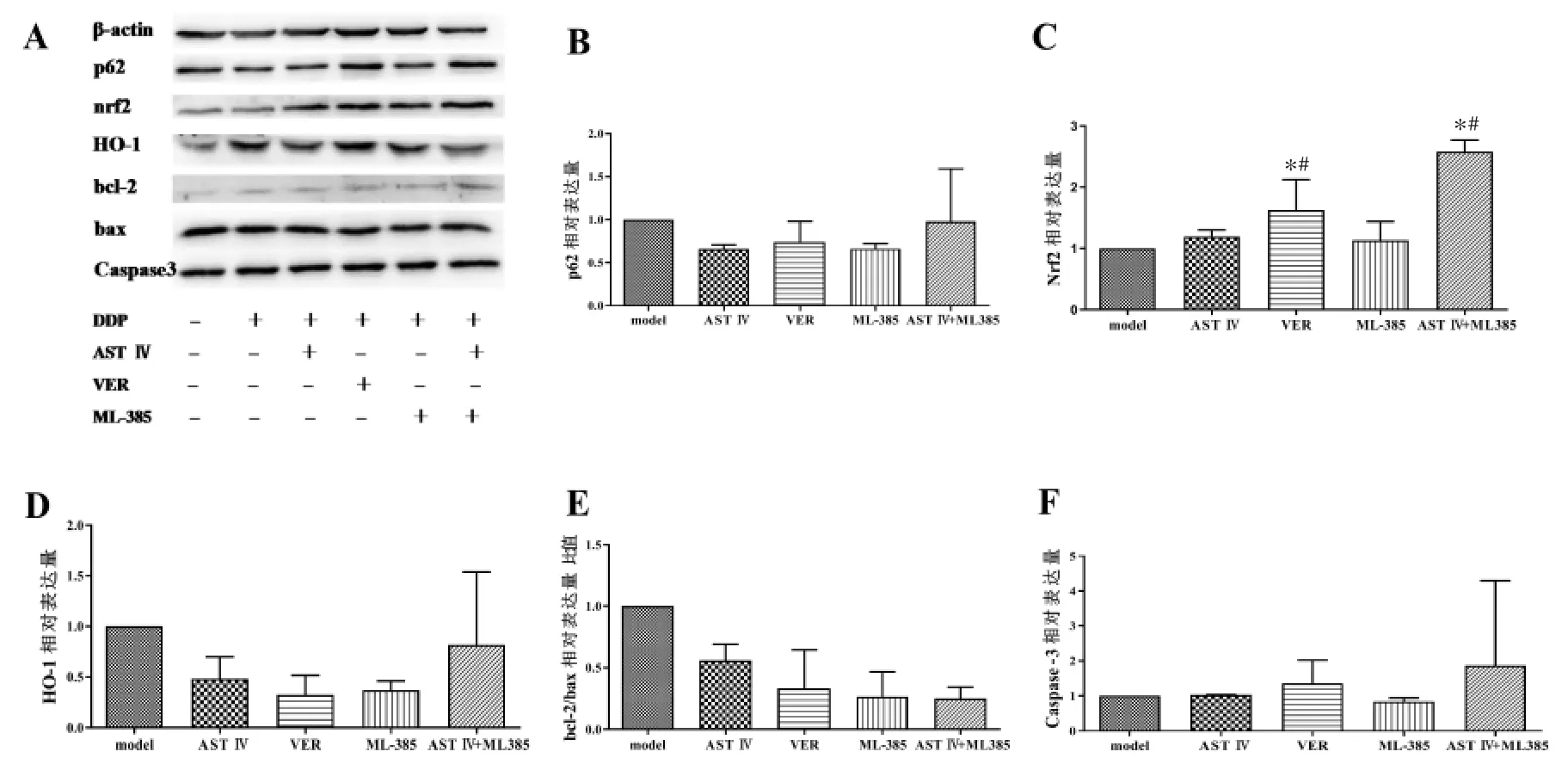
图2 p62-Nrf2通路各关键蛋白表达变化Fig.2 Changes of the key protein expression in p62-Nrf2 pathway
3 讨论
白血病属中医“血症”“虚劳”“癥瘕”等范畴。扶正祛邪是其基本治则,补气养血、益气养阴以扶正,清热解毒、活血祛瘀、化痰散结以祛邪。黄芪因具有补气升阳,益气固表等功效,常被医家用于治疗白血病气血两虚证,黄芪在体内外均有抗肿瘤作用,这与其主要药效成分AST Ⅳ密切相关,AST Ⅳ通过抑制肿瘤细胞侵袭迁移、增殖分化并诱导其凋亡,逆转耐药及增强机体免疫对抗肿瘤[3-4],并因肿瘤细胞种类不同效果存在差异性。本实验也验证了AST Ⅳ通过干扰细胞周期,造成S、G2/M期阻滞,抑制L1210/DDP细胞增殖,还通过上调Caspase-3基因表达及下调bcl-2/bax的表达比促进其凋亡,逆转了肿瘤细胞化疗耐药,疗效可与经典的多药耐药逆转剂盐酸维拉帕米(verapamil)相媲美。
DDP属金属铂类络合物,具有亲核亲电子特性,易与核酸碱基中的鸟嘌呤、腺嘌呤等的残基形成共价键,也可与细胞的多种结构如核糖体、剪接体、端粒酶中的RNA及蛋白质中蛋氨酸,组氨酸和半胱氨酸等亲核残基相互作用,常在线粒体、溶酶体、内质网、细胞核及胞浆中积累,诱发细胞应激反应[5]。DDP既能激活肿瘤细胞死亡通路,也可诱发癌细胞的适应性反应如自噬、未折叠蛋白质反应和其他利于生存的信号如NF-κB、Nrf2[2]。细胞的最终命运是信号网络串话的结果,而p62作为信号枢纽,通过调控转录因子NF-κB、Nrf2等关键分子的泛素化过程,连接自噬和凋亡信号,参与细胞生死之间的微妙平衡,此调控的分子基础与p62的多个功能结构域有关,如与非典型激酶结合并介导p62自异构化的PB1区、促进NF-κB通路激活的ZZ区、与肿瘤坏死因子受体相关因子6结合的TB区、与Keap1相互作用的KIR区、通过自噬或泛素-蛋白酶体系统募集泛素连接蛋白促其降解的UBA区及与LC3相互作用的LIR区。当DDP进入细胞与线粒体结合时,导致细胞色素C释放、钙依赖性线粒体肿胀和ROS产生,诱发氧化应激,降低细胞基因组的稳定性[6]。此时,肿瘤细胞内Nrf2与其锚定蛋白氧化应激感受器Keap1发生解聚,转位入核与抗氧化反应元件ARE结合,启动下游靶基因表达,如Ⅱ相解毒酶、抗氧化反应酶及ATP结合转运蛋白等,来抵抗化疗药物损伤,参与化疗耐药过程[2]。研究发现,p62可介导Keap1经自噬途径降解,通过非经典通路激活Nrf2,且p62表达也受Nrf2调控,并形成一个抗氧化反应的p62-Nrf2-p62正反馈循环[7]。
前期实验发现,与亲本株相比,耐药细胞株L1210/DDP存在Nrf2通路异常激活,而本实验发现与模型组相比,AST Ⅳ可协同DDP作用于耐药株,下调p62-Nrf2通路的关键基因p62的表达,使Keap1蛋白降解减少,在一定程度上抑制了Nrf2非经典通路激活,降低了肿瘤细胞HO-1的表达,减弱了细胞抗氧化应激反应的能力,对DDP的敏感性增强。另外有研究显示Keap1还可结合破坏NF-κB通路的正调节因子IKKB,抑制NF-κB的促瘤作用,且抗凋亡的bcl-2蛋白也为Keap1-泛素连接酶复合体的底物,Keap1可减少bcl-2-bax异二聚体形成,促进肿瘤细胞凋亡[6]。并且有研究报道,对SKOV3/DDP卵巢癌细胞进行p62 RNAi后,显著抑制p65核易位,下调NF-κB调控的促存活信号,进而逆转癌细胞的DDP耐药性[8],因NF-κB信号调控着至少400个参与增殖、凋亡和炎症相关的编码基因,包括凋亡相关bcl-2家族及Caspase家族的基因,这提示在逆转L1210/DDP化疗耐药过程中也可能存在着AST Ⅳ抑制NF-κB通路的靶向作用,但仍需进一步探讨。bcl-2蛋白通过抑制细胞色素C的释放,阻止胞质内细胞色素C对Caspase的激活来抑制细胞凋亡[9]。本实验显示,AST Ⅳ可通过降低bcl-2/bax蛋白表达比增加耐药癌细胞的凋亡率,与Nrf2通路抑制剂ML385联用效果更佳。这些研究结果或可辅证AST Ⅳ减毒增效的机制。ML385通过直接与Nrf2蛋白相互作用,阻止Nrf2-MAFG复合体与启动子ARE序列的结合、减少Nrf2转录活性,抑制其下游靶基因p62、HO-1的表达。但本实验中p62-Nrf2通路个别的节点、靶基因在基因转录、蛋白翻译水平的调控无统计学差异,如与AST Ⅳ组相比,AST Ⅳ+ML385组p62、HO-1蛋白表达呈上调趋势,这可能与实验样本量较少有关造成分析误差,或存在其他通路如NF-κB交互调控有关,尚待进一步研究。本研究说明就癌细胞耐药p62调控机制、AST Ⅳ的具体减毒增效的机制而言,还有许多研究的空白亟需深入探讨,相关的研究成果或可为对抗白血病化疗耐药的中药药物筛选及临床应用提供启示。