杜氏肌营养不良小鼠肌损伤对肝脏脂质代谢的影响及其作用机制
2021-12-31张紫玲徐登球俞沁玮江振洲
张紫玲,陆 茜,徐登球,俞沁玮*,江振洲,2,3**
(1中国药科大学新药筛选中心,南京210009;2中国药科大学天然药物活性组分与药效国家重点实验室,南京210009;3中国药科大学药物质量与安全预警教育部重点实验室,南京210009)
骨骼肌与肝脏之间存在着密切的器官应答关系。骨骼肌功能障碍会影响体内的脂质平衡,患有骨骼肌疾病(如杜氏肌营养不良症和肌肉减少症)的患者患上代谢相关性脂肪性肝病(metabolic associated fatty liver disease,MAFLD)的风险也会相应增加[1-2]。研究表明,肌少症是诱发MAFLD 的危险因素之一,其病理生理机制包括胰岛素抵抗、血脂异常和炎症增加[3],肌少症还可能是糖尿病易感性的早期预测指标[4]。同时,快速的骨骼肌萎缩预示肝硬化患者的生存率降低[5]。运动干预治疗MAFLD 的结果表明,通过有氧运动和耐力运动促进肌再生能降低肝脏脂肪含量[6],肝脏与脂肪组织、骨骼肌与微生物群之间的相互作用也可能是肌再生对MAFLD 的影响之一[7]。阐明骨骼肌与肝脏之间的关系,有利于从骨骼肌方向干预MAFLD的发病进程,或提示骨骼肌损伤患者关注肝脏病变,提早进行肝脏保护治疗。
杜氏肌营养不良症(Duchene muscular dystrophy,DMD),即假肥大型进行性肌营养不良症,是一种X 连锁隐性遗传的严重进行性肌肉萎缩性疾病,会导致运动困难,最终发展为需要辅助通气和过早死亡[8]。其发病原因是染色体上编码抗肌萎缩蛋白的部分基因重复、突变或缺失,造成抗肌萎缩蛋白在肌纤维上的缺失或功能异常[9]。临床数据表明,DMD 婴儿有肝功能生化异常的情况,在临床儿科上出现了原因不明无黄疸的天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)升高,甚至有曾被误诊为肝炎的案例[10],并且小儿DMD 患者血脂异常的发生率很高[11]。然而,DMD 对肝脏脂质代谢的影响及其作用机制尚未阐明。C57BL/10ScSn-Dmdmdx/Jnju(mdx)小鼠是用于研究DMD 疾病的模型动物,该动物编码抗肌萎缩蛋白的基因4号外显子出现无义突变,导致抗肌萎缩蛋白无法表达。本实验以mdx 小鼠为DMD 模型,探究其肝脏脂质代谢变化情况。
脂肪酸合成酶(fatty acid synthase,FASN)在动物肝脏脂质生成、沉积的过程中发挥了重要作用[12]。乙酰辅酶A 羧化酶(acetyl CoA carboxylase,ACC)是催化脂肪酸合成代谢第一步反应的限速酶[13-14],其中ACC1在肝脏、脂肪和泌乳乳腺中表达量较高[15]。FASN 能利用ACC1 生成的丙二酰辅酶A在胞质中合成脂肪酸。同时,除脂质合成的相关酶以外,肝脏脂质合成的过程还受多种饮食和激素因素的调节,这些因素控制着脂肪合成相关酶的表达。胆固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)是一类固定于内质网和核被膜上的膜连接蛋白,其中SREBP-1c 作为负责胰岛素增强脂质生成的胰岛素应答转录因子,在调控脂质合成中发挥着重要的作用[16]。然而,这些脂质合成酶是否在DMD 诱发肝脏脂质代谢异常的的过程中起到了关键的调控作用,还有待进一步探究。
本课题基于DMD患者临床上所出现的血脂异常现象,以及骨骼肌疾病和MAFLD 之间紧密的联系,探究DMD 对肝脏脂质代谢的影响及其作用机制。研究结果可为临床DMD患者检测肝脏脂质代谢情况提供理论依据,提示患者尽早进行肝脏保护治疗,也为治疗MALFD提供一个新的研究思路。
1 材 料
1.1 药品与试剂
Dystrophin 抗体(美国DSHB 公司);羊抗兔IgG(H+L)交叉吸附二级抗体(Alexa Fluor 488)、DAPI 染色液、羊抗兔IgG(H+L)二级抗体(HRP)(美国Thermo Fisher 公司);4% 多聚甲醛、抗荧光淬灭封片液、RIPA裂解液、BCA蛋白浓度检测试剂盒(中国碧云天生物技术研究所);总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、总胆汁酸(total bile acid,TBA)、游离脂肪酸(free fatty acid,FFA)、高密度脂蛋白(high-density lipoprotein,HDL)检测试剂盒(南京建成生物工程研究所);ALT、AST 检测试剂盒(中国东软威特曼生物科技有限公司);总RNA 提取试剂、逆转录试剂盒、AceQ qPCR SYBR Green Master Mix、高敏型ECL化学发光检测试剂盒(南京诺维赞生物科技有限公司);FASN 抗体(美国Proteintech 公司);SREBP-1c抗体、ACC 抗体(美国Affinity 公司);p-ACC 抗体(美国CST 公司);β-actin(武汉爱博泰克生物科技有限公司);油红O 粉末(上海阿拉丁试剂有限公司);苏木精-伊红染色液(珠海贝索生物技术有限公司);引物(上海英骏生物技术有限公司);其他试剂均为市售分析纯。
1.2 仪 器
激光共聚焦显微镜、BX53 显微镜(日本Olympus 公司);多功能酶标仪、高速低温离心机、Nanodrop 2000/2000C(美国Thermo 公司);AB StepOne-Plus Real-Time PCR Instrument(美国生命科技有限公司);电泳仪、转膜仪(美国Bio-Rad 公司);低温研磨仪(武汉赛维尔生物科技有限公司);冷冻切片机(德国Leica 公司);Tanon 4600 全自动化学发光图像分析系统(上海天能科技有限公司)。
1.3 动 物
雄性C57BL/10ScSn-Dmdmdx/JNju 鼠(以下简称mdx 小鼠)和雄性C57BL/6J 鼠(以下称为对照组)6周龄,SPF 级,购于南京大学-南京生物医药研究院,动物合格证号:SCXK(苏)2016-0003。动物饲养于中国药科大学动物实验中心屏障系统,正常饮食饮水,昼夜交替。动物实验符合动物伦理委员会标准。
2 方 法
2.1 动物分组与处理
对照组与mdx 小鼠各6 只,于7 周龄时处死,解剖取其肝脏组织和肌肉组织,取适宜大小进行冷冻包埋,另取一块放入4% 多聚甲醛中浸泡固定,送往江苏省中西医结合医院病理科制作石蜡包埋进行组织切片,剩余组织用锡纸包裹后置于液氮中,2 h后取出立即保存于-80 ℃冰箱。
2.2 肌肉组织免疫荧光染色
将冷冻包埋后的骨骼肌组织于冷冻切片机制片,切片厚度为8 μm,制备好的载玻片样品于室温干燥5 min 后,浸入预冷丙酮(4 ℃)中固定15 min,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3 次,晾干液体后于组织样本上覆盖含有5% 驴血清的封闭液室温封闭30 min。弃去液体,加上抗肌萎缩蛋白抗体,4 ℃避光孵育过夜。吸弃抗体,PBS 浸洗3 次,每次5 min,滴加荧光二抗,室温避光孵育1 h。吸弃二抗,PBS 浸洗3 次,滴加DAPI染色液,室温避光孵育10 min,吸弃DAPI 染色液,PBS 浸洗3 次,组织样本上滴加适量抗荧光淬灭封片液,盖片,在激光共聚焦显微镜下观察并拍照。
2.3 肝脏组织生化检测
称取肝组织20 mg,放入磁珠,加入生理盐水200 μL 匀浆,于高速低温离心机2500 r/min 离心10 min,按照试剂盒说明书上操作,于多功能酶标仪检测其吸收度,计算肝匀浆液中TC、TG 的含量。将上步匀浆液低温11200 r/min 离心10 min,取上清液用BCA 蛋白浓度检测试剂盒测定蛋白含量,用以计算TC、TG的终浓度。
2.4 组织形态学检查
2.4.1 油红染色(oil red O staining,OR O 染色)油红粉末溶于异丙醇中制备成0.5% 油红母液,母液与水以3∶2混合制备油红稀释液,滤纸过滤后进行染色。油红染完后使用苏木素染色液对细胞核进行染色。最后滴加甘油明胶封片液,盖上盖玻片,于BX53显微镜下观察并拍照。
2.4.2 苏木精-伊红染色(HE染色) 肝脏(肌肉)组织切片使用4% 多聚甲醛溶液固定1 min,而后干燥15 min,用HE 染色液对组织切片进行染色,随后用树脂封片,待树脂完全晾干后,于BX53 显微镜下观察并拍照。
2.5 血清生化检测
小鼠眼球取血收集血清,室温静置4 h 后以3000 r/min 转速离心15 min,吸取上清液,保存于4 ℃冰箱。按试剂盒操作步骤检测血清内TC、TG、TBA、FFA、HDL,以及ALT 和AST 的含量,于多功能酶标仪检测其吸收度,计算相应含量。
2.6 Real-Time PCR(RT-PCR)
采用总RNA 提取试剂提取肝脏RNA。采用Nanodrop 2000/2000C 分光光度法测定RNA 浓度。使用逆转录试剂将总RNA 逆转录为cDNA 后,使用SYBR Green 试剂在应用生物系统StepOnePlus™Real-Time PCR 上进行RT-PCR,检测脂质合成与代谢相关基因含量。引物序列如表1所示。
2.7 蛋白免疫印迹法
称取肝脏组织50 mg,使用RIPA 裂解液提取蛋白原液,于-80 ℃冰箱保存备用。通过BCA蛋白浓度检测试剂盒测定蛋白样品的浓度,再加入上样缓冲液将其配制成质量浓度为5 μg/μL 的蛋白样品,95 ℃金属浴煮10 min,制备上样样品。样品通过蛋白免疫印迹法(Western blot)检测脂质合成和代谢相关酶的蛋白含量。一抗为FASN 抗体、SREBP-1c 抗体、ACC 抗体、p-ACC 抗体、β-Actin,二抗为羊抗兔IgG 抗体。完成一抗与二抗的特异性结合后,使用ECL 化学发光试剂盒在发光成像系统上检测蛋白表达的信号强度。

Table 1 Sequences of real time PCR primers
2.8 统计学处理
使用GraphPad Prism 8.0 软件进行数据处理及分析。所有数据采用±s表示,组间分析全部使用t检验,当P<0.05为差异有统计学意义。
3 结 果
3.1 mdx小鼠肌肉损伤
对mdx 小鼠的胫骨前肌(tibialis anterior,TA)进行抗肌萎缩蛋白的免疫荧光染色(图1-A)和HE染色(图1-B),结果显示mdx 小鼠TA 肌细胞内抗肌萎缩蛋白缺失,肌细胞皱缩,有较多中性粒细胞浸润。
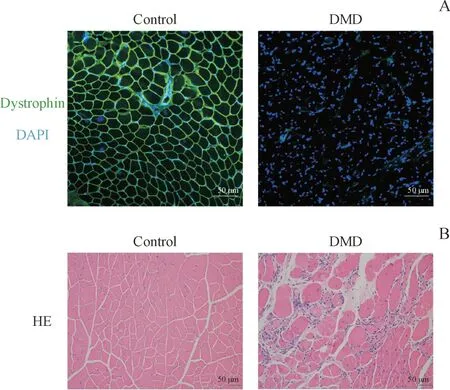
Figure 1 Loss of dystrophin in tibialis anterior (TA)and muscle damage in mdx miceA: TA muscle was stained with dystrophin (green) and DAPI was used to stain the nuclei (blue) (Scale bar = 50 μm); B: HE staining of TA(Scale bar = 50 μm)DMD: Duchene muscular dystrophy
3.2 mdx小鼠肝脏脂质含量增加
与对照组相比,mdx 小鼠的肝重系数上升(图2-A),肝脏内TC与TG含量均升高,其中TG大幅升高,是正常组含量的3 倍(图2-B)。肝脏病理组织学染色检查结果表明,mdx小鼠肝细胞胞浆中出现许多大小不一的空泡,边界清晰,将细胞核挤向一侧。肝细胞呈现肿胀的形态,无炎症现象(图2-C)。同时,mdx小鼠的肝脏油红染色结果显示其肝脏内脂滴显著增多(图2-C)。
3.3 血清生化检测
与对照组相比,7 周龄的mdx 小鼠血清中ALT、AST 大幅度升高,有显著性统计学差异(P<0.001)(图3-E,3-F),而FFA、HDL、TBA、TC、TG 与对照组相比无明显变化,其中TBA略微上升,TC稍有下降,但均无统计学差异(图3)。血生化检测结果显示mdx 小鼠可能存在肝脏炎症,血清中脂质含量没有明显变化。
3.4 mdx小鼠肝脏内脂质合成相关因子含量上调
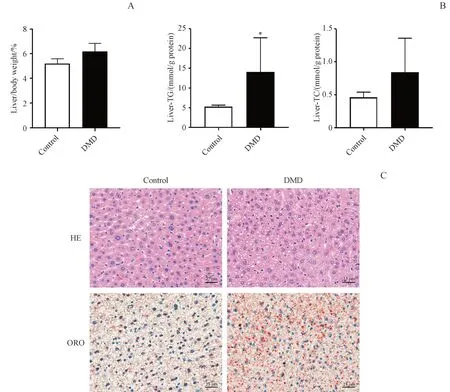
Figure 2 Increased lipid content in liver of mdx miceA: Liver index (±s, n = 6); B: Concentrations of TC and TG in liver (xˉ± s, n=6); C: HE staining and oil red O (ORO) staining of liver (20 × )*P <0.05 vs control group
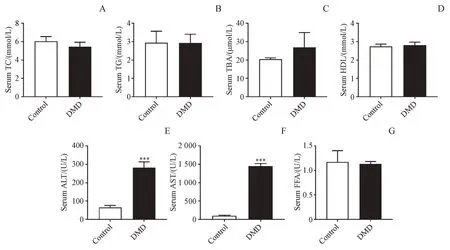
Figure 3 Concentrations of TC (A), TG (B), TBA (C), HDL (D), ALT (E), AST (F) and FFA (G) in serum in control and mdx mice (±s, n = 6)***P <0.001 vs control group
与对照组相比,mdx小鼠肝脏脂质合成相关基因表达量均升高,其中Fasn,Srebp1-c表达量显著提高,Scd1基因表达显著升高,Acc基因表达上调,以上4 个基因的表达对照组和模型组之间均有显著性差异(P<0.05)(图4-A)。Western blot 结果显示,与对照组相比,mdx 小鼠肝脏内FASN、SREBP-1c、ACC 和p-ACC 的蛋白表达量均显著上调,而ACC 的磷酸化水平没有明显变化(图4-B)。结果提示mdx 小鼠肝脏脂质含量增多是由于肝脏中脂质合成的增加。

Figure 4 Increased expression of lipid synthesis related factors of liver in mdx mice (±s, n = 6)A: Gene expression of lipid synthesis related factors detected by qPCR; B: Protein expression of FASN, SREBP1-c, ACC and p-ACC/ACC in liver*P <0.05 ,**P <0.01, ***P <0.001 vs control group
4 讨论
小鼠肝脏组织形态学结果显示,mdx小鼠肝脏内出现大量脂滴,肝脏中TC 和TG 的含量均上升,提示肝脏中胆固醇运输出现问题以及TG 发生累积。mdx 小鼠肝脏组织中脂质合成以及氧化代谢相关酶中FASN,SREBP1-c 与ACC 的基因和蛋白表达量均显著上调,提示肝脏组织内脂质沉积可能是由于脂质合成的增加,SREBP1-c 表达量上调也提示存在胰岛素上调而增加脂肪的可能。
DMD 患者临床数据表明,婴儿期的DMD 患者肌酸激酶(creatine kinase,CK)活性明显升高,并有研究表明血清CK 与ALT、AST水平有显著相关性。虽然mdx 小鼠血清中ALT、AST 含量显著升高,但ALT和AST缺乏肝脏特异性,因此对具有潜在肌肉功能障碍的患者肝细胞损伤的诊断受到严格限制。最新研究发现,谷氨酸脱氢酶可作为肝损伤的肝脏特异性生物标志物,具有改善潜在基础性肌肉损伤患者肝细胞损伤诊断的潜力[17]。
肌肉生长抑制素是转化生长因子-β 超家族中高度保守的成员,是骨骼肌质量的有效负调节因子。在成人组织中,肌肉生长抑制素主要在骨骼肌中表达,在脂肪组织和心脏中也有少量表达。研究发现,在mdx 小鼠中阻断肌肉生长抑制素蛋白的表达能够缓解mdx 小鼠肌肉萎缩的症状[18]。有临床报道发现,在肝移植及肝纤维化患者中,血浆肌肉生长抑制素含量有明显上调,这一发现提示肌肉生长抑制素是晚期肝病患者肌肉萎缩的关键因素。同时,血清中肌肉生长抑制素水平升高与肝硬化患者的生存率降低有关,提示肌肉生长抑制素在肝硬化发展进程中可能起到了重要的调节作用[19-21]。课题组的前期研究发现,DMD 患者与mdx 鼠肌肉中的肌肉生长抑制素的蛋白表达增加,非诺贝特能抑制腓肠肌与膈肌中肌肉生长抑制素的蛋白表达。因此可考察肌肉生长抑制素是否与脂质合成相关酶有关联,初步探究骨骼肌和肝病之间相互影响的机制。
以上结果均提示了7 周龄的mdx 小鼠肝脏组织内存在脂质蓄积。mdx 小鼠展示了当抗肌萎缩蛋白的基因被完全敲除后其肝脏的变化,抗肌萎缩蛋白的基因缺失导致了体内骨骼肌减少。同时,缺少运动或不健康饮食也会导致骨骼肌量的减少,骨骼肌量与肝脏脂肪面积呈负相关。脂肪合成相关酶FASN、SREBP1-c、ACC 和肌肉生长抑制素是两者相关机制的可能靶点。
综上所述,mdx 小鼠肝脏脂质含量显著增加,其发生机制与脂质合成相关酶FASN、SREBP1-c、ACC的上调有关。
