萝卜硫素对高糖诱导人肾小管上皮细胞增殖和凋亡的影响及机制
2021-12-30周磊艾望陈小娟闻春月
周磊 艾望 陈小娟 闻春月










中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2021)24-3000-08
DOI 10.6039/j.issn.1001-0408.2021.24.10
摘 要 目的:研究萝卜硫素对高糖诱导人肾小管上皮细胞HK-2增殖和凋亡的影响,并初步探讨其作用机制。方法:将HK-2细胞分为正常组、高糖组、厄贝沙坦组(阳性对照,1 μmol/L)和萝卜硫素低、中、高浓度组(10、20、40 μmol/L),正常组细胞用DMEM完全培养基培养96 h,其余各组细胞均用高糖DMEM完全培养基(含40 mmol/L葡萄糖)培养48 h诱导细胞损伤后,再加入相应药物继续培养48 h。检测各组细胞的存活率、凋亡率以及细胞中细胞周期蛋白D1(cyclin D1)、胱天蛋白酶3(caspase-3)、B细胞淋巴瘤2(Bcl-2)、B细胞淋巴瘤2相关X蛋白(Bax)mRNA和磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、磷酸化腺苷一磷酸活化蛋白激酶(p-AMPK)、磷酸化蛋白激酶B(p-Akt)、磷酸化磷脂酰肌醇3激酶(p-PI3K)蛋白的表达量。另将HK-2细胞分为正常组、高糖组、萝卜硫素高浓度组(40 μmol/L)、阿卡地新组(AMPK激动剂,1 mmol/L)、萝卜硫素高浓度+compound C组(萝卜硫素40 μmol/L+AMPK抑制剂compound C 40 μmol/L)、哌立福辛组(Akt抑制剂,19.95 μmol/L)、萝卜硫素高浓度+SC79组(萝卜硫素40 μmol/L+Akt激动剂SC79 4 μmol/L),同法培养后,检测细胞中p-mTOR、p-AMPK、p-Akt、p-PI3K蛋白的表达量。结果:与正常组比较,高糖组细胞的存活率以及细胞中cyclin D1、Bcl-2 mRNA和p-AMPK蛋白的表达量均显著降低(P<0.05),凋亡率以及细胞中caspase-3、Bax mRNA和p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著升高(P<0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞上述指标均显著改善(P<0.05),其中萝卜硫素中、高浓度组细胞上述指标的改善效果均显著优于萝卜硫素低浓度组(P<0.05)。与厄贝沙坦组比较,萝卜硫素高浓度组细胞上述指标差异均无统计学意义(P>0.05)。与萝卜硫素高浓度组比较,阿卡地新组细胞中p-AMPK、p-mTOR蛋白和哌立福辛组细胞中p-mTOR、p-Akt、p-PI3K蛋白的表达量差异均无统计学意义(P>0.05);萝卜硫素高浓度+compound C组细胞中p-AMPK蛋白的表达量显著降低(P<0.05),p-mTOR蛋白的表达量显著升高(P<0.05);萝卜硫素高浓度+SC79组细胞中p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著升高(P<0.05)。结论:萝卜硫素可促进高糖诱导肾小管上皮细胞增殖,抑制其凋亡,其机制可能与上调p-AMPK表达,下调p-mTOR、p-Akt、p-PI3K表达有关。
关键词 萝卜硫素;高糖;人肾小管上皮细胞;磷脂酰肌醇3激酶/蛋白激酶B信号通路;腺苷一磷酸活化蛋白激酶/哺乳动物雷帕霉素靶蛋白信号通路;增殖;凋亡
Effects of Sulforaphane on the Proliferation and Apoptosis of Human Renal Tubular Epithelial Cells Induced by High Glucose and Its Mechanism
ZHOU Lei,AI Wang,CHEN Xiaojuan,WEN Chunyue(Dept. of Nephrology, Wuhan Hospital of Traditional Chinese Medicine, Wuhan 430010, China)
ABSTRACT OBJECTIVE: To study the effects of sulforaphane on the proliferation and apoptosis of human renal tubular epithelial cells HK-2 induced by high glucose, and to investigate its mechanism primarily. METHODS: HK-2 cells were divided into normal group, high glucose group, irbesartan group (positive control, 1 μmol/L), sulforaphane low, medium and high concentration groups (10, 20, 40 μmol/L). The cells in normal group were cultured in DMEM medium for 96 hours. The cells in other groups were cultured in high glucose DMEM medium (containing 40 mmol/L glucose) for 48 hours. After inducing cell injury, the cells were added with corresponding drugs for 48 hours. Survival rate and apoptotic rate of cells were detected. mRNA expression of cyclin D1, caspase-3, Bcl-2 and Bax as well as protein expression of p-mTOR, p-AMPK, p-Akt and p-PI3K were also determined. In addition, HK-2 cells were divided into normal group, high glucose group, sulforaphane high concentration group (40 μmol/L), acardicin group (AMPK agonist, 1 mmol/L), sulforaphane high concentration+compound C group (sulforaphane 40 μmol/L+AMPK inhibitor compound C 40 μmol/L), perifoxine group(Akt inhibitor, 19.95 μmol/L)、sulforaphane high concentration+SC79 group(sulforaphane 40 μmol/L+Akt agonist SC79 4 μmol/L). After cultured with the same method, protein expression of p-mTOR, p-AMPK, p-Akt and p-PI3K were detected in HK-2 cells. RESULTS: Compared with normal group, survival rate of HK-2 cells, mRNA expression of cyclin D1 and Bcl-2 as well as protein expression of p-AMPK were decreased significantly in high glucose group (P<0.05); apoptotic rate, mRNA expression of caspase-3 and Bax, protein expression of p-mTOR, p-Akt and p-PI3K in HK-2 cells were increased significantly (P<0.05). Compared with high glucose group, above indexes of sulforaphane low, medium and high concentration groups, irbesartan group were all improved significantly (P<0.05); the improvement of above indexes in sulforaphane medium and high concentration groups were significantly better those of sulforaphane low concentration group (P<0.05). There was no significant difference in above indexes between sulforaphane high concentration group and irbesartan group (P>0.05). Compared with sulforaphane high concentration group, there were no significant difference in the protein expression of p-AMPK, p-mTOR in acardicin group and p-mTOR, p-Akt and p-PI3K in perifoxine group (P>0.05); the protein expression of p-AMPK in sulforaphane high concentration+compound C group was decreased significantly (P<0.05), while the protein expression of p-mTOR was increased significantly (P<0.05); the protein expression of p-mTOR、p-Akt、p-PI3K in sulforaphane high concentration+SC79 group were increased significantly (P<0.05). CONCLUSIONS: Sulforaphane can promote the proliferation of renal tubular epithelial cells and inhibit its apoptosis; its mechanism may be associated with up-regulating the expression of p-AMPK and down-regulating the expression of p-mTOR, p-Akt and p-PI3K.
KEYWORDS Sulforaphane; High glucose; Human renal tubular epithelial cells; PI3K/Akt signaling pathway; AMPK/mTOR signaling pathway; Proliferation; Apoptosis
糖尿病腎病是糖尿病的常见并发症,是严重危害人类身体健康的重大疾病之一。有研究表明,持续的高糖环境可导致细胞凋亡,是肾小管上皮细胞损伤的重要原因之一[1]。而肾小管上皮细胞损伤是糖尿病肾病的关键诱发因素,亦是导致糖尿病肾病转向终末期的重要原因[2-3]。萝卜硫素是一种天然的单体物质,广泛分布于十字花科植物中。有研究指出,萝卜硫素在缓解2型糖尿病患者胰岛素抵抗方面的效果较好,但其机制尚不明确[4]。有研究报道,萝卜硫素可通过抑制核因子E2相关因子2(Nrf2)/血红素加氧酶1信号通路来缓解过氧化氢(H2O2)诱导的肾小管上皮细胞氧化应激损伤,而氧化应激损伤是促进肾脏组织细胞凋亡和坏死的因素之一[5-6]。
已有研究表明,磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路是萝卜硫素及其衍生物促进肿瘤细胞凋亡的途径之一[7]。此外,萝卜硫素还可通过激活Akt来增强Nrf2介导的外源抗氧化防御,且Akt和腺苷一磷酸活化蛋白激酶(AMPK)的磷酸化可以下调哺乳动物雷帕霉素靶蛋白(mTOR)表达,进而诱导细胞自噬[8]。基于此,本研究拟通过建立高糖诱导的肾小管上皮细胞损伤模型,考察萝卜硫素对其增殖、凋亡的影响,并基于PI3K/Akt、AMPK/mTOR双信号通路初步探讨其可能的作用机制,旨在为阐明萝卜硫素治疗糖尿病肾病的机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括:Multiskan SkyHigh型全波长酶标仪、VeritiPro 96-Well型聚合酶链反应(PCR)仪、Form Steri-Cycle型CO2培养箱(美国Thermo Fisher Scientific公司),Mini-Protean型小垂直板电泳槽、ChemiDoc MP全能型凝胶成像系统(美国Bio-Rad公司),FACS Calibur型流式细胞仪(美国BD公司)等。
1.2 主要药品与试剂
DL-萝卜硫素对照品(批号C4441,纯度≥90%)、AMPK激动剂阿卡地新对照品(批号A9978,纯度98%)、AMPK抑制剂6-{4-[2-(1-哌啶基)乙氧基]苯基}-3-(4-吡啶基)吡唑并[1,5-A]嘧啶对照品(compound C,批号1133922,纯度98%)均购自美国Sigma公司;厄贝沙坦原料药(阳性对照,批号20190602,纯度96%)购自浙江华海药业股份有限公司;DMEM培养基(批号A4192101)、胎牛血清(批号30044333)均购自美国Gibco公司;0.25%胰蛋白酶(批号J6524)购自以色列BI公司;青霉素-链霉素混合溶液(批号C0222)、5×loading buffer(批号P0015L)、脱脂奶粉(批号P0216)、Akt激动剂2-氨基-6-氯-α-氰基-3-(乙氧羰基)-4H-1-苯并吡喃-4-乙酸乙酯对照品(SC79,批号SF2730,纯度98%)均购自上海碧云天生物科技有限公司;MTT(批号G4000)购自美国Promega公司;二甲基亚砜(DMSO,批号2206-27-1)购自上海阿拉丁生化科技股份有限公司;D-Hanks液(pH 7.2,批号20150504)、膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒(含binding buffer,批号20160601)、蛋白提取试剂盒(批号20170901)均购自北京索莱宝科技有限公司;Trizol试剂(批号1401902)购自美国Invitrogen公司;PrimeScriptTM RT Master Mix反转录试剂盒(批号AK3101)、TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)实时荧光定量聚合酶链反应(qRT-PCR)试剂盒(批号AI21785A)均购自日本TaKaRa公司;细胞周期蛋白D1(cyclin D1)、胱天蛋白酶3(caspase-3)、B细胞淋巴瘤2(Bcl-2)、B细胞淋巴瘤2相关X蛋白(Bax)PCR引物均委托生工生物工程(上海)股份有限公司设计、合成,引物序列与产物长度见表1;Akt抑制剂哌立福辛对照品(批号M1823,纯度98%)购自美国AbMole公司;BCA蛋白定量试剂盒(批号23225)、ECL发光液(批号32209)均购自美国Thermo Fisher Scientific公司;兔源磷酸化磷脂酰肌醇3激酶(p-PI3K)单克隆抗体(批号ab32089)、兔源磷酸化蛋白激酶B(p-Akt)单克隆抗体(批号ab38449)、兔源磷酸化腺苷一磷酸活化蛋白激酶(p-AMPK)单克隆抗体(批号ab133448)、兔源磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)单克隆抗体(批号ab109268)、兔源甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(批号ab181602)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号ab205718)均购自英国Abcam公司;其余试剂均为分析纯,水为超纯水。
1.3 细胞
本研究所用人肾小管上皮细胞HK-2购自武汉普诺赛生命科技有限公司,于-80 ℃冻存,备用。
2 方法
2.1 细胞培养
将HK-2细胞接种于含10%胎牛血清、100 u/mL青霉素、100 u/mL链霉素的DMEM培养基(以下简称“DMEM完全培养基”)中,置于37 ℃、5%CO2恒温培养箱中培养(培养条件下同),待细胞生长至90%左右时,用磷酸盐缓冲液(PBS,pH 7.2)洗涤2次,用0.25%胰蛋白酶消化,再用DMEM完全培养基终止后,收集细胞并传代培养,用于后续实验。
2.2 分组、造模与给药
将对数生长期的HK-2细胞分为正常组、高糖组、厄贝沙坦组(1 μmol/L[9])和萝卜硫素低、中、高浓度组(10、20、40 μmol/L,浓度根据前期实验结果设置),用于考察细胞存活率、凋亡率及相关因子mRNA和蛋白表达。另将对数生长期的HK-2细胞分为正常组、高糖组、萝卜硫素高浓度组(40 μmol/L,浓度参考本研究存活率检测结果设置)、阿卡地新组(1 mmol/L[10])、萝卜硫素高浓度+compound C组(萝卜硫素40 μmol/L+compound C 40 μmol/L[11])、哌立福辛组(19.95 μmol/L[12])、萝卜硫素高浓度+SC79组(萝卜硫素40 μmol/L+SC79 4 μmol/L[13]),用于验证信号通路的作用。正常组细胞用DMEM完全培养基培养96 h,其余各组细胞均用高糖DMEM完全培养基(含40 mmol/L葡萄糖,下同)培养48 h诱导细胞损伤后,再加入相应浓度的药物继续培养48 h。
2.3 细胞存活率的检测
采用MTT法进行检测。取对数生长期的HK-2细胞,用0.25%的胰蛋白酶消化后,收集细胞,用DMEM完全培养基重悬制成单细胞悬液,以1×105个/孔接种于96孔板中,按“2.2”项下方法分组、造模、给药、培养,另设不含药物和细胞的空白对照组,每组设6个复孔。培养结束后,每孔加入5 mg/mL的MTT溶液20 μL,室温孵育4 h;弃去培养基,加入DMSO 150 μL,避光振荡10 min,使用全波长酶标仪于570 nm波长处检测各孔的吸光度(A)值,计算细胞存活率:细胞存活率(%)=[(实验组A值-空白对照组A值)/(正常组A值-空白对照组A值)]×100%。实验重复3次。
2.4 细胞凋亡率的检测
采用流式细胞术进行检测。取对数生长期的HK-2细胞,用0.25%胰蛋白酶消化后,收集细胞,用DMEM完全培养基重悬制成单细胞悬液,以5×105个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药、培养,每组设3个复孔。培养结束后,收集各组细胞分别置于15 mL离心管(细胞密度≥1×106个/管)中,以1 500 r/min离心5 min,收集细胞沉淀;用1×D-Hanks液重悬和洗涤细胞2次,再用binding buffer重悬,使细胞密度达到1×106个/mL,每管加入Annexin Ⅴ-FITC试剂5 µL,室温避光孵育10 min;加入PI试剂5 µL,室温避光孵育5 min;再加入PBS至500 µL,轻轻混匀,使用流式细胞仪检测细胞凋亡情况,计算细胞凋亡率:细胞凋亡率(%)=细胞早期凋亡率+细胞晚期凋亡率+坏死细胞率。实验重复3次。
2.5 细胞中cyclin D1、caspase-3、Bcl-2、Bax mRNA表达的检测
采用qRT-PCR法进行检测。取对数生长期的HK-2细胞,以1×106个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药、培养,每组设3个复孔。培养结束后,收集各组细胞,采用Trizol法提取细胞总RNA,根据试剂盒说明书方法将总RNA反转录合成cDNA。以上述cDNA为模板,按qRT-PCR试剂盒说明书方法进行扩增。反应体系(20 µL)如下:2×TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)10 µL,10 µmol/L上、下游引物各0.8 µL,ROX Reference Dye(50×)0.4 µL,cDNA模板2 µL,加焦碳酸二乙酯(DEPC)水至20 µL。反应条件如下:95 ℃预变性1 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。以GAPDH为内参,采用2-ΔCt 法计算各组细胞中cyclin D1、caspase-3、Bcl-2、Bax mRNA的表达量。实验重复3次。
2.6 细胞中p-mTOR、p-AMPK、p-Akt、p-PI3K蛋白表达的检测
采用Western blot法进行检测。取对数生长期的HK-2细胞,以1×106个/孔接种于6孔板中,按“2.2”项下方法分组、造模、给药、培养,每组设3个复孔。培养结束后,收集各组细胞,根据试剂盒说明书方法提取总蛋白,测定蛋白浓度,用5×loading buffer稀释后,置于沸水中加热5 min使蛋白变性。取变性后的蛋白样品40 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,随后采用湿转法将其转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭1.5 h,加入p-mTOR、p-AMPK、p-Akt、p-PI3K、GAPDH一抗(稀释比例均为1 ∶ 1 000),4 ℃孵育过夜;用TBST缓冲液洗涤3次,加入HRP标记的IgG二抗(稀释比例为1 ∶ 5 000),室温孵育1.5 h;用TBST缓冲液洗涤3次,用ECL发光液显影,并置于凝胶成像系统下成像。使用Image J v1.8.0软件分析各条带的灰度值,以目标蛋白与内参蛋白(GAPDH)的灰度值比值作为目标蛋白的表达量。实验重复3次。
2.7 統计学方法
采用SPSS 21.0软件对数据进行统计分析。数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 萝卜硫素对高糖诱导HK-2细胞存活率的影响
与正常组比较,高糖组细胞的存活率显著降低(P<0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞的存活率均显著升高(P<0.05)。与萝卜硫素低浓度组比较,萝卜硫素中、高浓度组细胞的存活率均显著升高(P<0.05)。与厄贝沙坦组比较,萝卜硫素高浓度组细胞的存活率差异无统计学意义(P>0.05)。结果见图1。
3.2 萝卜硫素对高糖诱导HK-2细胞凋亡率的影响
与正常组比较,高糖组细胞的凋亡率显著升高(P<0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞的凋亡率均显著降低(P<0.05)。与萝卜硫素低浓度组比较,萝卜硫素中、高浓度组细胞的凋亡率均显著降低(P<0.05)。与厄贝沙坦组比较,萝卜硫素高浓度组细胞的凋亡率差异无统计学意义(P>0.05)。结果见图2、图3。
3.3 萝卜硫素对高糖诱导HK-2细胞中cyclin D1、caspase-3、Bcl-2、Bax mRNA表达的影响
与正常组比较,高糖组细胞中cyclin D1、Bcl-2 mRNA的表达量均显著降低(P<0.05),caspase-3、Bax mRNA的表达量均显著升高(P<0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞中cyclin D1、Bcl-2 mRNA的表达量均显著升高(P<0.05),caspase-3、Bax mRNA的表达量均显著降低(P<0.05)。与萝卜硫素低浓度组比较,萝卜硫素中、高浓度组细胞中cyclin D1、Bcl-2 mRNA的表达量均显著升高(P<0.05),caspase-3、Bax mRNA的表达量均显著降低(P<0.05)。與厄贝沙坦组比较,萝卜硫素高浓度组细胞中cyclin D1、Bcl-2、caspase-3、Bax mRNA的表达量差异均无统计学意义(P>0.05)。结果见表2。
3.4 萝卜硫素对高糖诱导HK-2细胞中p-mTOR、p-AMPK、p-Akt、p-PI3K蛋白表达的影响
与正常组比较,高糖组细胞中p-AMPK蛋白的表达量显著降低(P<0.05),p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著升高(P<0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞中p-AMPK蛋白的表达量均显著升高(P<0.05),p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著降低(P<0.05)。与萝卜硫素低浓度组比较,萝卜硫素中、高浓度组细胞中p-AMPK蛋白的表达量均显著升高(P<0.05),p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著降低(P<0.05)。与厄贝沙坦组比较,萝卜硫素高浓度组细胞中p-mTOR、p-AMPK、p-Akt、p-PI3K蛋白的表达量差异均无统计学意义(P>0.05)。结果见图4、表3。
3.5 AMPK/mTOR、PI3K/Akt双信号通路作用的验证
与正常组比较,高糖组细胞中p-AMPK蛋白的表达量显著降低(P<0.05),p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著升高(P<0.05)。与高糖组比较,萝卜硫素高浓度组细胞中p-AMPK蛋白的表达量显著升高(P<0.05),p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著降低(P<0.05)。
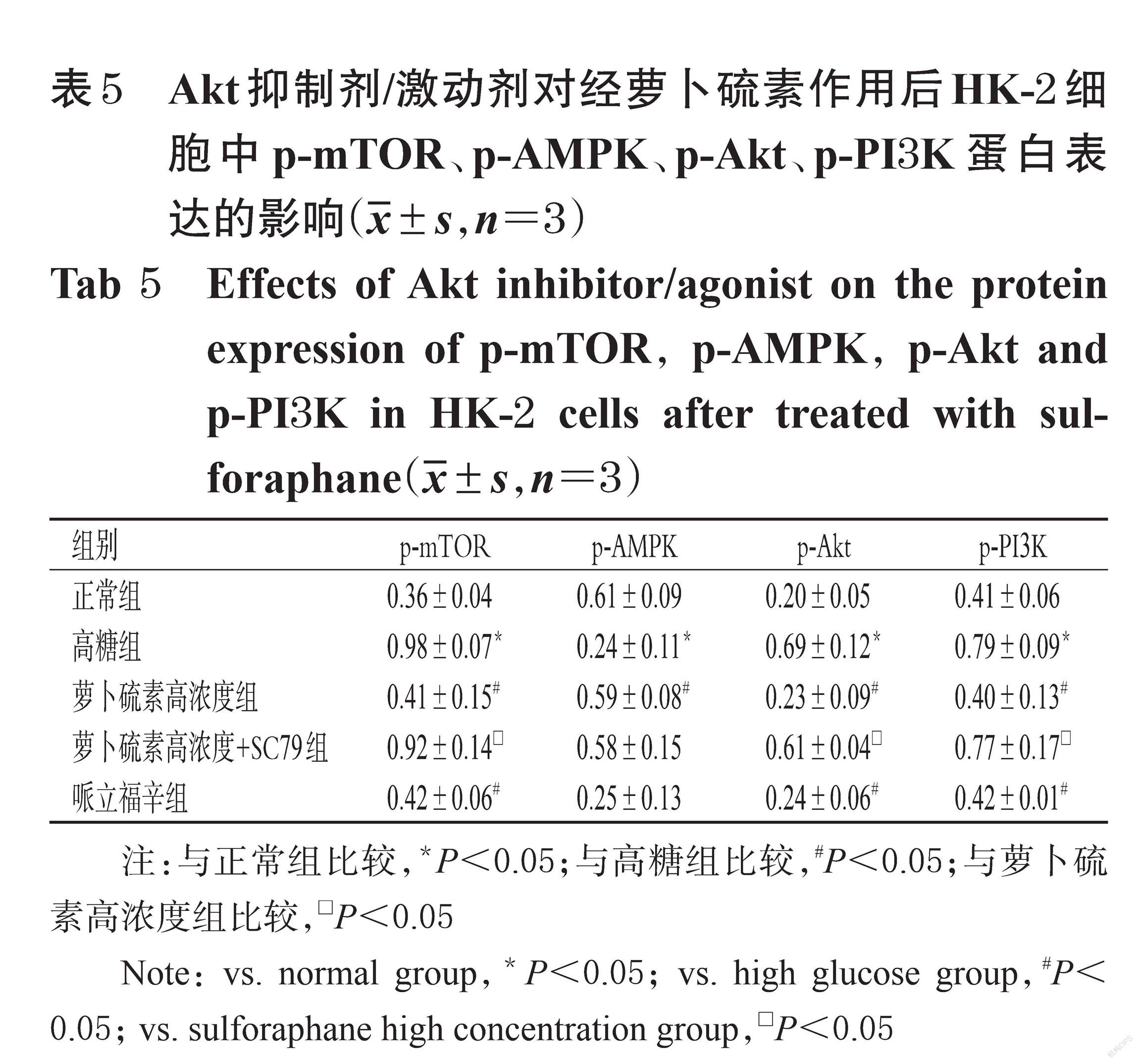
3.5.1 AMPK/mTOR信号通路 与高糖组比较,阿卡地新组细胞中p-AMPK蛋白的表达量显著升高(P<0.05),p-mTOR蛋白的表达量显著降低(P<0.05);与萝卜硫素高浓度组比较,阿卡地新组细胞中上述蛋白的表达量差异均无统计学意义(P>0.05)。与萝卜硫素高浓度组比较,萝卜硫素高浓度+compound C组细胞中p-AMPK蛋白的表达量显著降低(P<0.05),p-mTOR蛋白的表达量显著升高(P<0.05),p-Akt、p-PI3K蛋白的表达量差异均无统计学意义(P>0.05)。结果见图5、表4。
3.5.2 PI3K/Akt信号通路 与高糖组比较,哌立福辛组细胞中p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著降低(P<0.05);与萝卜硫素高浓度组比较,哌立福辛组细胞中上述蛋白的表达量差异均无统计学意义(P>0.05)。与萝卜硫素高浓度组比较,萝卜硫素高浓度+SC79组细胞中p-mTOR、p-Akt、p-PI3K蛋白的表达量均显著升高(P<0.05),p-AMPK蛋白的表达量差异无统计学意义(P>0.05)。结果见图6、表5。
4 讨论
有研究表明,cyclin D1作为细胞周期蛋白,可以正向调控细胞周期,促进细胞由G1期进入S期,从而促进细胞增殖[14]。caspase-3是引起细胞凋亡的关键酶,可通过促进细胞色素C释放入细胞质来激活caspase家族级联反应,从而诱导细胞凋亡和炎症反应的发生[15]。Bcl-2、Bax分别是Bcl家族中最主要的抗凋亡蛋白和促凋亡蛋白[16]。本研究结果显示,与正常组比较,高糖组细胞的存活率和细胞中cyclin D1、Bcl-2 mRNA的表达量均显著降低,凋亡率和细胞中caspase-3、Bax mRNA的表达量均显著升高。与高糖组比较,萝卜硫素低、中、高浓度组细胞的存活率和细胞中cyclin D1、Bcl-2 mRNA的表达量均显著升高,凋亡率和细胞中caspase-3、Bax mRNA的表达量均显著降低,其中萝卜硫素中、高浓度组上述指标的改善效果较萝卜硫素低浓度组更显著。这说明高糖可诱导肾小管上皮细胞凋亡,降低细胞存活率;而萝卜硫素可促进肾小管上皮细胞增殖,抑制其凋亡,且有浓度依赖性。
已有研究报道,厄贝沙坦可显著抑制高糖诱导肾小管上皮细胞凋亡并且促进其增殖,且厄贝沙坦在临床上可有效治疗2型糖尿病肾病患者早期的肾小管损伤[16-18]。为此,本研究以厄贝沙坦作为阳性对照药物,对比厄贝沙坦与萝卜硫素对高糖诱导肾小管上皮细胞损伤的影响。结果显示,与厄贝沙坦组比较,萝卜硫素高浓度组细胞的存活率、凋亡率和cyclin D1、caspase-3、Bcl-2、Bax mRNA的表达量差异均无统计学意义。这说明高浓度萝卜硫素对上述指标的影响与厄贝沙坦相当。
AMPK是一种丝氨酸/苏氨酸蛋白激酶,可通过影响体内很多信号通路(如mTOR等)的激活,从而调控体内代谢[19]。既往研究表明,AMPK可以通过磷酸化激活体内糖代谢,从而恢复机体对葡萄糖的摄取[20]。除此以外,AMPK还可以通过下调mTOR的磷酸化水平来改善高糖诱导的足细胞凋亡[21]。Lee等[22]发现,高糖诱导肾小球细胞GMCs中p-AMPK的表达减少,同时连接蛋白CX43的表达亦有所下降;而激活AMPK可以降低mTOR的表达,逆转高糖诱导的CX43下调,从而延缓GMCs衰老[23]。本研究结果显示,与高糖组比较,萝卜硫素可上调高糖诱导HK-2细胞中p-AMPK的表达,下调p-mTOR的表达,且有浓度依赖性,其中萝卜硫素高浓度组的改善效果与厄贝沙坦组相当。这说明萝卜硫素对肾小管上皮细胞的保护作用可能与调控AMPK/mTOR信号通路有关。为了进一步验证该机制,本研究考察了AMPK激动剂阿卡地新以及AMPK抑制剂compound C与高浓度萝卜硫素联用对高糖诱导HK-2细胞中AMPK/mTOR信号通路的影响。结果显示,与高糖组比较,阿卡地新组细胞中p-AMPK蛋白的表达量显著升高,p-mTOR蛋白的表达量显著降低,该作用与萝卜硫素高浓度组相当。与萝卜硫素高浓度组比较,萝卜硫素高浓度+compound C组细胞中p-AMPK蛋白的表达量显著降低,p-mTOR蛋白的表达量显著升高。这说明萝卜硫素对高糖诱导HK-2细胞中AMPK/mTOR信号通路的影响与AMPK激动剂一致,如果抑制AMPK的表达,则可逆转萝卜硫素的上述作用。
有研究表明,激活PI3K可以促进Akt磷酸化,从而调控下游转录因子(如forkhead box O)表达,PI3K/Akt信号通路被抑制也会导致p-mTOR蛋白表达水平的降低[24-25]。PI3K/Akt信号通路参与了多种肾脏疾病的发生发展,抑制PI3K/Akt信号通路激活可抑制高糖诱导肾小管上皮细胞-间充质转化,改善足细胞损伤,进而减缓糖尿病肾病的发展进程[26-29]。本研究结果显示,与高糖组比较,萝卜硫素可下调高糖诱导HK-2细胞中p-PI3K、p-Akt的表达,且有浓度依赖性,其中萝卜硫素高浓度组的改善效果与厄贝沙坦组相当。这说明萝卜硫素可能通过抑制PI3K/Akt信号通路来抑制高糖诱导HK-2细胞凋亡。为了进一步验证该机制,本研究考察了Akt抑制剂哌立福辛以及Akt激动剂SC79与高浓度萝卜硫素联用对高糖诱导HK-2细胞中PI3K/Akt信号通路的影响。结果显示,与高糖组比较,哌立福辛组细胞中p-PI3K、p-Akt、p-mTOR蛋白的表达量均显著降低,与萝卜硫素高浓度组水平相当。与萝卜硫素高浓度组比较,萝卜硫素高浓度+SC79组细胞中p-PI3K、p-Akt、p-mTOR蛋白的表达量均显著升高。这说明萝卜硫素对高糖诱导HK-2细胞中PI3K/Akt信号通路的影响与Akt抑制剂一致,如果激活Akt的表达,则可逆转萝卜硫素的上述作用。
综上所述,萝卜硫素可促进高糖诱导肾小管上皮细胞增殖,抑制其凋亡,同时上调cyclin D1和Bcl-2的表达,下调caspase-3和Bax的表达,其机制可能与上调p-AMPK表达,下调p-mTOR、p-Akt、p-PI3K表达有关。
参考文献
[ 1 ] TANG S C,LAI K N. The pathogenic role of the renal proximal tubular cell in diabetic nephropathy[J]. Nephrol Dial Transplant,2012,27(8):3049-3056.
[ 2 ] 王雅寧,张云芳,刘云启,等.黄芪甲苷对高糖诱导的肾小管上皮细胞损伤的保护作用及机制研究[J].中国医师杂志,2018,20(11):40-44.
[ 3 ] CHEN K,DAI H,YUAN J,et al. Optineurin-mediated mitophagy protects renal tubular epithelial cells against accelerated senescence in diabetic nephropathy[J]. Cell Death Dis,2018,9(2):105.
[ 4 ] 周徐雅.萝卜硫素的部分降糖机制研究及其脂质体的制备[D].合肥:安徽医科大学,2017.
[ 5 ] 覃正碧,毛卫林.萝卜硫素对肾小管上皮细胞氧化应激及Nrf2/HO-1信号通路的影响[J].中国药师,2017,20(5):809-812.
[ 6 ] 张尚维,李明星,赵蕊,等.糖尿病肾病发生的氧化应激机制及抗氧化治疗的研究进展[J].中国药理学与毒理学杂志,2020,34(8):634-640.
[ 7 ] 任杰,蒋何菲,赵娟,等.萝卜硫素及其衍生物BSFN通过激活PI3K/Akt途径诱导SH-SY5Y细胞凋亡[J].中国药学杂志,2014,49(20):1813-1819.
[ 8 ] WANG X,LIN Y,KEMPER T,et al. AMPK and Akt/mTOR signaling pathways participate in glucose-mediated regulation of hepatitis B virus replication and cellular auto- phagy[J]. Cell Microbiol,2020,22(2):e13131.
[ 9 ] BATENBURG W W,GARRELDS I M,BERNASCONI C C,et al. Angiotensin Ⅱ type 2 receptor-mediated vasodilation in human coronary microarteries[J]. Circulation,2004,109(19):2296-2301.
[10] 尚粉青,闫龙龙,张玎,等.高糖通过调节腺苷酸活化蛋白激酶/聚二磷酸腺苷核糖聚合酶-1的磷酸化抑制B细胞淋巴瘤/白血病-6基因表达的研究[J].中国糖尿病杂志,2016,24(11):1012-1015.
[11] ANDREOZZI F,RACITI G A,NIGRO C,et al. The GLP-1 receptor agonists exenatide and liraglutide activate Glucose transport by an AMPK-dependent mechanism[J]. J Transl Med,2016,14(1):229.
[12] HUANG K,ZHAO W,WANG X,et al. Akt inhibition enhanced the growth inhibition effects of low-dose heavy- ion radiation via the PI3K/Akt/p53 signaling pathway in C6 glioblastoma cells[J]. Front Oncol,2021,11:649176.
[13] JING Z T,LIU W,XUE C R,et al. Akt activator SC79 protects hepatocytes from TNF-α-mediated apoptosis and alleviates d-Gal/LPS-induced liver injury[J]. Am J Physiol Gastrointest Liver Physiol,2019,316(3):G387-G396.
[14] 李伟,李双霞,孟元华,等. Piwil2蛋白和Cyclin D1蛋白在乳腺恶性叶状肿瘤组织中表达及其相关性研究[J].医学综述,2021,27(2):385-389.
[15] 李伟宏,田莉,刘俊保.莪术油对人子宫内膜癌HEC-1-B细胞增殖、凋亡及Caspase-3、Bax、Bcl-2蛋白表达的影响[J].河南中医,2021,41(3):384-387.
[16] 王晓霞,刘天龙,刘晶,等.黄芪甲苷对D-半乳糖诱导原代培养心肌细胞凋亡的保护作用及机制研究[J].中国药房,2018,29(9):1189-1193.
[17] 高兰,刘海蔚,纪群.厄贝沙坦通过抑制IRAK1介导p38 MAPK信号通路对高糖诱导的肾小管上皮细胞增殖和凋亡的影响[J].中国老年学杂志,2021,41(6):1289- 1293.
[18] 李中,云鹏.黄葵胶囊联合厄贝沙坦治疗早期2型糖尿病肾脏病肾小管损伤30例[J].长江大学学报(自科版),2018,15(24):15-18.
[19] HA T S,PARK H Y,NAM J A,et al. Diabetic conditions modulate the adenosine monophosphate-activated protein kinase of podocytes[J]. Kidney Res Clin Pract,2014,33(1):26-32.
[20] ZHANG B B,ZHOU G C,LI C. AMPK:an emerging drug target for diabetes and the metabolic syndrome[J]. Cell Metab,2009,9(5):407-416.
[21] EID A A,FORD B M,BHANDARY B,et al. Mammalian target of rapamycin regulates Nox4-mediated podocyte depletion in diabetic renal injury[J]. Diabetes,2013,62(8):2935-2947.
[22] LEE M J,FELIERS D,MARIAPPAN M M,et al. A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy[J]. Am J Physiol Renal Physiol,2007,292(2):F617-F627.
[23] GUO Y N,WANG J C,CAI G Y,et al. AMPK-mediated downregulation of connexin43 and premature senescence of mesangial cells under high-glucose conditions[J]. Exp Gerontol,2014,51:71-81.
[24] ZHANG M,ZHANG X Y. The role of PI3K/AKT/FOXO signaling in psoriasis[J]. Arch Dermatol Res,2019,311(2):83-91.
[25] SHANG X,LIN K,YU R,et al. Resveratrol protects the myocardium in sepsis by activating the phosphatidylinositol 3-kinases(PI3K)/AKT/mammalian target of rapamycin(mTOR)pathway and inhibiting the nuclear factor-κB(NF-κB)signaling pathway[J]. Med Sci Monit,2019,25:9290-9298.
[26] 胡濤,韩璐. miR-23b过表达对高糖诱导近端肾小管上皮细胞EMT及PI3K-Akt通路的影响[J].河北医药,2019,41(2):190-194.
[27] 李锴,朱志辉,马医林,等. miR-93-3p对高糖诱导的肾小管上皮细胞损伤及炎症因子分泌的影响[J].西部医学,2020,32(10):1420-1424,1431.
[28] 祝再然,张明,赵桂金,等. SGLT2抑制剂对糖尿病肾病大鼠足细胞损伤及PTEN/PI3K/Akt信号通路的影响[J].广东医学,2020,41(24):2490-2494.
[29] 钟娟,陈静,青姚,等.川芎嗪通过抑制PI3K/Akt/mTOR通路诱导自噬改善糖尿病肾病大鼠肾损害[J].天津医药,2019,47(4):395-400.
(收稿日期:2021-07-05 修回日期:2021-10-08)
