黄精中糖类成分的含量测定方法比较及其酒蒸工艺优化
2021-12-30潘东梅蔡维珊梁业婷沈颖史哲铭易延逵
潘东梅 蔡维珊 梁业婷 沈颖 史哲铭 易延逵












中圖分类号 R283.3 文献标志码 A 文章编号 1001-0408(2021)24-2994-07
DOI 10.6039/j.issn.1001-0408.2021.24.09
摘 要 目的:比较黄精中多糖及还原糖的含量测定方法,并优化黄精的酒蒸工艺。方法:分别采用蒽酮-硫酸法和苯酚-硫酸法测定黄精中多糖的含量,分别采用蒽酮-硫酸法、苯酚-硫酸法和3,5-二硝基水杨酸(DNS)法测定黄精中还原糖的含量。以黄精炮制品的外观性状评分以及多糖、还原糖、总糖含量为指标,加酒量、蒸制时间、闷润时间为因素,采用拉丁方设计优化黄精的酒蒸工艺并比较蒸制前后多糖、还原糖、总糖含量。结果:蒽酮-硫酸法所得多糖、还原糖检测质量浓度的线性范围均为0.006 6~0.033 mg/mL(R 2=0.999 9),精密度、稳定性(90 min)、重复性试验的RSD分别小于3%、2%,平均加样回收率分别为99.75%(RSD=0.48%,n=6)、103.40%(RSD=1.25%,n=6);苯酚-硫酸法所得多糖、还原糖检测质量浓度的线性范围均为0.002 5~0.025 mg/mL(R 2=0.999 2),精密度、稳定性(90 min)、重复性的RSD分别小于5%、6%,平均加样回收率分别为112.80%(RSD=2.36%,n=6)、99.20%(RSD=3.47%,n=6);DNS法所得还原糖检测质量浓度的线性范围为0.01~0.18 mg/mL(R 2=0.999 9),精密度、稳定性(90 min)、重复性试验的RSD均小于2%,平均加样回收率为96.95%(RSD=1.19%,n=6)。黄精的最优酒蒸工艺为加酒量20%、闷润2 h、蒸制7 h。3次验证实验所得黄精酒蒸品中多糖、还原糖、总糖平均含量的RSD均小于3%(n=3)。4批生黄精中多糖、还原糖、总糖的平均含量分别为16.3%、11.2%、27.4%,4批黄精酒蒸品中多糖、还原糖、总糖的平均含量分别为3.4%、61.0%、64.4%。结论:黄精中多糖的含量测定以蒽酮-硫酸法为优,还原糖的含量测定以DNS法为优;黄精酒蒸品中多糖的含量明显下降,而还原糖和总糖的含量明显增加。
关键词 黄精;多糖;还原糖;含量测定;酒蒸工艺优化
Comparison of Determination Methods of Saccharides in Polygonatum cyrtonema and Optimization of Its Wine-steaming Technology
PAN Dongmei,CAI Weishan,LIANG Yeting,SHEN Ying,SHI Zheming,YI Yankui(School of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China)
ABSTRACT OBJECTIVE: To compare the methods for the content determination of polysaccharide and reducing sugar in Polygonatum cyrtonema, and to optimize the wine-steaming technology of P. cyrtonema. METHODS: The contents of polysaccharide in P. cyrtonema were determined by anthrone-sulfuric acid method and phenol-sulfuric acid method. The contents of reducing sugar in P. cyrtonema were determined by anthrone-sulfuric acid method, phenol-sulfuric acid method and 3,5-dinitrosalicylic acid (DNS) method, respectively. Taking appearance and property scores of processed products, the contents of polysaccharide, reducing sugar and total sugar as indicators, the amount of alcohol added, steaming time and moistening time as factors, the wine-steaming technology of P. cyrtonema was optimized by Latin square design. The contents of polysaccharide, reducing sugar and total sugar were compared before and after steaming. RESULTS: The linear ranges of polysaccharide and reducing sugar obtained by anthrone-sulfuric acid method were both 0.006 6-0.033 mg/mL (R2=0.999 9). RSDs of precision, stability (90 min) and reproducibility tests were all lower than 3% and 2%, respectively. Average recoveries were 99.75% (RSD=0.48%, n=6) and 103.40% (RSD=1.25%, n=6), respectively. The linear ranges of polysaccharide and reducing sugar obtained by phenol-sulfuric acid method were both 0.002 5-0.025 mg/mL (R2=0.999 2). RSDs of precision, stability (90 min) and reproducibility tests were all lower than 5% and 6%, respectively. Average recoveries were 112.80% (RSD=2.36%,n=6) and 99.20% (RSD=3.47%, n=6). The linear range of reducing sugar obtained by DNS method was 0.01-0.18 mg/mL(R2=0.999 9). RSDs of precision, stability (90 min) and reproducibility tests were all lower than 2%. Average recoveries was 96.95%(RSD=1.19%,n=6). The optimal wine-steaming technology of P. cyrtonema included the amount of alcohol added of 20%, moistening time of 2 h and steaming time of 7 h. RSDs of average contents of polysaccharide, reducing sugar and total sugar in wine-steamed products were all lower than 3% in 3 times of validation tests (n=3). The average contents of polysaccharide, reducing sugar and total sugar in 4 batches of P. cyrtonema were 16.3%, 11.2% and 27.4%; those of 4 batches of wine-steamed products were 3.4%, 61.0% and 64.4%, respectively. CONCLUSIONS: The anthrone- sulfuric acid method is the best for the determination of poly- saccharide in P. cyrtonema; DNS method is the best for the determination of reducing sugar in P. cyrtonema. The content of polysaccharide in wine-steamed products is decreased signifi- cantly, while the contents of reducing sugar and total sugar are increased significantly.
KEYWORDS Polygonatum cyrtonema; Polysaccharide; Reducing sugar; Content determination; Optimization of wine-steaming technology
基金项目:国家自然科学基金资助项目(No.82004101);南方医科大学2020年度大学生创新创业训练计划项目(No.S202012121109)
讲师,博士。研究方向:中医方剂。电话:020-61648263。E-mail:pandongmei1228@126.com
通信作者:副教授,博士。研究方向:药物新技术。电话:020-62789408。E-mail:dareyyk@sina.com
黄精为百合科植物黄精Polygonatum sibiricum Red.、滇黄精Polygonatum kingianum Coll. et Hemsl.或多花黄精Polygonatum cyrtonema Hua的干燥根茎,具有补气养阴、健脾益肾、润肺等功效[1]。黄精主要含有糖、皂苷、黄酮、木脂素、氨基酸、醌、生物碱、维生素等成分以及多种微量元素[2-3],其中糖类成分是黄精重要的活性成分,具有抗氧化、保护小鼠肝脏、增强小鼠免疫功能的作用[4-5];可降低糖尿病模型大鼠的血糖水平,延缓其眼部并发症的发生[6];可增加大鼠血液中超氧化物歧化酶活性,降低丙二醛含量,改善心肌肥厚症状[7]。此外,黄精还对三阴性乳腺癌抑制的骨髓造血有保护作用[8],可改善阿尔茨海默病模型大鼠海马组织的病理改变[9],可通过作用于病毒相关靶点而在新型冠状病毒肺炎治疗领域中发挥潜力[10]。现有文献报道的黄精中多糖和還原糖类成分的含量测定方法有蒽酮-硫酸法[1,11]和苯酚-硫酸法[12-13],此外还原糖的含量测定方法还包括3,5-二硝基水杨酸(DNS)法[12]。这些测定方法是糖类成分测定的常用方法,但所用试剂及反应原理各有不同,因此所得结果略有差异。
黄精的炮制方法较多,有蒸法、蔓荆子水蒸法、九蒸九晒法、黑豆煮法、水煮晒干复蒸晒法、取汁酒熬法、酒蒸法、熟地水蒸法、枸杞水蒸法、乳浸晒法等[14-16],2020年版《中国药典》(一部)记载的黄精常用炮制方法为酒蒸法[1]。目前,虽已有文献对黄精酒蒸工艺参数的优化进行了报道[17-18],但笔者在黄精酒蒸炮制的生产加工过程中发现,酒蒸可使多糖成分的含量明显下降,很难达到2020年版《中国药典》(一部)中规定的酒蒸黄精多糖含量[以无水葡萄糖(C6H12O6)计]不低于4.0%的要求[1]。基于此,本研究对黄精中糖类成分含量的测定方法进行了比较,同时采用拉丁方设计优化黄精的酒蒸工艺,旨在为其酒蒸品的质量控制提供依据,为规范黄精的酒蒸炮制生产加工工艺提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有UV-2600型紫外-可见分光光度计(日本Shimadzu公司)、T-500型电子天平(美国G&G公司)、Centrifuge 5804R型离心机(德国Eppendorf公司)、BS-ⅡOS型电子天平(德国Sartorius公司)、KH-100DE型数控超声仪(昆山禾创超声仪器有限公司)等。
1.2 主要药品与试剂
葡萄糖对照品(批号190622,纯度>99%)购自广州市齐云生物科技有限公司;黄酒(酒精度11~19度)购自浙江古越龙山绍兴酒股份有限公司;苯酚、蒽酮、硫酸、DNS、乙醇等试剂均为分析纯,水为去离子水。
4批黄精饮片样品均购买于2020年10月,经南方医科大学中药鉴定教研室刘传明副教授鉴定均为多花黄精P. cyrtonema Hua的干燥根茎。4批黄精饮片样品来源信息见表1。
2 方法与结果
2.1 黄精中多糖的含量测定方法比较
2.1.1 对照品溶液的制备
精密称定干燥至恒定质量的葡萄糖对照品,置于量瓶中,加水溶解并稀释至刻度,摇匀,制成质量浓度分别为0.33、0.125、1 mg/mL的对照品溶液。
2.1.2 供试品溶液的制备
取于60 ℃下干燥至恒定质量的黄精细粉(过五号筛)0.05 g,置于圆底烧瓶中,加80%乙醇30 mL,水浴中加热回流1 h,滤过,加80%乙醇定容至50 mL,即得黄精还原糖供试品溶液。将上述滤过的残渣和滤纸置于圆底烧瓶中,加水30 mL,水浴中加热回流1 h,趁热滤过,用热水洗涤残渣及烧瓶4次,每次2 mL,合并滤液与洗液,并转移至50 mL量瓶中,加水至刻度,摇匀,即得黄精多糖供试品溶液[1]。
2.1.3 检测波长的选择
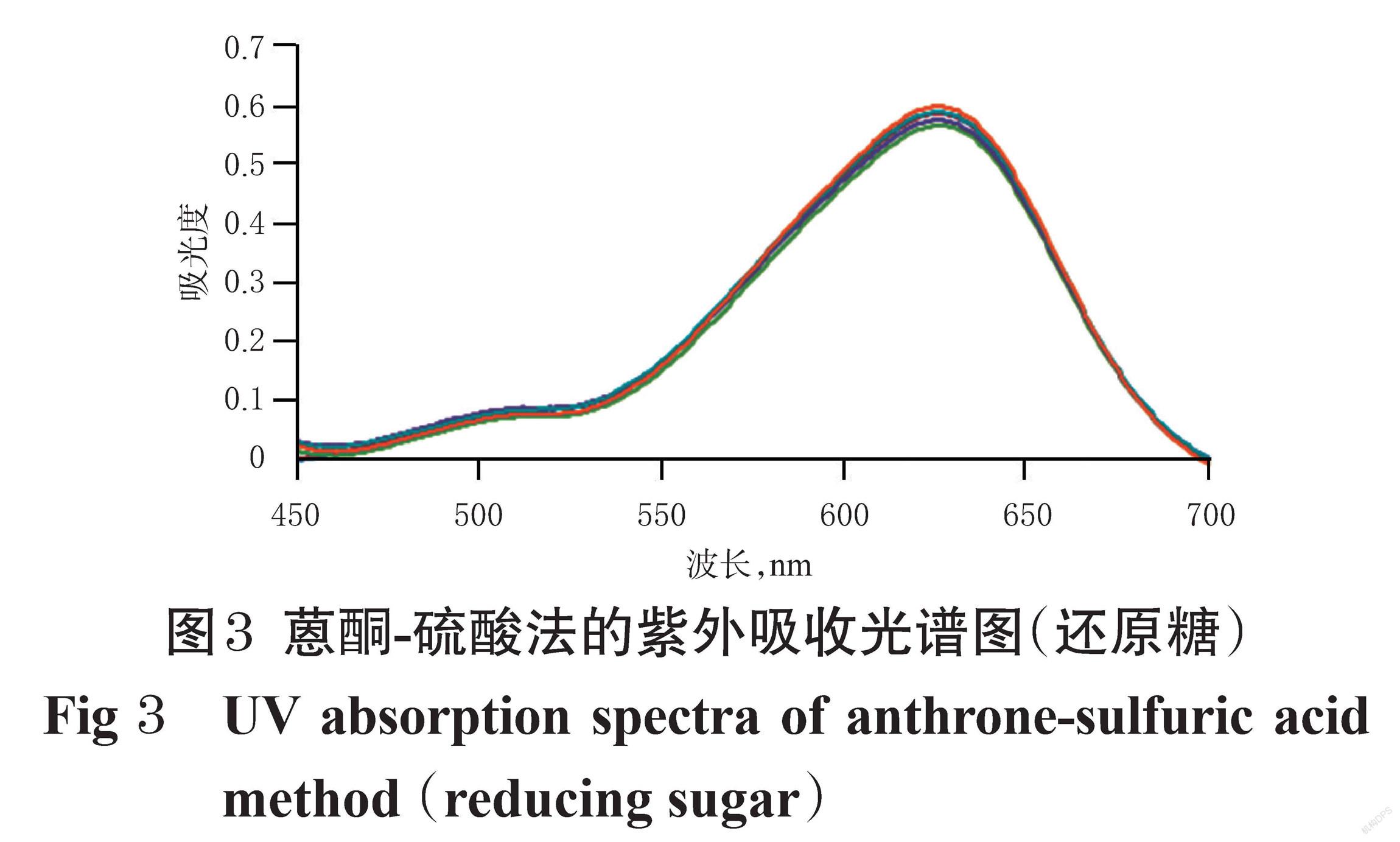
(1)蒽酮-硫酸法:取“2.1.1”项下质量浓度为0.33 mg/mL的葡萄糖对照品溶液、“2.1.2”项下黄精多糖供试品溶液(编号S3)各1 mL,分别置于不同试管中,加水至2 mL,摇匀,于冰浴中缓缓滴加0.2%蒽酮-硫酸溶液(精密称取蒽酮0.2 g,加80%浓硫酸100 mL溶解,摇匀,即得)至10 mL,混匀,放置5 min后,置于水浴中反应10 min,取出,立即置于冰浴中冷却10 min。以不含对照品、供试品的反应体系为空白对照,使用紫外-可见分光光度计于450~700 nm波长范围内进行扫描。结果显示,于625 nm波长处,对照品溶液、黄精多糖供试品溶液均有最大吸收,故选择蒽酮-硫酸法的检测波长为625 nm。结果见图1。
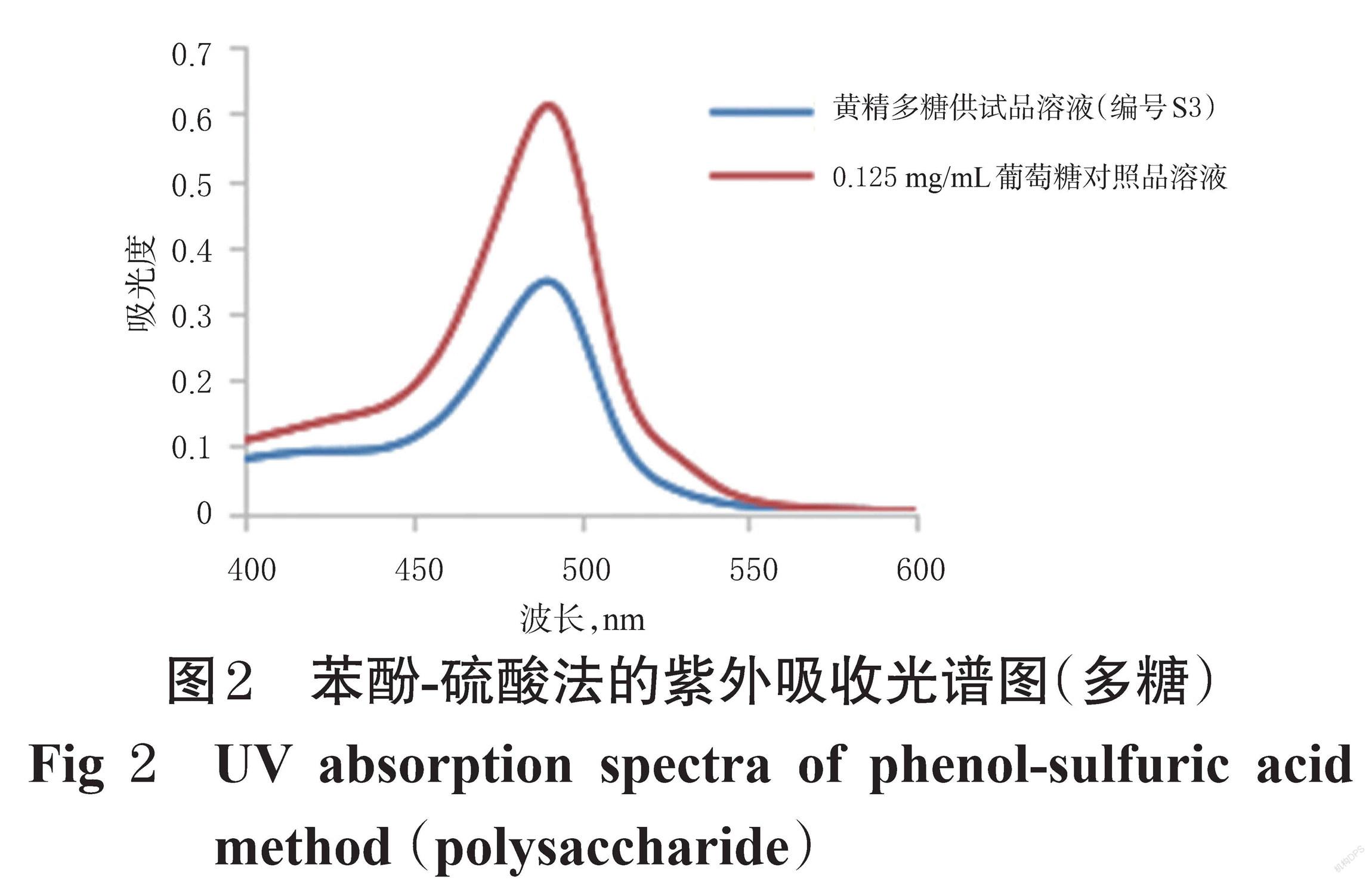
(2)苯酚-硫酸法:取“2.1.1”项下质量浓度为0.125 mg/mL的葡萄糖对照品溶液、“2.1.2”项下黄精多糖供试品溶液(编号S3)各0.5 mL,分别置于不同试管中,加水至2 mL,分别精密加入5%苯酚溶液(精密称取苯酚2.5 g,用水溶解并定容至50 mL,即得)1 mL、浓硫酸7 mL,摇匀,于水浴中加热20 min,然后冷却至室温。以不含对照品、供试品的反应体系为空白对照,使用紫外-可见分光光度计于400~600 nm波长范围内进行扫描。结果显示,于490 nm波长处,对照品溶液、黄精多糖供试品溶液均有最大吸收,故选择苯酚-硫酸法的检测波长为490 nm。结果见图2。
2.1.4 线性关系考察
(1)蒽酮-硫酸法:分别精密量取“2.1.1”项下质量浓度为0.33 mg/mL的葡萄糖对照品溶液0.2、0.4、0.6、0.8、1.0 mL,按“2.1.3(1)”项下方法显色后,使用紫外-可见分光光度计于625 nm波长处测定吸光度。以葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标进行线性回归。结果显示,多糖的回归方程为y=37.363 6x-0.025 8(R 2=0.999 9),表明多糖检测质量浓度的线性范围为0.006 6~0.033 mg/mL。
(2)苯酚-硫酸法:分别精密量取“2.1.1”项下质量浓度为0.125 mg/mL的葡萄糖对照品溶液0.2、0.4、0.8、1.2、1.6、2.0 mL,按“2.1.3(2)”项下方法显色后,使用紫外-可见分光光度计于490 nm波长处测定吸光度。以葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标进行线性回归[19]。结果显示,多糖的回归方程为y=41.298x-9.000×10-5(R 2=0.999 2),表明多糖检测质量浓度的线性范围为0.002 5~0.025 mg/mL。
2.1.5 精密度试验
取“2.1.2”项下黄精多糖供试品溶液(编号S3),按“2.1.3”项下两种方法分别显色后,使用紫外-可见分光光度计分别于625、490 nm波长处连续测定6次吸光度。结果显示,蒽酮-硫酸法所得吸光度的RSD为2.60%(n=6),苯酚-硫酸法所得吸光度的RSD为3.67%(n=6)。
2.1.6 重复性试验
取黄精细粉(编号S3)0.05 g,按“2.1.2”项下方法制备黄精多糖供试品溶液,共12份,再按“2.1.3”项下两种方法分别显色(每个方法各6份)后,使用紫外-可见分光光度计分别于625、490 nm波长处测定吸光度。结果显示,蒽酮-硫酸法所得含量的RSD为1.15%(n=6),苯酚-硫酸法所得含量的RSD为4.08%(n=6)。
2.1.7 稳定性试验
取“2.1.2”项下黄精多糖供试品溶液(编号S3),按“2.1.3”项下两种方法分别显色,并在室温下放置0、10、20、30、60、90 min时使用紫外-可见分光光度计分别于625、490 nm波长处测定吸光度。结果显示,蒽酮-硫酸法所得吸光度的RSD为1.40%(n=6),苯酚-硫酸法所得吸光度的RSD为2.13%(n=6)。
2.1.8 加样回收率试验
取已知含量的黄精细粉(编号S3)0.05 g,共12份,按“2.1.2”项下方法制备黄精多糖供试品溶液,精密加入对照品溶液0.4 mL(蒽酮-硫酸法为0.33 mg/mL的葡萄糖对照品溶液,苯酚-硫酸法为0.125 mg/mL的葡萄糖对照品溶液),混匀,再按“2.1.3”项下两种方法分别显色(每个方法各6份)后,使用紫外-可見分光光度计分别于625、490 nm波长处测定吸光度并计算加样回收率。结果显示,蒽酮-硫酸法的加样回收率为98.50%~100.80%,平均加样回收率为99.75%(RSD=0.48%,n=6);苯酚-硫酸法的加样回收率为107.50%~121.50%,平均加样回收率为112.80%(RSD=2.36%,n=6)。
2.2 黄精中还原糖的含量测定方法比较
2.2.1 检测波长的选择
(1)蒽酮-硫酸法:取“2.1.2”项下黄精还原糖供试品溶液(编号S3),共6份,其余操作及结果(未取葡萄糖对照品溶液)同“2.1.3(1)”项。结果见图3。
(2)苯酚-硫酸法:取“2.1.2”项下黄精还原糖供试品溶液(编号S3),共6份,其余操作及结果(未取葡萄糖对照品溶液)同“2.1.3(2)”项。结果见图4。
(3)DNS法:分别精密吸取“2.1.2”项下黄精还原糖供试品溶液(编号S3)3.5 mL、“2.1.1”项下质量浓度为1 mg/mL的葡萄糖对照品溶液0.1、0.2、0.3、0.6、0.9、1.2、1.5、1.8 mL,加水至4 mL,分别精密加入DNS溶液(取DNS 0.65 g,用水溶解后,加入2 mol/L氢氧化钠溶液2.5 mL、丙三醇4.5 g,再用水定容至100 mL,即得)5 mL,混匀,于水浴中煮沸5 min,然后冷却至室温,加水定容至10 mL,以不含对照品、供试品的反应体系为空白对照,使用紫外-可见分光光度计于450~700 nm波长范围内进行扫描。结果显示,于500 nm波长左右,对照品溶液、黄精还原糖供试品溶液均有较大吸收,但此波长下DNS也有吸收,对测定结果有一定干扰。有研究认为,采用DNS法测定还原糖时宜以520 nm为检测波长[12],故本研究选择DNS法的检测波长为520 nm。结果见图5。
2.2.2 线性关系考察
(1)蒽酮-硫酸法:操作及结果同“2.1.4(1)”项。
(2)苯酚-硫酸法:操作及结果同“2.1.4(2)”项。
(3)DNS法:取“2.1.1”项下质量浓度为1 mg/mL的葡萄糖对照品溶液0.1、0.2、0.3、0.6、0.9、1.2、1.5、1.8 mL,按“2.2.1(3)”项下方法显色后,使用紫外-可见分光光度计于520 nm波长处测定吸光度。以葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标进行线性回归。结果显示,还原糖的回归方程为y=12.370 3x-0.120 2(R 2=0.999 9),表明还原糖检测质量浓度的线性范围为0.01~0.18 mg/mL。
2.2.3 精密度试验
取“2.1.2”项下黄精还原糖供试品溶液(编号S3),按“2.2.1”项下3种方法分别显色后,使用紫外-可见分光光度计分别于625、490、520 nm波长处连续测定6次吸光度。结果显示,蒽酮-硫酸法所得吸光度的RSD为1.35%(n=6),苯酚-硫酸法所得吸光度的RSD为0.39%(n=6),DNS法所得吸光度的RSD为0.99%(n=6)。
2.2.4 重复性试验
取黄精细粉(编号S3)0.05 g,按“2.1.2”项下方法制备黄精还原糖供试品溶液,共18份,按“2.2.1”项下3种方法分别显色(每个方法各6份)后,使用紫外-可见分光光度计分别于625、490、520 nm波长处测定吸光度。结果显示,蒽酮-硫酸法所得含量的RSD为1.75%(n=6),苯酚-硫酸法所得含量的RSD为5.01%(n=6),DNS法所得含量的RSD为1.43%(n=6)。
2.2.5 稳定性试验
取“2.1.2”项下黄精还原糖供试品溶液(编号S3),按“2.2.1”项下3种方法分别显色,并在室温下放置0、10、20、30、60、90 min时分别于625、490、520 nm波长处测定吸光度。结果显示,蒽酮-硫酸法所得吸光度的RSD为0.33%(n=6),苯酚-硫酸法所得吸光度的RSD为0.77%(n=6),DNS法所得吸光度的RSD为0.65%(n=6)。
2.2.6 加样回收率试验
取已知含量的黄精细粉(编号S3)0.05 g,按“2.1.2”项下方法制备黄精还原糖供试品溶液。取0.2 mL,共6份,分别精密加入“2.1.1”项下质量浓度为0.33 mg/mL的葡萄糖对照品溶液0.4 mL(蒽酮-硫酸法)。取上述制备的黄精还原糖供试品溶液0.1 mL,共6份,分别精密加入“2.1.1”项下质量浓度为0.125 mg/mL的葡萄糖对照品溶液0.4 mL(苯酚-硫酸法)。取上述制备的黄精还原糖供试品溶液3.5 mL,共6份,分别精密加入“2.1.1”项下质量浓度为1 mg/mL的葡萄糖对照品溶液0.3 mL(DNS法)。按“2.2.1”项下3种方法分别显色后,使用紫外-可见分光光度计分别于625、490、520 nm波长处测定吸光度并计算加样回收率。结果显示,蒽酮-硫酸法的加样回收率为97.00%~108.30%,平均加样回收率为103.40%(RSD=1.25%,n=6);苯酚-硫酸法的加样回收率为95.00%~109.50%,平均加樣回收率为99.20%(RSD=3.47%,n=6);DNS法的加样回收率为95.00%~99.30%,平均加样回收率为96.95%(RSD=1.19%,n=6)。
2.2.7 黄精多糖及还原糖的含量测定
参考“2.1”“2.2”项下方法学考察结果,取4批黄精饮片,按“2.1.2”项下方法分别制备黄精多糖、还原糖供试品溶液,采用蒽酮-硫酸法测定其中多糖的含量,采用DNS法测定其中还原糖的含量,并计算总糖含量:总糖含量=多糖含量+还原糖含量。
2.3 拉丁方设计优化黄精的酒蒸工艺
2.3.1 因素与水平
以黄精多糖、还原糖、总糖含量和外观性状评分(外观性状评分为色泽、气味、质地评分之和,其标准[20]见表2)为指标,以加酒量(以药材总量的百分含量计)、蒸制时间、闷润时间(蒸制时间为关注因素,其余因素为非关注因素[21])为因素,采用5×5拉丁方设计优化黄精的酒蒸工艺。黄精酒蒸工艺拉丁方设计的因素与水平见表3、实验设计方案与结果见表4。
采用SPSS 26.00软件对表4中的外观性状评分、多糖含量、还原糖含量、总糖含量进行分析。外观性状评分等指标的主体间效应检验结果见表5,各因素的事后检验结果见表6~表8。
由表5、表6可知,蒸制时间对外观性状评分有显著影响(P=0.038),随着蒸制时间的延长,外观性状评分呈增长趋势,当蒸制7 h后,外观性状评分达到稳定;随着蒸制时间的延长,多糖含量呈先增加后降低的趋势,于蒸制7 h时达到最高,随后趋于稳定;随着蒸制时间的延长,还原糖及总糖含量略有波动,均于蒸制7 h时较高,随后趋于稳定,故选择蒸制时间为7 h。由表7可知,当加酒量为20%时,外观性状评分为最高;当加酒量为20%、30%时,多糖含量相差不大且均较高;当加酒量为20%时,还原糖及总糖含量均为最高,故选择加酒量为20%。由表8可知,随着闷润时间的延长,外观性状评分的变化不大,表明闷润时间对其影响不大;随着闷润时间的延长,多糖含量呈先增加后降低的趋势,还原糖及总糖含量呈先降低后升高的趋势,考虑到上述整体变化趋势,选择闷润时间为2 h。
可见,黄精最优酒蒸工艺为加酒量20%、闷润2 h、蒸制7 h。
2.3.2 验证实验
取黄精饮片样品(编号S3)适量,按“2.3.1”项下最优酒蒸工艺平行制备3批酒蒸黄精,按“2.2.7”项下方法测定其中多糖及还原糖含量并计算总糖含量。结果显示,所制3批黄精酒蒸品中多糖、还原糖、总糖的平均含量分别为3.0%(RSD=2.65%,n=3)、58.7%(RSD=2.91%,n=3)、61.7%(RSD=2.86%,n=3),表明优化所得酒蒸工艺稳定、可行。
2.3.3 黄精酒蒸品的制备及含量比较
取4批黄精饮片样品,按上述最优酒蒸工艺炮制,按“2.2.7”项下方法测定其中多糖及还原糖含量并计算总糖含量。以生黄精为对照,进行含量比较。每批样品测定3次。结果显示,4批生黄精中多糖、还原糖、总糖的平均含量分别为16.3%、11.2%、27.4%;4批黄精酒蒸品中多糖、还原糖、总糖的平均含量分别为3.4%、61.0%、64.4%,多糖含量明显降低,而还原糖和总糖含量明显升高,提示优化所得最优酒蒸工艺可明显提高黄精中糖类成分的总含量。结果见表9。
3 讨论
本研究在采用苯酚-硫酸法测定黄精多糖含量时,所得平均加样回收率(112.80%)偏大,其原因可能为:在室温下,苯酚的溶解扩散较慢,经超声处理可使苯酚溶解,但过一段时间后溶液会出现分层现象,导致实验过程中每次量取的苯酚溶液的质量浓度有所偏差,从而影响实验结果[21]。同时,因为苯酚自身易被氧化,故实验中所使用的苯酚需要进行重蒸,以避免因苯酚反应量不够而影响实验结果[21]。鉴于此,本研究选择蒽酮-硫酸法测定黄精多糖的含量。笔者在研究过程中发现,S3批生黄精采用DNS法测得的还原糖含量仅为13.1%,而采用蒽酮-硫酸法和苯酚-硫酸法测得的还原糖含量超过80%,其原因可能与黄精中含有较多的可溶于乙醇的苷类化合物有关[2-3];但由于蒽酮-硫酸法和苯酚-硫酸法均使用了浓硫酸,而浓硫酸会使糖苷中的糖基部分脱水而形成糠醛及其衍生物,因此这两种方法测得的还原糖含量还包括了其他成分的含量,故本研究选择DNS法测定黄精还原糖的含量。
黄精中的黏液质有刺激咽喉的副作用,经炮制后,黄精多糖发生降解,使得大量黏液质被除去,刺激咽喉的副作用有所减少,加之多糖降解所产生的低聚糖具有提高免疫、抗氧化等药理作用,从而增强了黄精的补益功效[22]。酒具有行药势、通血脉等作用,能增加中药有效成分的溶出,且有利于增强黄精中低聚糖提高免疫力、抗氧化的功效[14]。
拉丁方设计表的行与列皆为配伍组,可减少实验次数[23]。本研究采用拉丁方设计优化黄精的酒蒸工艺,结果显示,最优酒蒸工艺为加酒量20%、闷润2 h、蒸制7 h。优化所得酒蒸工艺可明显提高黄精还原糖和总糖含量,而明显降低多糖含量,这可能与炮制过程中,在高温或其他因素的影响下,多糖成分发生降解而生成低聚糖或单糖有关[17-18]。2020年版《中国药典》(一部)要求,生黄精及其蒸制品均以黄精多糖为含量指标[1]。有研究认为,黄精以蒸制和九蒸九晒为宜[14],但经蒸制后黄精的多糖含量明显减少,且蒸制达到一定时间或蒸制次数过多,其多糖含量均难以达到《中国药典》“不低于4.0%”的要求[1]。因此,笔者认为,可将还原糖和总糖含量作为评价黄精质量的指标。
综上所述,黄精中多糖的含量测定以蒽酮-硫酸法为优,还原糖的含量测定以DNS法为优。所得最优酒蒸工艺为加酒量20%、闷润2 h、蒸制7 h;黄精酒蒸品中多糖的含量明显下降,还原糖和总糖的含量明显增加。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:319-320.
[ 2 ] 赵文莉,赵晔,TSENG Y. 黄精药理作用研究进展[J].中草药,2018,49(18):4439-4445.
[ 3 ] 范佐旺,柯晓燕,陈靓雯,等.多花黄精的化学成分及药理研究进展[J].中医药信息,2020,37(5):119-126.
[ 4 ] WANG G J,FU Y W,LI J J,et al. Aqueous extract of Polygonatum sibiricum ameliorates ethanol-induced mice liver injury via regulation of the Nrf2/ARE pathway[J]. J Food Biochem,2021,45(1):e13537.
[ 5 ] 張庭廷,夏晓凯,陈传平,等.黄精多糖的生物活性研究[J].中国实验方剂学杂志,2006,12(7):42-45.
[ 6 ] 王艺,彭国庆,陈迪,等. PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察[J].国际眼科杂志,2016,16(3):428-434.
[ 7 ] 方欢乐,李晓明,李秋全,等.黄精多糖的提取及抗氧化作用的研究[J].生物化工,2018,4(3):11-12,15.
[ 8 ] XIE Y,JIANG Z W,YANG R,et al. Polysaccharide-rich extract from Polygonatum sibiricum protects hematopoiesis in bone marrow suppressed by triple negative breast cancer[J]. Biomed Pharmacother,2021,137:111338.
[ 9 ] YI Y X,WU S X,YE M S,et al. Effect of Aβ1-42 injection on hippocampus cells in rats and protective role of polygona-polysaccharose for Alzheimer’s disease[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban,2014,39(4):344-348.
[10] MU C L,SHENG Y F,WANG Q,et al. Potential compound from herbal food of rhizoma polygonati for treatment of COVID-19 analyzed by network pharmacology:viral and cancer signaling mechanisms[J]. J Funct Foods,2021,77:104149.
[11] 王聪.多花黄精多糖提取分离、分子量测定及其粗多糖的初步药效研究[D].成都:成都中医药大学,2012.
[12] 张志君,孙伟,李永亮,等. 3,5-二硝基水杨酸法联合苯酚-浓硫酸法测定不同产地黄精中多糖含量[J].中国实验方剂学杂志,2012,18(6):106-109.
[13] 蓝松.苯酚-硫酸法测定黄精多糖含量研究[J].广东化工,2013,40(18):132-133.
[14] 龚千锋.中药炮制学[M]. 4版.北京:中国中医药出版社,2016:313.
[15] 张亨柱.黄精炮制品功效差异初探[J].海峡药学,2019,31(6):36-39.
[16] 吴建华,张涓,崔於.黄精炮制工艺的研究进展[J].川北医学院学报,2013,28(1):27-30.
[17] 陈丽霞,王建科,耿晓玲.综合评分法优选黄精蒸制工艺[J].微量元素与健康研究,2017,34(5):38-40.
[18] 孙秀梅,栾妮娜,张兆旺.黄精饮片3种蒸制工艺的比较[J].山东中医药大学学报,2010,34(6):542-543.
[19] 瞿昊宇,冯楚雄,谢梦洲,等.不同炮制方法对黄精多糖含量的影响[J].湖南中医药大学学报,2015,35(12):53-55.
[20] 钟凌云. 中药炮制学[M]. 5版.北京:中国中医药出版社,2021:299-300.
[21] 李艳辉.无机及分析化学实验[M]. 3版.南京:南京大学出版社,2019:245.
[22] 吴丰鹏,李芹英,吴彦超,等.九蒸九制对黄精多糖单糖组成及其抗氧化性的影响[J].食品工业科技,2021,42(2):42-46.
[23] 颜艳,王彤.医学统计学[M]. 5版.北京:人民卫生出版社,2020:256.
(收稿日期:2021-08-04 修回日期:2021-11-24)
