接骨木提取物对酒精性骨重构大鼠模型骨代谢、骨稳态及骨凋亡的实验研究
2021-12-30申意伟李雪李毅范桢亮李佐杨冰佑
申意伟,李雪,李毅,范桢亮,李佐,杨冰佑
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;3.北药基础与应用研究教育部重点实验室,黑龙江 哈尔滨 150040;4.东北师范大学生命科学院,吉林 长春 130024;5.浙江省中医院肾病科,浙江 杭州 310006)
酒精性骨重构(Alcoholic Bone Remodeling,ABR)是以全身骨质和骨量异常为特征[1-2],是酒精诱导骨组织细胞异常代谢而导致骨稳态失衡的综合反映,表现为骨髓间充质干细胞、成骨细胞、破骨细胞、骨细胞等活性和功能异常[3],破坏了成骨/破骨生理平衡,破坏了骨生物力学性能[4],是酒精性骨坏死、酒精性骨质疏松症[5-6]等的共同病理过程。接骨木(SambucuswilliamsiiHance)系忍冬科接骨木属植物,又名续骨木、铁骨散、舒筋树,为落叶灌木或乔木,分布于中国,韩国和日本的不同地区,其天然资源极为丰富。接骨木为民间骨病治疗常用药,已有数千年历史,其性味甘苦平,无毒,具有祛风利湿、活血止痛等功效,具有抗炎镇痛、抗氧化等作用,主要用于治疗骨质疏松[7]、骨折[8]、跌打肿痛及创伤出血等病症[9-10]。在前期研究证实接骨木促进骨折愈合、抗炎症、抗氧化及改善骨稳态的基础上[8,11-13],本研究拟进一步采用酒精腹腔注射复制酒精性骨重构大鼠模型,从骨代谢、骨稳态及骨凋亡等角度评价接骨木对酒精性骨紊乱的干预作用,为临床防治酒精性骨病提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
10周龄雄性SD大鼠30只,清洁级,体质量205~245 g,由辽宁沈阳长生科技有限公司提供,实验动物质量合格证编号:SCXK(辽)2015-0001。屏障系统条件下[实验动物使用许可证:SYXK(黑)2016004],标准颗粒饲料喂养,周期照明,室内室温 20~25 ℃,相对湿度 40%~70%,实验期间动物自由饮食和饮水。
1.1.2 仪器
酶标仪,杭州奥盛仪器有限公司(型号:AMR-100);大小鼠电子秤,北京冀诺泰科技发展有限公司(型号:JNT-DC);实时PCR系统,美国Applied Bio-Systems Instruments公司(型号:ABI 7900HT);电泳仪,美国Electrophoresis Power Supply公司(型号: EPS 301GE);分光光度计,美国Thermo Fisher Scientific公司(型号:NanoDrop 2000C);显微镜,日本Nikons公司(型号:Eclipse Ci-L) ,双色红外荧光成像系统,美国LI-COR Odyssey公司(型号:ODY-2569)。
1.1.3 药品与试剂
1.1.3.1 接骨木提取物制备方法
干燥的接骨木根皮(5 kg),经95%乙醇(75 L)回流提取2次,每次2 h,过滤,合并提取液,浓缩干燥得乙醇提取物(264 g)。将乙醇提取物加水溶解,经AB-8大孔吸附树脂柱色谱柱,用20倍树脂床体积的蒸馏水洗去糖等水溶性杂质,用50%乙醇、95%乙醇依次洗脱,减压回收50%乙醇洗脱液,即为本研究供试药品(105 g),已经证明为接骨木主要药效部位及组分[8,11]。
1.1.3.2 试剂
无水乙醇(致远化学科技有限公司,批号20171113);切片石蜡(汇恒化工科技有限公司,批号39601095);中性树胶(索莱宝科技有限公司,批号20190827);中性福尔马林固定液(索莱宝科技有限公司,货号: G2161);改良HE染色试剂盒(索莱宝科技有限公司,货号:G1121);RIPA缓冲液(碧云天生物技术公司,批号:P0013B);BCA蛋白质测定试剂盒(碧云天生物技术公司,批号:P0012);QuickBlockTMWestern封闭液(碧云天生物技术公司,货号:P0252);TRIzol试剂(美国Invitrogen公司,批号:15596018);逆转录试剂盒(美国Promega公司,批号:A5000);实时定量PCR反应体系试剂盒(美国Promega公司,批号:A6010)。Anti-Cleaved Caspase-3抗体(Abcam ,ab49822)、重组Anti-Caspase-3抗体(Abcam ,ab224271)、重组Anti-Bax抗体 (Abcam ,ab32503)、Anti-beta Actin抗体(Abcam,ab8226)。维生素D(VD)检测试剂盒(美国ImmunoClone(I&C)公司,货号:ZY-VD-Ge);大鼠IGF-1检测试剂盒(上海康朗生物科技有限公司,货号:im-E30653);大鼠抗酒石酸酸性磷酸酶(ACP5)酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R0939c);大鼠骨钙素/骨谷氨酸蛋白(OT/BGP)ELISA Kit(武汉华美生物工程有限公司,货号:CSB-E05129r)。
1.2 分组与干预
所有大鼠适应性喂养7 d后, 随机分为空白组、模型组和中药组, 每组10只。模型组和中药组大鼠参考酒精性骨重构模型造模方法[14]采用20%(v∶v)酒精腹腔注射,10 mL/kg, 每日1次,共12周,复制酒精性骨损伤模型;正常组给予等体积生理盐水腹腔注射。在造模开始第1天,中药组在酒精造模基础上给予接骨木提取物340 mg/kg,每日1次灌胃,共12周;空白组和模型组给予等体积生理盐水灌胃。
1.3 样本采集及处理
大鼠称重后禁食12 h,麻醉后心脏取血,3 000 r/min、4 ℃离心15 min后分离血清,-80 ℃恒温冰箱保存备用。游离取股骨、椎体,剔除附着软组织,根据不同检测指标给予相应处置、备用。
1.4 检测指标与方法
1.4.1 椎体HE染色
取动物新鲜组织块投入固定液中使组织、细胞的蛋白质变性凝固;用不同梯度酒精作脱水剂,逐渐脱去组织块中的水分;将已透明的组织块置于已溶化的石蜡中,放入溶蜡箱保温,待石蜡完全浸入组织块后进行包埋;将包埋好的蜡块固定于切片机上,切成薄片,一般厚度为5~8 μm,贴到载玻片上,放45 ℃恒温箱中烘干;用二甲苯脱去切片中的石蜡,再经不同浓度酒精洗脱,最后入蒸馏水;放入苏木精-伊红染色液染色数分钟;经无水乙醇脱水,再经二甲苯使切片透明,封片。
1.4.2 qRT-PCR法检测骨代谢标记基因表达
游离腰5椎体,剔除周围软组,预处理骨组织样品[14],注意样品完整性。根据操作指南说明,使用TRIzol试剂(Invitrogen,CA,USA)提取骨组织样品总RNA,并根据操作指南说明使用高效cDNA逆转录试剂盒制备cDNA。qRT-PCR在ABI 7900实时PCR系统上进行,条件如下:保持阶段为95 ℃ 10 min,循环为40个循环,95 ℃ 30 s,60 ℃ 30 s和72 ℃ 30 s。检查了以下基因的表达:I型胶原蛋白Alpha 2链(COL1A2,上游5′-AAGAATGCATACAGCCGTGC-3′,下游5′-ACTGCTCTGACCAATCCTTC-3′),骨形态发生蛋白2(BMP2,上游5′-TGCGGTCTCCTAAAGGTCG-3′,下游5′-GGACTTAAGACGCTTCCGCT-3′),骨γ-羧基谷氨酸蛋白(BGLAP,上游5′-TGCGGTCTCCTAAAGGTCG,GGACTTAAGACGCTTCCGCT-3′),NF-κβ配体的受体激活剂(RANKL,上游5′-TGATGGAAGGTTCGTGGCTC-3′,下游5′-GGTACGCTCCCTGAGGTTTC-3′),白介素6(IL-6,上游5′-CCAGTTGCCTTCTTGGGACT-3′,下游5′-TCTGACAGTGCATCATCGCT-3′)和骨保护素(OPG,上游5′-GGCACACGAGTGATGAATGC-3′,下游5′-TCTTCGCACAGGGTGACATC-3′)。甘油醛-3-磷酸脱氢酶(GAPDH,上游5′-GTGAAGGTCGGTGTGAACGG-3′,下游5′-CCCCATTTGATGTTAGCGGG-3′)基因的表达水平作为参考。每个基因qRT-PCR进行3次重复处理。随后确定循环阈值(Ct),并使用2-ΔΔCT方法比较计算mRNA表达的相对定量。
1.4.3 ELISA法检测血清骨代谢标物IGF-1和Vitamin D以及骨稳态标物OCN和TRAP含量
按照对应试剂盒说明书对以上指标进行检测。
1.4.4 Western blot法检测凋亡标记基因表达
骨组织在RIPA裂解缓冲液中裂解,离心,用上样缓冲液稀释,95 ℃加热6 min。使用BCA试剂盒测定蛋白浓度。随后,蛋白样品通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,并印迹到聚偏二氟乙烯膜上(Millipore,Billerica,MA,USA)。将膜在封闭液中封闭2 h,分别在Anti-Cleaved Caspase-3抗体、重组Anti-Caspase-3抗体、重组Anti-Bax抗体和Anti-beta Actin抗体稀释液中4 ℃过夜。TBST洗涤3次,10 min/次,将膜与荧光基团偶联的二抗在室温下孵育1.5~2 h。荧光条带通过奥德赛(Odyssey)双色红外荧光成像系统进行扫描并可视化定量分析。
2 结果
2.1 组织病理学结果
HE染色结果表明,模型组较空白组骨小梁数目、骨小梁连通度减少,髓腔脂肪细胞数目增加,提示酒精摄入可导致骨质减少;中药组较模型组骨小梁数目、骨小梁连通度增加,髓腔脂肪细胞数目趋于正常水平,提示长期酒精摄入可导致大鼠骨质和骨量紊乱及髓脂代谢异常,接骨木提取物可在一定程度上拮抗酒精诱导的骨质和骨量代谢异常,可对酒精性骨重构起积极干预作用,见图1。
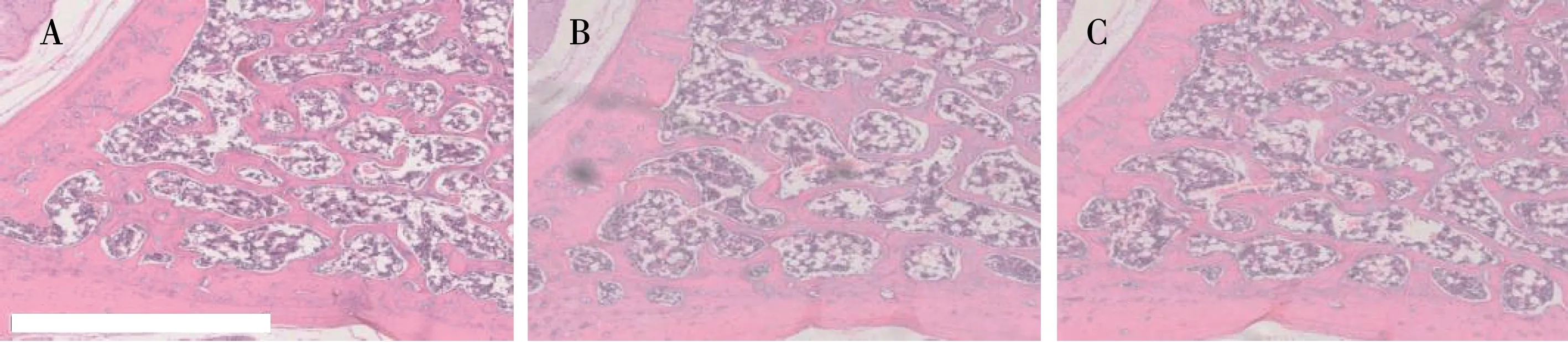
注:A.空白组;B.模型组;C.中药组。图1 椎体HE染色(×50)
2.2 各组对骨重构标志物mRNA的影响
结果表明,与空白组比较,模型组骨形成相关基因BMP2、COL1A2和BGLAP mRNA 表达显著降低,差异具有统计学意义(P<0.05),提示长期酒精摄入对骨形成有显著抑制作用;破骨活化相关基因RANKL和IL-6 mRNA表达显著增加,而骨保护素OPG mRNA表达显著降低,提示长期酒精摄入可激活破骨水平,增加骨质吸收,由此可见,酒精性骨重构表现为骨形成减少、骨吸收增加的骨稳态失衡。与模型组比较,中药组骨形成相关基因BMP2、COL1A2和BGLAP mRNA表达显著增加,差异具有统计学意义(P<0.05),提示骨碎补提取物可在一定程度上拮抗酒精对骨形成有显著抑制作用;破骨活化相关基因RANKL和IL-6 mRNA表达显著降低,而骨保护素OPG mRNA表达显著增加,提示骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导破骨水平激活,抑制骨质吸收,由此可见,骨碎补提取物可在一定程度上恢复酒精性骨重构所致骨形成减少、骨吸收增加的骨稳态失衡,平调成骨/破骨动态水平,平衡骨质代谢,见表1。
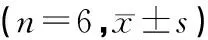
表1 各组骨重构标志物mRNA表达水平情况
2.3 各组对血清骨代谢标物IGF-1和Vitamin D水平的影响
结果表明,与空白组比较,模型组血清骨代谢标物IGF-1含量显著降低,差异具有统计学意义(P<0.05),提示长期酒精摄入可使IGF-1含量降低,有碍骨质形成;与模型组比较,中药组血清骨代谢标物IGF-1含量显著增加(P<0.05),提示骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导的骨质形成紊乱。血清Vitamin D含量在各组间均无显著差异,见表2。
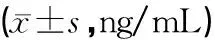
表2 各组血清骨代谢标物IGF-1和Vitamin D水平
2.3 各组对血清骨稳态标物OCN和TRAP含量的影响
结果表明,与空白组比较,模型组血清骨稳态标物TRAP(tartrate-resistant acid phosphatase 5)(骨吸收标记物)含量显著增加,差异具有统计学意义(P<0.05),提示长期酒精摄入可破坏骨稳态失衡,有利骨质吸收;与模型组比较,中药组血清骨稳态标物TRAP含量显著减少(P<0.05),提示骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导的骨质吸收紊乱。血清OCN(骨形成标记物)含量在各组间均无显著差异,见表3。
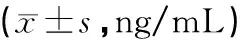
表3 各组血清骨稳态标物OCN和TRAP含量
2.4 各组对CASP3、BAX凋亡相关蛋白表达的影响
结果表明,与空白组比较,模型组凋亡相关蛋白Cl-CASP3(CASP3活化形式)、BAX表达显著增加,差异具有统计学意义(P<0.05),提示长期酒精摄入可增加细胞凋亡水平,诱导骨重构紊乱与细胞凋亡密切相关。与模型组比较,中药组凋亡相关蛋白Cl-CASP3(CASP3活化形式)、BAX表达显著降低,提示骨碎补提取物可在一定程度上拮抗酒精诱导的凋亡活化,见表4、图2。

表4 各组CASP3、BAX凋亡相关蛋白表达情况
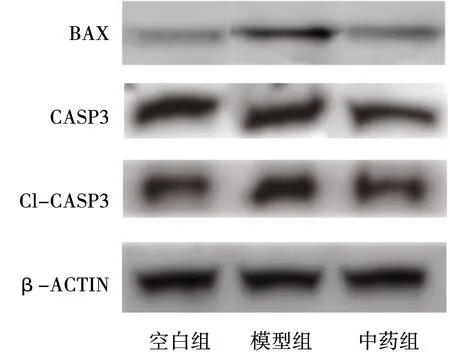
图2 各组CASP3、BAX凋亡相关蛋白表达情况
3 讨论
酒精性骨重构(又称酒精性骨重建、酒精性骨重造、酒精性骨重塑、酒精性骨减少等)是以全身骨质和骨量异常为特征[1],是酒精诱导骨组织细胞异常代谢而导致骨稳态失衡的综合反映(本研究中,酒精诱导的骨代谢紊乱及微观结构异常可见图1和表1、2等),其最终表现为骨髓间充质干细胞、成骨细胞、破骨细胞、骨细胞活性和功能异常,破坏了成骨/破骨生理平衡,是酒精性骨坏死、酒精性骨质疏松症[5]等的共同病理过程。本研究结果表明,骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导破骨水平激活,抑制骨质吸收,一定程度上恢复酒精性骨重构所致骨形成减少、骨吸收增加的骨稳态失衡,平调成骨/破骨动态水平,平衡骨质代谢(见图1和表1等)。前期动物和细胞实验结果表明,酒精对骨重构的影响是多维态的,既可表现为骨微观形态结构异常、骨生物力学性能降低、机体代谢紊乱、氧化 还原失衡和破骨细胞异常活化,又可表现为酒精介导的骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSCs)形态异常、氧化应激增高、自噬改变、凋亡亢进[15]和成骨分化紊乱等[4]。中药单体丹酚酸B可能主要通过调节酒精介导的活性氧(Reactive oxygen species,ROS)增高来缓解BMSCs凋亡,增加细胞活力和促进细胞存活,柚皮苷对BMSCs活力作用不如丹酚酸B显著;柚皮苷可能主要通过促进BMSCs 成骨分化来干预酒精对骨形成的抑制作用,丹酚酸B对酒精性成骨分化抑制亦有一定改善作用,但不如柚皮苷显著,且丹酚酸B对成脂分化的抑制作用亦较柚皮苷弱[4]。补肾活血法可作为防治酒精性骨病的方法之一[6,16]。酒精对骨重构的影响是多维态的,抗氧化、抗凋亡和调节成骨/成脂骨稳态可能是干预酒精性骨重构的有效靶点[3-4]。
接骨木含有粗脂肪、粗蛋白、粗纤维、总糖等主要营养成分和钾、钠、钙、镁、铁等矿质元素以及氨基酸等,营养丰富,各种营养成分较为全面。前期实验我们已经确定了接骨木根皮促进骨折愈合的有效部位及可能活性组分[17]。(7R,8S)-1-(4-hydroxy-3-methoxyphenyl)-2-[4-(3-hydroxypropyl)-2-methoxyphe-noxy]-1,3-propanediol (PPD)是一种从接骨木分离鉴定的具有骨保护作用的化合物,可以在大鼠类成骨UMR 106细胞、前成骨MC3T3-E1细胞以及BMSC细胞的成骨过程的不同阶段发挥类雌激素活性,从而刺激成骨细胞功能。进一步研究表明,PPD可能通过ER配体非依赖性方式激活ERK / MAPK信号通路而在UMR 106细胞中发挥其雌激素作用。淫羊藿苷也曾报道过类似的作用方式调节UMR 106细胞[18]、MC3T3-E1细胞[19]和骨细胞[20]成骨分化。木质素类为接骨木主要组分之一。一些研究报告了木脂素在体内和体外对骨骼的有益作用。从杜仲中提取的总木脂素有效地抑制了卵巢切除术(OVX)诱导的骨质流失,并促进了原代成骨细胞的增殖,分化和骨蛋白原(OPG)表达[21]。芝麻中的主要木脂素芝麻素通过加速成骨细胞基因的表达来刺激成骨细胞成熟而发挥功能[22]。北五味子果实和种子中的木质素增加成骨细胞中碱性磷酸酶的活性[23]。尽管已经证明了一些木脂素对骨骼的合成代谢作用,但两项临床研究表明,亚麻籽中的木脂素在防止更年期妇女骨质流失方面并不有效[24-25]。关于木脂素对酒精性骨骼损伤的作用的报道相对有限,并且亚麻籽中木脂素对骨骼缺乏保护作用可能是由于所使用的木脂素的化学结构不同所致。因此,为了系统地评估木脂素对骨骼的保护作用,并解析接骨木骨骼保护作用的机制需要进一步的实验和临床研究。本研究证实,接骨木提取物对酒精性骨病有积极干预作用,其干预直接可能通过改善骨质代谢、恢复骨稳态和拮抗酒精诱导的细胞凋亡机制有关。
本研究HE染色结果提示长期酒精摄入可导致大鼠骨质和骨量紊乱及髓脂代谢异常,接骨木提取物可在一定程度上拮抗酒精诱导的骨质和骨量代谢异常,可对酒精性骨重构起积极干预作用。骨重构标志物mRNA分析结果表明,长期酒精摄入对骨形成有显著抑制作用,却可激活破骨水平,增加骨质吸收,由此可见,酒精性骨重构表现为骨形成减少、骨吸收增加的骨稳态失衡;骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导破骨水平激活,抑制骨质吸收,一定程度上恢复酒精性骨重构所致骨形成减少、骨吸收增加的骨稳态失衡,平调成骨/破骨动态水平,平衡骨质代谢。IGF-1是一种参与骨骼生长和骨骼合成的关键激素,在酒精性骨重构发生发展中起重要作用[26]。本研究表明乙醇处理引起了血清IGF-1水平的降低,提示骨合成代谢紊乱。Vitamin D作为参与骨结构和骨代谢的重要物质[27],本研究中未观察到酒精摄入导致血清Vitamin D水平显著变化。骨钙素是骨合成的标志物,是成骨细胞分泌的高度丰富的骨蛋白,调节骨骼的重塑和能量代谢,其编码的蛋白质包含一个Gla(γ羧基谷氨酸)结构域,该结构域可与钙和骨骼的矿物质羟磷灰石结合。本研究中未观察到酒精摄入导致血清骨钙素水平显著变化。甲状旁腺激素(parathyroid hormone,PTH)能刺激破骨细胞分泌TRAP;甲状旁腺激素是甲状旁腺主细胞分泌的碱性单链多肽类激素,主要靶向骨和肾脏来调节体内钙和磷的代谢,促使血钙水平升高,血磷水平下降,在骨稳态维持中起重要作用。结果表明,长期酒精摄入可增加TRAP水平,有利骨质吸收;骨碎补提取物可在一定程度上拮抗长期酒精摄入诱导的骨质吸收紊乱。Cl-CASP3(Cleaved caspase-3,为caspase-3活化形式)作为调控细胞凋亡的关键效应分子。酒精增加Cl-CASP3表达,诱导细胞凋亡,研究表明骨组织活化的caspase-3含量与骨密度呈负相关[15],接骨木可能通过拮抗酒精诱导的细胞凋亡来干预酒精性骨重构的发生发展。
本研究表明,接骨木提取物可能是通过拮抗酒精诱导的细胞凋亡亢进、增加血清IGF-1水平和降低TRAP含量,增加骨小梁数目,来恢复酒精性骨稳态失衡,促进骨质形成而抑制骨质吸收,恢复正常骨代谢和维持正常骨稳态以减缓酒精对骨质和骨量的毒副作用,同时为临床防治酒精性骨病提供了参考和依据。
