不同氮质量浓度对凤眼蓝生长和生理指标尤其是氮代谢关键酶活性的影响
2021-12-28张迎颖宋雪飞徐佳兵刘海琴张志勇宋海亮
张迎颖, 宋雪飞, 徐佳兵, 周 庆, 刘海琴, 王 岩, 张志勇,①, 宋海亮
〔1. 江苏省农业科学院农业资源与环境研究所 农业农村部长江下游平原农业环境重点实验室, 江苏 南京 210014;2. 常州市武进区前黄水利(务)站, 江苏 常州 213172; 3. 南京师范大学环境学院, 江苏 南京 210023〕
凤眼蓝〔Eichhorniacrassipes(Mart.) Solms〕,又称凤眼莲、水浮莲、水葫芦,为多年生浮水草本植物,具有适应能力强、生长速率高、氮磷吸收量大等优点,被广泛应用于富营养化湖泊生态修复、黑臭河道生态治理及尾水深度净化等领域[1-3]。研究表明:凤眼蓝能够较好地适应水环境变化,并能较好地发挥吸收和富集水体污染物的能力[4-6],但在不同水环境中,凤眼蓝在形态和生理上存在较大差异[7-9]。
氮是引起水体富营养化的主要因子之一[10-11],也是浮水植物生长发育必不可少的营养元素[12]。在植物的氮同化过程中,核酸和蛋白质以及核苷酸、辅酶、维生素和生物碱等有机物的合成均受到氮素供给的显著制约[13]76。植物吸收的氮主要是无机氮,包括铵态氮和硝态氮。一般情况下,铵态氮可直接被植物吸收,在植物体内合成氨基酸;而硝态氮则需要经过还原过程转化成铵态氮后才能被植物吸收[14]。研究发现,不同形态氮可直接影响水生植物的氮同化过程[15-16],水生植物的氮同化过程又影响其自身的生长发育[17]。与硝态氮相比,凤眼蓝更容易吸收水中的铵态氮[16,18]。但是,氮浓度仅在一定范围内对凤眼蓝的鲜质量有显著影响[19]。开展凤眼蓝对不同氮浓度水体的生理响应研究,可为不同富营养化程度水体修复植物的选择和配置提供参考依据。
鉴于此,本研究以氯化铵(NH4Cl)为氮源,设置了7个氮质量浓度处理组,对不同氮质量浓度水体中凤眼蓝的部分生长指标和生理指标尤其是氮代谢关键酶活性进行了比较,对这些指标与氮质量浓度进行了Pearson相关性分析,并对与氮质量浓度显著相关的指标和全氮含量进行了Z分综合评价,以期探究氮质量浓度变化对凤眼蓝生长发育的影响,为富营养化水体的生态治理提供参考。
1 材料和方法
1.1 材料
供试凤眼蓝植株来自江苏省农业科学院面源污染治理工程技术中心中试基地的人工湿地。
1.2 方法
1.2.1 处理和培养方法 于2020年5月20日至6月9日在江苏省农业科学院面源污染治理工程技术中心中试基地的温室大棚(东经118°52′31.19″、北纬32°01′57.82″)内进行实验,棚顶覆盖透明的聚氯乙烯(PVC)塑料膜。实验期间,日最高气温21 ℃~34 ℃,日最低气温17 ℃~25 ℃,光源为自然光。用自来水预培养1周后,选取长势基本一致的凤眼蓝植株,每株具3或4枚叶,种植于体积10 L的塑料桶中,每桶3株(总质量约180 g)。用1/2 Hoagland营养液进行培养,以NH4Cl为氮源,设置7个氮质量浓度水平,分别为0.0(CK)、0.5、2.5、5.0、10.0、20.0和40.0 mg·L-1,每处理3个重复,每个重复1桶。用自来水配置培养液,每天下午用自来水补充消耗的水分,每3天更换1次培养液,尽量保证各处理的氮质量浓度恒定,并用5 mol·L-1HCl溶液和5 mol·L-1NaOH溶液将培养液酸碱度调至pH 6.8至pH 7.0。
1.2.2 指标测定 实验开始时,选取3株与实验植株长势基本一致的凤眼蓝植株,使用JJ1000型电子天平(精度0.01 g,常熟市双杰测试仪器厂)称量单株鲜质量,结果取平均值;将3株植株分别置于不同纸袋中,经105 ℃杀青30 min后,于75 ℃烘干至恒质量,称量单株干质量,结果取平均值。将干燥样品粉碎,取0.3~0.5 g干燥粉末,使用AL104型电子天平〔精度0.000 1 g,梅特勒-托利多仪器(上海)有限公司〕精确称量,采用硫酸-混合加速剂-蒸馏法[20]308-309测定全氮含量,采用硫酸高氯酸消煮钼锑抗比色法[20]313-314测定全磷含量,重复测定3次。
实验结束时,使用SPAD-502 plus叶绿素计(日本Konica Minolta公司)测定植株自上而下第3至第5位叶片的叶绿素相对含量(SPAD)。使用米尺(精度0.1 cm)测量株高(植株茎部底端至最高处叶片顶端的长度)和根长(根部顶端至主根末端的长度)。随后,先用自来水冲洗全株,再用蒸馏水洗净,用吸水纸吸干植株表面水分,使用JJ1000型电子天平称量每桶3株样株的总鲜质量,计算单株鲜质量;每处理随机选取1株样株,采用上述方法烘干后,使用JJ1000型电子天平称量单株干质量。采用上述方法分别测定干燥粉末的全氮和全磷含量,重复测定3次。
选取样株自上而下第3至第5位长势较为一致的叶片(颜色深浅一致,长约5.5~6.5 cm)12~15枚,用液氮快速研磨成粉末,置于-80 ℃冰箱中保存、备用。使用苏州科铭生物技术有限公司生产的试剂盒,测定叶片蛋白质含量和氮代谢关键酶活性。其中,蛋白质含量测定使用考马斯亮蓝法蛋白质含量测试盒(型号KMSP-2-W),谷氨酸脱氢酶活性测定使用谷氨酸脱氢酶测试盒(型号GDH-2-Y),硝酸还原酶活性测定使用硝酸还原酶测试盒(型号NR-2-W),亚硝酸还原酶活性测定使用亚硝酸还原酶测试盒(型号NIR-2-G),谷氨酰胺合成酶活性测定使用谷氨酰胺合成酶测试盒(型号GS-2-Y),谷氨酸合成酶活性测定使用谷氨酸合成酶测试盒(型号GOGAT-2-Y)。每个指标重复测定3次。
1.3 数据处理及统计分析
利用EXCEL 2016和SPSS 16.0软件进行数据处理和统计分析,对各指标进行单因素方差分析(one-way ANOVA)和多重比较(LSD法和Duncan’s法),并对各指标与氮质量浓度进行Pearson相关性分析。
参照相关文献[21]计算各处理组凤眼蓝植株的氮增加量(mN)和磷增加量(mP),计算公式分别为mN=(mCN-m0CN0)×14×10-3和mP=(mCP-m0CP0)×31×10-3。式中,m0和m分别为实验开始和结束时处理组3株样株的总干质量,CN0和CN分别为实验开始和结束时干燥样株的全氮含量,CP0和CP分别为实验开始和结束时干燥样株的全磷含量。

2 结果和分析
2.1 不同氮质量浓度对凤眼蓝植株生长指标的影响
统计结果(表1)表明:随着氮质量浓度提高,株高先升高后降低,氮质量浓度10.0 mg·L-1处理组的植株最高(19.13 cm);根长总体上逐渐下降,氮质量浓度40.0 mg·L-1处理组的根最短(22.23 cm)。单株鲜质量和单株干质量总体上先升高后趋于稳定,氮质量浓度5.0、20.0和40.0 mg·L-1处理组的单株鲜质量较高,10.0、20.0和40.0 mg·L-1处理组的单株干质量较高。
多重比较分析结果(表1)表明:各处理组间的株高差异不显著,但均显著高于对照组(氮质量浓度0.0 mg·L-1)。氮质量浓度0.5和5.0 mg·L-1处理组的根长略低于对照组,其他处理组的根长显著低于对照组。氮质量浓度0.5和2.5 mg·L-1处理组的单株鲜质量略高于对照组,其他处理组的单株鲜质量显著高于对照组,但各处理组间差异不显著。氮质量浓度0.5、2.5和5.0 mg·L-1处理组的单株干质量略高于对照组,其他处理组的单株干质量显著高于对照组,但各处理组间差异不显著。
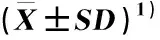
表1 不同氮质量浓度对凤眼蓝生长指标的影响
2.2 不同氮质量浓度对凤眼蓝叶片生理指标的影响
2.2.1 对叶绿素相对含量(SPAD)和蛋白质含量的影响 统计结果(表2)表明:随着氮质量浓度提高,SPAD值逐渐升高,蛋白质含量总体上也逐渐升高,并且,氮质量浓度40.0 mg·L-1处理组的SPAD值和蛋白质含量均最高,分别为53.47和0.23 mg·g-1。
多重比较分析结果(表2)表明:各处理组的SPAD值和蛋白质含量均显著高于对照组(氮质量浓度0.0 mg·L-1)。氮质量浓度0.5和2.5 mg·L-1处理组间以及氮质量浓度20.0 mg·L-1处理组与10.0和40.0 mg·L-1处理组间的SPAD值均差异不显著,但其他处理组间的SPAD值差异显著。氮质量浓度40.0 mg·L-1处理组的蛋白质含量显著高于其他处理组;氮质量浓度0.5、2.5、5.0、10.0和20.0 mg·L-1处理组间的蛋白质含量大多差异不显著,但氮质量浓度2.5、5.0和20.0 mg·L-1处理组的蛋白质含量显著高于氮质量浓度0.5 mg·L-1处理组。
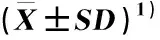
表2 不同氮质量浓度对凤眼蓝叶片叶绿素相对含量(SPAD)、蛋白质含量及氮代谢关键酶活性的影响
2.2.2 对氮代谢关键酶活性的影响 统计结果(表2)表明:随着氮质量浓度提高,谷氨酸脱氢酶活性呈波动变化趋势,以氮质量浓度2.5 mg·L-1处理组的谷氨酸脱氢酶活性最高(53.23 μmol·h-1·mg-1),且显著高于其他处理组。与对照组相比,氮质量浓度0.5、10.0和40.0 mg·L-1处理组的谷氨酸脱氢酶活性显著降低,氮质量浓度2.5 mg·L-1处理组的谷氨酸脱氢酶活性显著升高,氮质量浓度5.0和20.0 mg·L-1处理组的谷氨酸脱氢酶活性略降低。
随着氮质量浓度提高,硝酸还原酶活性总体上先升高后降低,以氮质量浓度2.5 mg·L-1处理组的硝酸还原酶活性最高(0.32 μmol·h-1·mg-1),且显著高于其他处理组。与对照组相比,氮质量浓度0.5和5.0 mg·L-1处理组的硝酸还原酶活性略降低,氮质量浓度2.5 mg·L-1处理组的硝酸还原酶活性显著升高,氮质量浓度10.0、20.0和40.0 mg·L-1处理组的硝酸还原酶活性显著降低。
随着氮质量浓度提高,亚硝酸还原酶活性总体上也先升高后降低,以氮质量浓度2.5 mg·L-1处理组的亚硝酸还原酶活性最高(37.34 μmol·h-1·mg-1),且显著高于其他处理组(氮质量浓度0.5 mg·L-1处理组除外)。与对照组相比,氮质量浓度0.5 mg·L-1处理组的亚硝酸还原酶活性略升高,氮质量浓度2.5 mg·L-1处理组的亚硝酸还原酶活性显著升高,氮质量浓度5.0 mg·L-1处理组的亚硝酸还原酶活性略降低,氮质量浓度10.0、20.0和40.0 mg·L-1处理组的亚硝酸还原酶活性显著降低。
随着氮质量浓度提高,谷氨酰胺合成酶活性总体上逐渐升高,但存在明显波动,以氮质量浓度40.0 mg·L-1处理组的谷氨酰胺合成酶活性最高(33.61 μmol·h-1·mg-1),且显著高于其他处理组。与对照组相比,氮质量浓度0.5 mg·L-1处理组的谷氨酰胺合成酶活性略降低,氮质量浓度2.5和10.0 mg·L-1处理组的谷氨酰胺合成酶活性略升高,氮质量浓度5.0、20.0和40.0 mg·L-1处理组的谷氨酰胺合成酶活性显著升高。
随着氮质量浓度提高,谷氨酸合成酶活性呈波动变化趋势。对照组的谷氨酸合成酶活性最高(37.04 μmol·h-1·mg-1),而各处理组的谷氨酸合成酶活性总体上较低(4.90~33.02 μmol·h-1·mg-1)。各处理组中,氮质量浓度0.5 mg·L-1处理组的谷氨酸合成酶活性最高,氮质量浓度5.0 mg·L-1处理组的谷氨酸合成酶活性次之(15.64 μmol·h-1·mg-1)。并且,各处理组的谷氨酸合成酶活性显著低于对照组。
2.3 不同氮质量浓度对凤眼蓝氮和磷吸收的影响
统计结果(表3)表明:随着氮质量浓度提高,全氮含量和氮增加量总体上先升高后降低,氮质量浓度5.0 mg·L-1处理组的全氮含量和氮增加量均最高,分别为4.41 mmol·g-1和1.90 g;全磷含量和磷增加量总体上先逐渐升高后趋于稳定。与对照组(氮质量浓度0.0 mg·L-1)相比,氮质量浓度0.5、2.5和20.0mg·L-1处理组的全氮含量略升高,其余3个处理组的全氮含量显著升高,且3组间差异显著;除氮质量浓度0.5 mg·L-1处理组外,其他处理组的全磷含量均略升高,且各组间差异不显著。比较而言,氮质量浓度5.0和10.0 mg·L-1处理组的氮增加量较高,而氮质量浓度0.5和2.5 mg·L-1处理组的氮增加量较低。

表3 不同氮质量浓度对凤眼蓝氮和磷吸收的影响1)
2.4 凤眼蓝生长和生理指标与氮质量浓度的相关性
上述指标与氮质量浓度的Pearson相关性分析结果见表4。由表4可见:根长与氮质量浓度极显著(p<0.01)负相关,硝酸还原酶活性和亚硝酸还原酶活性与氮质量浓度显著(p<0.05)负相关,单株干质量、叶绿素相对含量和谷氨酰胺合成酶活性与氮质量浓度显著正相关,蛋白质含量与氮质量浓度极显著正相关,其他指标与氮质量浓度的相关性均不显著。
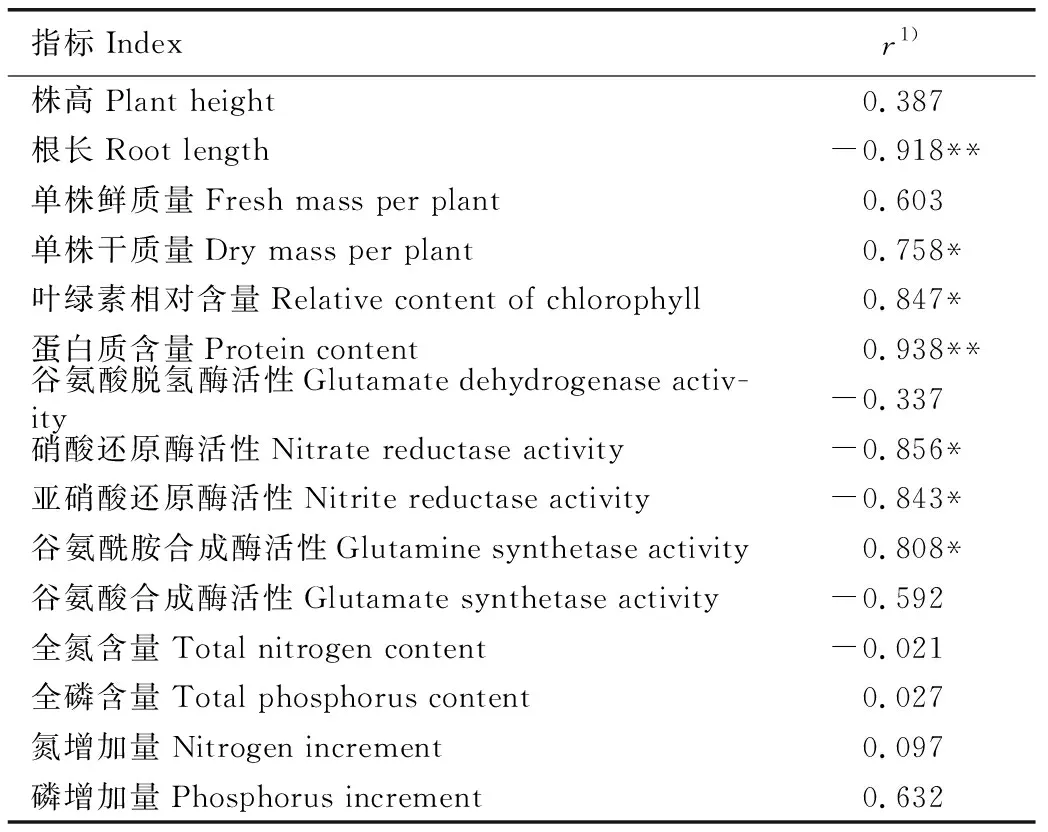
表4 凤眼蓝各生长和生理指标与氮质量浓度的Pearson相关性分析
2.5 氮质量浓度对凤眼蓝影响的综合评价
对与氮质量浓度显著相关的指标和全氮含量进行Z分综合评价,结果见表5。由表5可见:单株干质量、叶绿素相对含量、蛋白质含量、硝酸还原酶活性、亚硝酸还原酶活性、谷氨酰胺合成酶活性和全氮含量为“高优”指标,根长为“低优”指标。氮质量浓度5.0~40.0 mg·L-1处理组相关指标综合评价值的总和(∑Zi)为正值,其中,氮质量浓度40.0 mg·L-1处理组的∑Zi值最高,达4.91;氮质量浓度5.0和10.0 mg·L-1处理组的∑Zi值较高,分别为2.55和1.29。
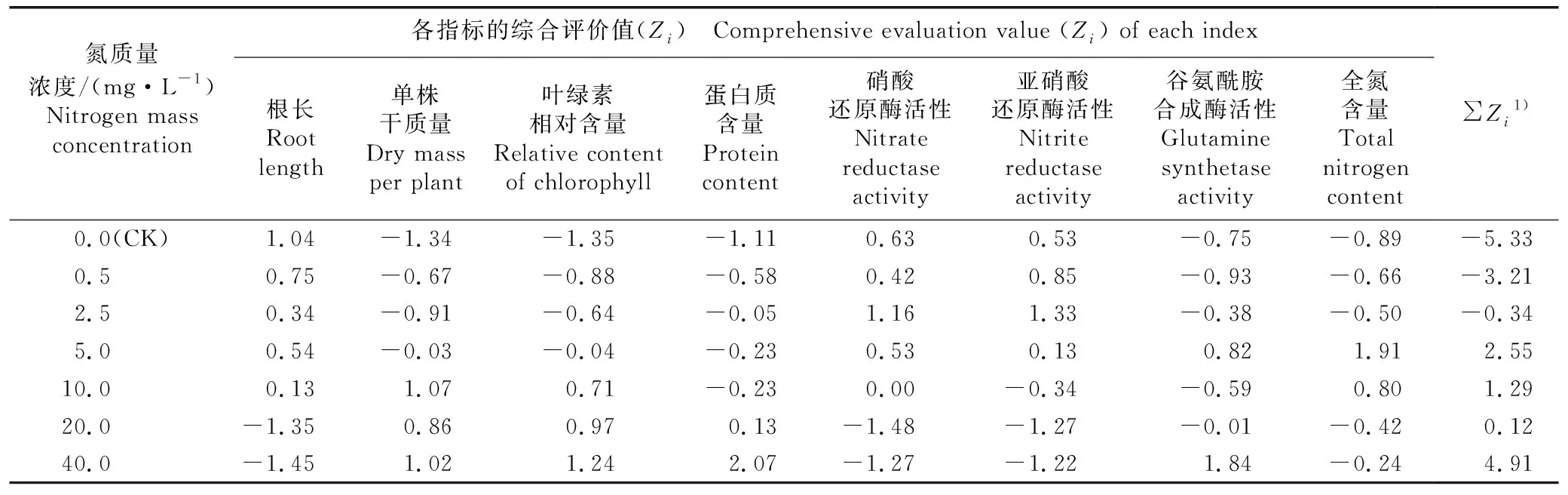
表5 不同氮质量浓度处理组凤眼蓝各指标的Z分综合评价结果
3 讨论和结论
研究发现,当水体氮质量浓度低于5.5 mg·L-1时,凤眼蓝的净生长率随氮供给率升高而增大,但当氮供给率超过5.5 mg·L-1后,凤眼蓝的净生长率则不会随着氮供给率升高而继续增大[23]。本研究也得到类似的结果:在一定氮质量浓度范围(0.0~5.0 mg·L-1)内,随着氮质量浓度提高,凤眼蓝的株高和单株鲜质量均逐渐升高,氮质量浓度在10.0 mg·L-1及以上时,凤眼蓝的株高和单株鲜质量变化不显著。另外,随着氮质量浓度提高,凤眼蓝的根长逐渐降低。究其原因,在低营养条件下,凤眼蓝根系快速生长,形成较大的根表面积,使根部接触到更多的外界环境,从而吸收到更多的营养物质,满足植株和根系生长需求[24]。相关性分析结果表明:凤眼蓝的根长与氮质量浓度呈极显著(p<0.01)负相关,单株干质量与氮质量浓度呈显著(p<0.05)正相关,说明随着水体中氮浓度的提高,凤眼蓝的根长趋于短小,而其植株的干物质积累量逐渐升高。
叶绿素相对含量和蛋白质含量是衡量植物生长发育状况的重要指标[25-26]。随着氮质量浓度提高,凤眼蓝的叶绿素相对含量逐渐升高,蛋白质含量也基本上逐渐升高,相关性分析也得到类似结果,且这2个指标与氮质量浓度分别呈显著和极显著正相关,说明增加水体中的氮浓度有助于提高凤眼蓝叶片的叶绿素和蛋白质含量。
通常情况下,硝酸还原酶可直接调节硝酸盐的还原过程,进而调节氮代谢,影响植物光合作用[27-28];亚硝酸还原酶则可将亚硝酸盐还原为NO或NH3,降低环境中亚硝态氮的积累,以减轻其对植物体的毒害[13]98。硝酸还原酶为诱导酶,一般在硝酸盐诱导下形成[13]97。总体来看,在低氮质量浓度(5.0 mg·L-1及以下)条件下,凤眼蓝叶片的硝酸还原酶活性处于较高水平,但当氮质量浓度在20.0 mg·L-1及以上时,硝酸还原酶活性却显著降低,说明水体中低浓度的硝态氮可诱导凤眼蓝体内硝酸还原酶的活性,但高浓度的铵离子却抑制了硝酸还原酶的活性。同样地,亚硝酸还原酶活性也表现出与硝酸还原酶活性相同的变化规律。相关性分析结果表明:凤眼蓝叶片的硝酸还原酶和亚硝酸还原酶活性与氮质量浓度均呈显著负相关,说明随着水体中氮浓度的提高,凤眼蓝叶片的硝酸还原酶和亚硝酸还原酶活性逐渐变弱。值得注意的是,本研究以NH4Cl为氮源,但实验使用的自来水中含有少量的硝态氮(0.30~1.70 mg·L-1),在静置多日后仍可检出亚硝态氮,这可能是凤眼蓝叶片中检出硝酸还原酶和亚硝酸还原酶的主要原因。鉴于上述结果,若要明确不同形态氮素对凤眼蓝叶片硝酸还原酶和亚硝酸还原酶活性的影响规律,需开展单独硝态氮或单独铵态氮的对比实验。
谷氨酰胺合成酶活性提高可带动植物氮代谢过程增强,削弱铵离子浓度过高对植物造成的毒害作用,促进氨基酸的合成与转化[29-30]。不同形态氮素均能够提高植物体内的谷氨酰胺合成酶活性,并以铵态氮的影响更为明显,究其原因在于铵态氮是谷氨酰胺合成酶的底物,可直接促进谷氨酰胺合成酶活性提高[31]。本研究中,随着氮质量浓度提高,凤眼蓝叶片的谷氨酰胺合成酶活性总体上逐渐升高,但存在明显波动,并且凤眼蓝叶片的谷氨酰胺合成酶活性与氮质量浓度呈显著正相关,说明增加水体中氮浓度有助于增强凤眼蓝体内的谷氨酰胺合成酶活性。谷氨酸合成酶主要催化谷氨酰胺与α-酮戊二酸合成谷氨酸。在高等植物体内,铵离子的同化离不开谷氨酰胺合成酶和谷氨酸合成酶的协同催化作用,二者组成的谷氨酰胺合成酶/谷氨酸合成酶(GS/GOGAT)循环系统,在植物固氮过程中发挥着关键作用[32-33]。高等植物在光呼吸、氨基酸代谢、固氮等过程产生的铵离子有95%以上通过GS/GOGAT循环系统完成同化过程[34]。在本研究氮质量浓度范围内,凤眼蓝叶片的谷氨酸合成酶活性总体上较低,并且未表现出与谷氨酰胺合成酶活性相同或相似的变化规律,这可能与凤眼蓝体内2种酶的分泌不同步有关。值得注意的是,在氮质量浓度0.0和0.5 mg·L-1条件下,凤眼蓝叶片的谷氨酸合成酶活性相对较高,这可能与凤眼蓝在低氮浓度条件下的应激反应有关。
谷氨酸脱氢酶既能催化铵离子与α-酮戊二酸合成谷氨酸,又能在催化谷氨酸氧化的同时释放铵离子[35-36]。当生境中无机氮水平较高时,植物体内的谷氨酸脱氢酶行使铵同化功能;当生境中缺少有机碳时,植物体内的谷氨酸脱氢酶主要促进谷氨酸分解,并为三羧酸循环提供碳骨架[37]。比较而言,凤眼蓝的谷氨酸脱氢酶活性在氮质量浓度0.0~5.0 mg·L-1条件下较高(均值为24.38 μmol·h-1·mg-1),但在氮质量浓度10.0~40.0 mg·L-1条件下却较低(均值为10.54 μmol·h-1·mg-1)。说明在低氮浓度条件下,凤眼蓝体内的谷氨酸脱氢酶在铵同化过程中发挥作用;氮浓度提高,凤眼蓝叶片的谷氨酰胺合成酶活性显著升高,优先参与铵同化过程,在一定程度上抑制了谷氨酸脱氢酶的活性。
Reddy等[23]认为,凤眼蓝植株体内氮含量随氮素水平提高而持续升高。本研究结果与之存在较大差异,表现为在氮质量浓度0.0~5.0 mg·L-1范围内,凤眼蓝的全氮含量随着氮质量浓度的提高而升高,但当氮质量浓度高于5.0 mg·L-1时,凤眼蓝的全氮含量一直维持在一定水平。这种差异可能是因为2个实验使用的容器体积差异较大,凤眼蓝初始投放量的差异也较大,导致植株对氮的吸收和储存能力差异较大。然而,各处理组凤眼蓝的全磷含量无显著差异,且全磷含量与氮质量浓度的相关性不显著,说明氮质量浓度变化对凤眼蓝的全磷含量无显著影响。各处理组凤眼蓝的氮增加量和磷增加量也表现出相似的规律。总体来看,氮质量浓度5.0和10.0 mg·L-1处理组凤眼蓝的氮增加量分别位于第1和第2位。值得注意的是,本研究中对照组凤眼蓝的叶片由实验初期的深绿色,逐渐变为浅绿色,之后叶片外围逐渐发黄直至枯死,表现出明显的缺氮症状。
综合所有研究结果,水体中氮质量浓度为5.0~40.0 mg·L-1较适合凤眼蓝的生长发育,尤其是5.0~10.0 mg·L-1,既能保证凤眼蓝正常生长,又能充分发挥植株的氮吸收能力。
