KIF5B过表达和干扰慢病毒载体的构建及对结直肠癌细胞增殖的影响
2021-12-28刘晶晶范国庆曾律滔刘媛媛蔡剑平黄建东
霍 达 刘晶晶 范国庆 曾律滔 刘媛媛 蔡剑平 黄建东 崔 菊
细胞内物质运输是细胞中重要的生物学过程,涵盖了细胞内多种物质,包括蛋白质、细胞器以及染色体等的细胞定位,因而对细胞内的多种生理活动具有重要的调节作用。驱动蛋白作为马达蛋白的一种,参与并负责细胞内沿微管的物质运输,在有丝分裂期间调控染色体的运动,故而调节细胞的正常生长及增殖[1~3]。KIF5B是驱动蛋白家族kinesin-1的成员,主要负责胞质中沿微管的物质运输,与神经细胞中的轴突运输相关,在有丝分裂期间可通过BICD2蛋白依赖的方式拮抗动力蛋白并调控胞核与中心体的分离[4~6]。近年来研究发现,KIF5B可能不单单只是起着物质运输的作用,在犬肾上皮连续细胞系(madin-daby canine kidney cells,MDCK)细胞中KIF5B的敲低可诱发上皮间充质转化(epithelial-mesenchymal transition,EMT),乳腺癌中的研究也证明KIF5B能够影响癌细胞的EMT[7,8]。而EMT能够赋予上皮细胞来源的恶性肿瘤细胞迁徙和转移的能力,临床表现为原发灶的癌扩散成为转移灶,使得治疗难度大大增加[9~11]。
结直肠癌是临床常见的恶性肿瘤之一,病死率较高,通常因为癌转移与癌细胞耐药性使得患者预后较差[12]。鉴于KIF5B在MDCK细胞和乳腺癌细胞EMT过程的作用,笔者推测KIF5B对于结直肠癌细胞的侵袭转移能力有重要影响,因此本研究拟通过慢病毒转染技术来建立KIF5B沉默与KIF5B过表达的结直肠癌细胞系,检测KIF5B对结直肠癌细胞增殖的影响,为后续研究KIF5B对于结直肠癌细胞EMT过程的调控奠定基础。
材料与方法
1.实验细胞:HCT116细胞株,使用培养基为IMDM培养基(+10%FBS)。SW480细胞株,使用培养基为IMDM培养基(+10%FBS)。293T细胞株,使用培养基为DMEM培养基(+10%FBS)。LOVO细胞,使用培养基为F12K培养基(+10%FBS)。细胞分组情况如下:①正常组细胞:未经转染的正常结直肠癌细胞;②对照组细胞:转染了阴性对照载体的结直肠癌细胞;③sh1组细胞: 转染了携带有KIF5B-sh1的慢病毒的结直肠癌细胞;④sh2组细胞: 转染了携带有KIF5B-sh2的慢病毒的结直肠癌细胞;⑤过表达组细胞: 转染了过表达KIF5B载体的结直肠癌细胞。
2.主要试剂:IMDM培养基,DMEM培养基与F12K培养基为Hyclone产品;慢病毒载体(GV358和GV112)、辅助质粒(Helper1.0和Helper2.0)和感受态细胞购自上海吉凯基因化学技术有限公司;胎牛血清购自美国Thermo Fisher Scientific公司;KIF5B兔抗人单克隆抗体为本实验室自制;tubulin与actin抗体,HRP标记山羊抗兔二抗皆购自北京康为世纪科技有限公司;嘌呤霉素购自美国Sigma-Aldrich公司;质粒提取试剂盒和胶回收纯化试剂盒购自天根生化科技(北京)有限公司;限制性核酸内切酶购自New England Biolabs公司(北京);DNA聚合酶购自日本TaKaRa公司;T4 DNA连接酶购自美国Thermo Fisher Scientific公司;CCK-8试剂购自上海碧云天生物技术有限公司。
3.细胞培养与传代:复苏的结直肠癌细胞1000r/min离心5min后去除冻存液,加10ml完全培养基重悬培养于CO2培养箱37℃培养,约2天传代。
4.慢病毒载体的构建:(1)shRNA的合成:根据人源KIF5B基因设计两段siRNA序列5′-GCTCAACAGATGGCGTAAT-3′与5′-GAAGGGATCAAGACAATAT-3′,其阴性对照病毒序列为5′-TTCTCCGAACGTGTCACGT-3′,根据siRNA序列分别合成6条shRNA寡核苷酸单链,具体序列详见表1。将成对的引物干粉溶解于退火缓冲液中,90℃水浴15min后冷却至室温得到配对的shRNA。(2)人KIF5B基因(NM_004521)扩增:通过PCR引物KIF5B(20820-3)-P1:5′-GAGGATCCCCGG-GTACCGGTCGCCACC-ATGGCGGACCTGGCCGAGTGC-AAC-3′和引物KIF5B(20820-3)-P2:5′-TCCTTGT-AGTCCATACCCACTTGTTTGCCTCCTCCACCTCGC-3′扩增人KIF5B基因。(3)载体构建与测序:将(1)中的退火产物(或酶切后的PCR产物)与线性化载体按照体系连接,或于冰水浴中配置(2)中PCR产物与载体的交换体系,用所得连接产物(或交换反应产物)转化感受态大肠杆菌后氨苄西林药筛培养,挑取单菌落进行PCR鉴定,对阳性克隆培养后取菌液测序。

表1 合成的KIF5B基因shRNA寡核苷酸单链信息
5.病毒包装与检测:(1)质粒转染与病毒收获 293T细胞以合适丰度铺板贴壁,无血清培养2h后加入三质粒转染液(包括GV载体质粒20μg、pHelper 1.0载体质粒15μg、pHelper 2.0载体质粒10μg以及相应体积的吉凯转染试剂),轻柔混匀,6h后换完全培养基继续培养2~3天,收集上清,离心后再以0.45μm滤器过滤上清液,超速离心去除上清,加入病毒保存液轻柔重悬,溶解后10000r/min高速离心5min,取上清按要求分装保存。(2)效价分析:取梯度稀释的病毒溶液感染96孔板中的293T细胞,培养箱培养24h后,换完全培养基继续培养,感染后72h加入抗性药物嘌呤霉素,维持药物浓度5μg/ml继续培养1天,通过感染后的活细胞数量来计算病毒效价,病毒效价=活细胞数/病毒原液量。
6.细胞转染:2.5%胰酶消化细胞,用含血清的培养基终止消化,1000r/min离心5min后弃上清,用完全培养基稀释到(1~5)×105个/毫升并铺板于6孔板中,并按照比例加入慢病毒与慢病毒感染增强液,于CO2培养箱37℃培养,12~16h后弃去旧培养基并加入不含病毒的新培养基继续培养,36~54h后加入嘌呤霉素至终浓度为2μg/ml,继续培养至少5天以筛选稳转株。
7.Western blot法检测:胰酶消化1500r/min离心1min收集细胞,用PBS洗1遍后取细胞沉淀,加入RIPA裂解液重悬细胞沉淀,冰上放置30min裂解细胞,期间可涡旋震荡促进细胞裂解,12000×g离心20min后取上清,BCA法测浓度后加入上样缓冲液混匀后100℃加热变性10min。取20μg总蛋白进行SDS-PAGE电泳,80mV恒压10~20min待条带进入分离胶后转120mV恒压至条带接近制胶板下缘停止电泳,取出胶260mA恒流转膜150min将蛋白转至PVDF膜上,5%脱脂奶粉(TBST配置)中封闭1.0~1.5h,裁剪目的条带加一抗4℃孵育过夜,TBST洗后加二抗室温孵育1h,TBST洗后显影观察。
8.CCK-8实验:取对数生长期细胞胰酶消化后1500r/min离心1min收集细胞,用PBS洗1遍后重悬于新鲜培养基中,细胞计数后稀释细胞浓度为2×104个/毫升,细胞悬液混匀后每孔100μl加入96孔板中,每组6个复孔,37℃培养箱培养,每隔一段时间取出1个96孔板弃旧培养基,加入100μl新培养基(混有10μl的CCK-8试剂),放回37℃培养箱孵育2h,检测450nm和620nm处的吸光度(A)值。
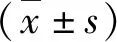
结 果
1.KIF5B-GV358载体的鉴定:经AgeⅠ酶切的GV-358质粒与扩增得到的人KIF5B基因进行同源重组,得到KIF5B-GV358重组质粒。PCR鉴定重组质粒,进行电泳可见1040bp大小的产物(图1)。

图1 琼脂糖凝胶电泳鉴定KIF5B过表达载体1.阴性对照(ddH2O);2.阴性对照(空白载体自连对照组);3.阳性对照(GAPDH);4.marker蛋白;5~12.1~8号转化子
2.shKIF5B-GV112载体的鉴定:将AgeⅠ与EcoRⅠ酶切后的GV112载体与含有AgeⅠ与EcoRⅠ酶识别序列的干扰片段连接得到shKIF5B-GV112重组载体。转化后挑选阳性克隆送测序,KIF5B-sh1与KIF5B-sh2的测序结果如图2所示。
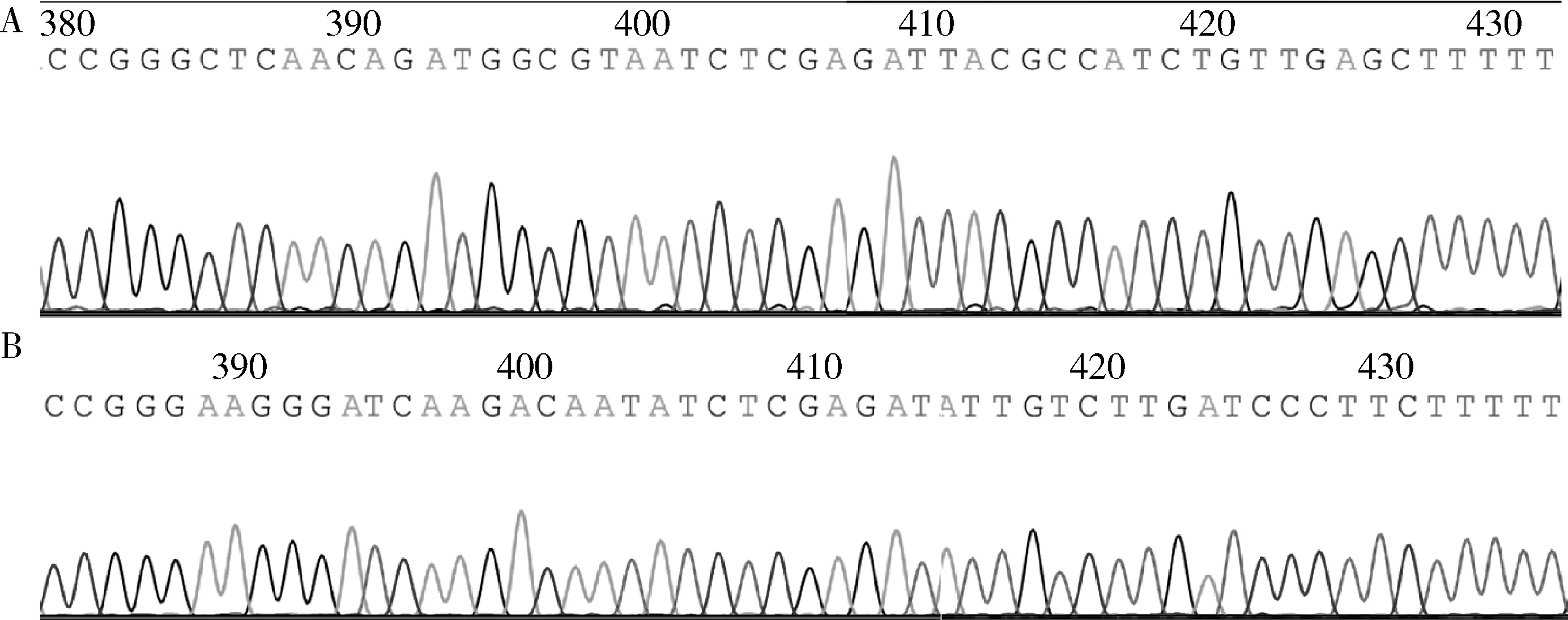
图2 测序结果A.KIF5B-sh1测序峰图;B.KIF5B-sh2测序峰图
3.KIF5B-GV358载体表达情况:KIF5B-GV358重组质粒转染293T细胞,在荧光显微镜下观察,能检测到绿色荧光(图3),证明转染成功。

图3 荧光显微镜下鉴定KIF5B-GV358质粒(×100)A.明场视野;B.绿色荧光视野
4.慢病毒效价:过表达重组质粒与干扰质粒分别转染293T细胞进行嘌呤霉素药筛,确定包装的慢病毒效价结果如表2所示。

表2 慢病毒效价
5.KIF5B蛋白表达水平检测:将KIF5B干扰慢病毒转入HCT116细胞与SW480细胞中,KIF5B过表达慢病毒转入LOVO细胞,经过嘌呤霉素筛选分别得到稳转株后,收集细胞提取总蛋白进行Western blot法检测3种细胞内KIF5B表达水平,结果如图4所示,对Western blot法检测结果用Image J软件计算灰度值后得到KIF5B蛋白相对表达量如图5所示。在HCT116细胞中,对照组、sh1组和sh2组的KIF5B蛋白相对表达量分别为0.52±0.04、0.35±0.05和0.24±0.05;在SW480细胞中,对照组、sh1组和sh2组的KIF5B蛋白相对表达量分别为0.42±0.04、0.071±0.06和0.24±0.03;在LOVO细胞中,对照组和过表达组的KIF5B蛋白相对表达量分别为0.38±0.07和0.57±0.04。

图4 KIF5B干扰(A)与过表达(B)慢病毒分别转染3种不同结直肠癌细胞后的Western blot法检测结果

图5 KIF5B干扰与过表达慢病毒分别转染3种不同结直肠癌细胞的效率A.HCT116细胞;B.SW480细胞;C.LOVO细胞
6.KIF5B表达水平降低后对结直肠癌细胞生长的影响:对稳定转染KIF5B干扰慢病毒的HCT116与SW480细胞进行CCK-8检测,结果如图6所示。在HCT116细胞中,30h后对照组的相对A值(0.32±0.02)要低于sh1组(0.37±0.01);在SW480细胞中,52h后对照组的相对A值(0.28±0.02)要低于sh1组(0.36±0.06),差异有统计学意义(P<0.05)。

图6 KIF5B干扰后对HCT116(A)与SW480(B)细胞增殖的影响与对照组比较,*P<0.05
7.KIF5B表达水平降低后对结直肠癌细胞内细胞周期相关蛋白的影响:检测稳定转染KIF5B干扰慢病毒的HCT116与SW480细胞内细胞周期相关蛋白的表达。对照组HCT116细胞和sh1组HCT116细胞的p21蛋白的相对表达量分别为0.60±0.02和0.52±0.03,p16蛋白的相对表达量分别为0.69±0.02和0.42±0.03,cyclin A2蛋白的相对表达量分别为0.60±0.05和0.57±0.06;对照组SW480细胞和sh1组SW480细胞的p21蛋白的相对表达量分别为0.62± 0.03和0.44±0.04,p16蛋白的相对表达量分别为0.92±0.04和0.71±0.06,cyclin A2蛋白的相对表达量分别为0.42±0.03和0.43±0.02。这表明敲低KIF5B后,HCT116与SW480细胞内p21与p16蛋白表达量降低,差异有统计学意义,而cyclin A2表达几乎无变化,详见图7。

图7 KIF5B干扰后HCT116与SW480细胞内p21、p16、cyclin A2等蛋白表达水平的变化A.Western blot法检测结果;B.蛋白相对表达量
讨 论
结直肠癌作为常见的恶性肿瘤之一,截至2020年其发生率已位居全球第3位,病死率在所有恶性肿瘤中位居第2位,成为了公共健康领域亟需解决的重大问题[13]。临床治疗中,癌细胞的转移与耐药性是结直肠癌预后差的重要原因。因此,有效预防及避免癌细胞的转移和寻找新的药物靶点是治疗结直肠癌的主要思路。
驱动蛋白是一类马达蛋白,负责细胞内沿微管的物质运输,参与到细胞内功能蛋白的定位、染色质的分离以及线粒体等细胞器的分布,对于细胞的生长增殖具有十分重要的作用[14~17]。驱动蛋白以其结构而划分为kinesin-1~kinesin-14等14个亚家族,其中kinesin-1家族由具有典型驱动蛋白结构的KIF5、KIF5B与KIF5C组成[18]。在MDCK细胞系中的研究发现KIF5B与E-cadherin蛋白有相互作用,敲低KIF5B会降低E-cadherin的表达,增加N-cadherin的表达,引发EMT。另外在乳腺癌中的研究,Moamer等研究发现KIF5B通过调节转录因子SNAIL蛋白的核聚集来调控E-cadherin蛋白的表达,进而影响乳腺癌细胞的EMT。而KIF5B对结直肠癌进展的研究却十分缺乏,因此,本研究通过慢病毒转染技术来建立KIF5B沉默与KIF5B过表达的结直肠癌细胞模型,来为今后研究KIF5B在结直肠癌中的作用奠定基础。
本实验成功构建了KIF5B沉默载体和KIF5B过表达载体,并成功转染了3种不同的结直肠癌细胞株。另外,通过Western blot法检测可以发现不同的RNAi序列对同种细胞、同种RNAi序列对不同细胞的沉默效率都不尽相同,因此需要通过基因序列分析、生信分析等手段寻找最佳沉默序列。接着在构建了稳转KIF5B沉默载体的HCT116与SW480细胞系后,笔者用CCK-8实验检测发现KIF5B表达量降低导致这两种结直肠癌细胞增殖加快,又检测到p21与p16蛋白的表达水平随KIF5B沉默而下降。p16蛋白与周期素依赖激酶(cyclin-dependent kinase,CDK)CDK4和CDK6相互作用,并作为细胞增殖的负调节因子发挥作用,p21蛋白同样参与到细胞周期的调控中并负向调节细胞增殖,在多种肿瘤细胞中表达异常[19~21]。亦有研究表明,p21与p16蛋白的表达可能与结直肠癌进展息息相关,因而笔者推测沉默KIF5B会降低p21和p16蛋白两种细胞周期负调控蛋白的表达,加速结直肠癌细胞周期,从而促进癌细胞增殖,但其具体调节机制仍需开展进一步研究[22,23]。在今后的实验中,笔者将继续利用构建好的KIF5B干扰与过表达载体研究KIF5B对结直肠癌细胞生长、凋亡与转移的作用,为结直肠癌的临床治疗提供新的思路。
