胰腺导管内乳头状黏液性肿瘤MRI影像特征及恶变风险预测模型建立
2021-12-27方旭李晶王铁功李娜孟英豪冯小晨边云邵成伟陆建平王莉
方旭 李晶 王铁功 李娜 孟英豪 冯小晨 边云 邵成伟 陆建平 王莉
海军军医大学第一附属医院放射诊断科,上海 200433
随着影像学技术的发展和广泛应用,胰腺囊性肿瘤的检出率逐渐增高。胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm, IPMN)是最常见的胰腺囊性肿瘤,属于胰腺癌的癌前病变[1-2]。在手术治疗的IPMN患者中,主胰管型及混合胰管型的恶变率为38%~68%,分支胰管型为12%~47%[3]。2017版国际共识指南(international consensus guidelines, ICG)将胰头部IPMN导致梗阻性黄疸、强化壁结节≥5 mm、主胰管内径≥10 mm定义为IPMN恶变的高危征象和外科手术的绝对适应证;将胰腺炎病史、囊肿≥3 cm、囊壁增厚、强化壁结节<5 mm、主胰管内径5~9 mm、主胰管管径突然改变伴远端胰腺萎缩、淋巴结肿大、CA19-9升高、囊肿增长率≥5 mm/2年作为IPMN恶变的危险征象和外科手术的相对适应证[4]。因此影像学评估IPMN恶变征象对手术干预的时机具有重要价值。然而,单个征象在预测恶变时均存在一定局限性,容易导致病变的过诊或漏诊[5]。既往多项研究报道所建立的IPMN恶变预测模型具有良好的预测能力[6-12],但大多数预测模型包含穿刺行囊液分析等有创操作,或仅适用于某一种类型的IPMN,目前尚缺少一种无创、同时适用于所有类型IPMN的MRI预测模型。本课题组前期研究已建立基于CT影像特征的IPMN恶变的预测模型,具有较好的预测效能和临床获益[13]。本研究基于MRI影像特征建立预测模型并进行验证,旨在评估MRI影像特征列线图预测IPMN恶变的临床价值。
资料与方法
一、一般资料
回顾性分析2012年10月至2020年4月间海军军医大学第一附属医院260例术前经MRI检查且术后病理确诊的IPMN患者的临床资料。排除标准:(1)同时伴发非IPMN起源的PDAC以及合并胰腺其他肿瘤的患者;(2)术前接受放、化疗的患者;(3)MRI图像无法清晰显示IPMN病灶的患者。收集的信息主要包括性别、年龄、体重指数、有无梗阻性黄疸、有无胰腺炎病史、手术方式等。根据2019版WHO IPMN病理学级别定义[14]将患者分为非恶变组(低度异型增生)和恶变组(重度异型增生、浸润癌)。根据国际预测模型建模共识[15],将患者依据时间顺序分为训练集和验证集,其中2012年10月至2019年4月共193例(非恶变组117例、恶变组76例)患者作为训练集,2019年5月至2020年4月共67例(非恶变组40例、恶变组27例)患者作为验证集。本研究通过医院伦理委员会审核批准。
二、影像学检查方法
患者检查前均禁食禁水4 h。MRI设备为美国GE公司Signa HDxt 3.0 T、美国GE公司Discovery 750 3.0 T扫描仪和8通道体部线圈。扫描序列:(1)横断面呼吸触发脂肪抑制快速自旋回波T2WI序列。重复时间(time of repetition, TR)6 316 ms,回波时间(time of echo, TE)85 ms,层数20,层厚5 mm,层间距1 mm,视野440 mm×440 mm,矩阵224×320。(2)肝脏快速容积成像(liver acquisition with volume acceleration,LAVA)T1WI序列。TR 2.58 ms,TE 1.18 ms,层厚5 mm,无层间距,视野440 mm×440 mm,矩阵224×320。增强扫描采用高压注射器以2.0 ml/s的流率经前臂静脉注入对比剂钆喷替酸葡甲胺(Gd-DTPA)0.2 ml/kg,注射结束后用20 ml生理盐水以同样流率冲洗。分别在注射对比剂后15、20、40 s行动脉期、门静脉期、延迟期扫描。
三、图像分析
由2名高年资影像科医师明确疾病为IPMN但对患者其他临床和病理学信息不知情的情况下共同进行阅片,结果不一致时互相协商达成一致意见。依据2017版ICG中IPMN影像学评估标准分析患者的MRI表现,包括IPMN类型、囊肿部位、囊肿大小、囊壁是否增厚、有无壁结节及壁结节大小、主胰管内径、有无主胰管管径突然改变伴远端胰腺萎缩、淋巴结是否肿大等。其中囊壁增厚定义为厚度≥2 mm[16];壁结节定义为囊壁或扩张胰管壁上强化的实性成分;胰腺萎缩定义为同一位置的主胰管内径与胰腺实质厚度比>0.5[17];淋巴结肿大定义为T1WI增强门静脉期最大短径≥10 mm。所有测量数量均以横断面最大径为标准。
四、统计学处理
结 果
一、临床资料
训练集和验证集非恶变组与恶变组的IPMN类型、囊肿大小、囊壁增厚、壁结节大小、主胰管内径、主胰管管径突然改变伴远端胰腺萎缩的差异均有统计学意义,训练集非恶变组与恶变组的黄疸、淋巴结肿大的差异有统计学意义,其余临床特征和MRI表现差异均无统计学意义(表1)。

表1 260例胰腺导管内乳头状黏液性肿瘤患者一般资料
二、预测模型的构建
多因素logistic逐步回归分析显示,黄疸、囊肿大小、壁结节≥5 mm、主胰管管径突然改变伴远端胰腺萎缩的差异有统计学意义(表2),是预测IPMN恶变的独立危险因素。据此建立的预测IPMN恶变的模型为-0.35+2.28×黄疸+1.57×壁结节≥5 mm+2.92×主胰管管径突然改变伴远端胰腺萎缩-1.95×囊肿<3 cm-1.05×囊肿≥3 cm。可视化列线图见图3。

表2 胰腺导管内乳头状黏液性肿瘤恶变风险因素多变量分析
三、预测模型在训练集和验证集中的预测效能
训练集和验证集的预测模型列线图的ROC曲线见图2,训练集的AUC值为0.85(95%CI0.79~0.91),灵敏度、特异度和准确率分别为72.37%、85.47%和80.31%;验证集的AUC值为0.84(95%CI0.74~0.94),灵敏度、特异度和准确率分别为81.48%、75.00%和77.61%。

图1 基于胰腺导管内乳头状黏液性肿瘤MRI特征的列线图
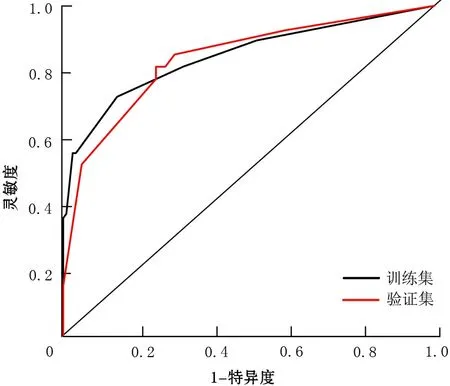
图2 训练集和验证集的ROC曲线
四、临床决策曲线分析
绘制列线图预测IPMN恶变的决策曲线(图3)。临床决策曲线分析表明,当列线图鉴别IPMN恶变的概率>0.16时使用列线图诊断IPMN,比将“所有患者视为恶变治疗”方案或将“所有患者视为非恶变治疗”方案更能让患者获益。

图3 列线图预测胰腺导管内乳头状黏液性肿瘤恶性的决策曲线
讨 论
既往研究结果显示,黄疸、壁结节大小、囊肿大小、主胰管内径是预测IPMN恶变模型的常用独立预测因素[6-12],其中黄疸、壁结节≥5 mm是2017版ICG中IPMN恶变的高危征象和外科手术的绝对适应证。虽然主胰管管径突然改变伴远端胰腺萎缩是IPMN恶变的重要征象[18-19],但既往研究很少将其纳入到预测模型。
本研究多因素分析结果发现,黄疸、壁结节≥5 mm、主胰管管径突然改变伴远端胰腺萎缩、囊肿大小均与IPMN恶变显著相关,因此,建立的对IPMN恶变的预测模型包含黄疸、壁结节≥5mm、主胰管管径突然改变伴远端胰腺萎缩、囊肿大小4项独立因素。该模型是基于MRI影像特征的无创评估模型,对IPMN的恶变表现出良好的预测能力(训练集AUC=0.85,验证集AUC=0.84)。
本研究建立的预测模型纳入主胰管管径突然改变伴远端胰腺萎缩,预测IPMN恶变的OR值高达18.53,其机制是由于IPMN伴高度异型增生或浸润癌的生物学特征与胰腺导管腺癌的常规表现类似,肿瘤阻塞并且侵犯主胰管,造成主胰管狭窄,甚至截断,导致上游主胰管扩张,长期胰管高压引起胰管破裂,胰液外渗导致胰腺炎,反复发作致使胰管周围胰腺组织萎缩,影像学即表现为肿瘤远端的胰腺萎缩。然而,2017版ICG中高危征象之一的主胰管内径≥10 mm在本研究中并未作为独立预测因素进入预测模型,可能是由于训练集恶变组的主胰管内径≥10 mm患者仅占40.79%,另有学者研究得出主胰管内径5~7mm是IPMN恶变的最佳阈值[20-21],表明将主胰管内径≥10 mm作为IPMN恶变高危征象会存在漏诊的可能性。
为了克服单因素分析评估IPMN恶变的局限性,近年来基于列线图的预测模型在评估IPMN恶变中也取得了很多进展。Shimizu等[6,8]分别在2010年和2015年构建了列线图预测模型,预测因素包括性别、IPMN类型、壁结节大小、细胞学分析;随后基于2017版ICG建立新的预测模型(AUC=0.763),包括壁结节大小、主胰管内径、囊肿大小,并获得良好的外部验证结果(AUC=0.725)[12]。但该研究团队的细胞学分析和壁结节大小分别依靠内镜下逆行胰胆管造影和超声内镜检查,均属于有创操作,且易受到操作者经验影响。Correa-Gallego等[7]和Attiyeh等[11]基于多中心数据构建了分别针对主胰管型或混合胰管型IPMN、分支胰管型IPMN的两个独立预测模型,但是基于2012版ICG评估标准,纳入模型的因素均以临床指标为主,影像学评估不够全面。Jang等[10]收集了日本和韩国22家医疗中心的2 525例分支胰管型IPMN患者构建列线图预测模型,在训练集(AUC=0.783)和验证集(AUC=0.737)均具有良好的鉴别能力。但该模型并不适用于恶变率相对较高的主胰管型或混合胰管型IPMN。本研究基于MRI影像特征列线图的预测模型,优势在于基于2017版ICG、无创、适用于所有类型IPMN,且表现出良好的预测效能。本研究不足之处:(1)回顾性研究,仅纳入经手术切除的患者,未纳入尚处于随访阶段的患者;(2)单中心研究,预测模式缺少外部验证;(3)囊肿增长速率、癌胚抗原、CA19-9未纳入评估指标,由于缺少术前随访数据,部分患者肿瘤指标缺失。笔者将联合多中心,增加样本量,进行外部验证,为预测模型的临床应用提供更有力的证据。
利益冲突所有作者均声明不存在利益冲突
