拉伸指数弥散加权成像模型直方图分析预测单发肝细胞癌微血管侵犯
2021-12-26李宏翔薛蕴菁王莉莉许乙凯
李宏翔,薛蕴菁*,王莉莉,张 静,段 青,许乙凯
(1.福建医科大学附属协和医院放射科,福建 福州 350001;2.南方医科大学南方医院影像中心,广东 广州 510515)
肝细胞癌(hepatocellular carcinoma, HCC)是高发恶性肿瘤,外科手术切除是其首选治疗方法,文献[1-2]报道,约70%的HCC在术后5年内复发,而HCC微血管侵犯(microvascular invasion, MVI)被认为是导致术后复发和影响术后生存率的重要因素。研究[3]表明,多发HCC出现MVI的概率较高;根据术前影像学表现和MR功能成像等技术可预测HCC MVI[1,4-6],有利于制定治疗方案及改善预后。拉伸指数模型直方图分析可用于评估肿瘤相关生物学行为[7-8]。本研究评估拉伸指数弥散加权成像(diffusion weighted imaging, DWI)模型直方图分析术前预测单发HCC MVI的价值。
1 资料与方法
1.1 一般资料 收集2017年8月—2019年4月43例于福建医科大学附属协和医院及南方医科大学南方医院经术后病理确诊的HCC患者,男40例,女3例,年龄34~72岁,平均(51.3±9.6)岁。纳入标准:①术前接受腹部多期动态MR增强检查及多b值DWI;②MR检查与手术切除间隔时间不超过4周;③影像学资料显示病灶单发,且未发现大的静脉癌栓。排除标准:①术前接受肿瘤局部治疗;②图像质量不佳或临床资料缺失。
1.2 仪器与方法 采用Philips Achieva 3.0T MR仪,配备16通道相控阵体部线圈,行上腹部扫描。参数:T2W/脂肪抑制T2W,TR 1 250 ms,TE 80 ms/TR 1 307,TE 80 ms,层厚5 mm;改良版两点法水脂分离序列,TR 3.3 ms,TE 1/TE2 1.18/2.1 ms,层厚3 mm;多b值DWI,采用单次激发平面回波序列,b值分别为0、10、20、40、80、200、400、600、1 000 s/mm2,TR/TE 2 062/63 ms,FOV 375 mm×302 mm×150 mm,矩阵256×256,层厚5 mm,层数30,NEX 2。之后以流率2 ml/s经肘静脉注射对比剂钆塞酸二钠(Primovist,Bayer)0.1 ml/kg体质量,采用T1高分辨各向同性容积激发序列行动态增强扫描,TR/TE 3.2/1.53 ms,层厚 3 mm。
1.3 图像分析 将多b值DWI导入MATLAB 2014软件(http://www. mathworks.com/),由2名具有10年以上腹部影像学诊断经验的主任医师结合轴位T2WI和增强扫描图像测量增强扫描肝胆期轴位T2WI中的肿瘤最大径,于轴位DWI(b=1 000 s/mm2)上逐层手动勾画肿瘤边界作为ROI,软件自动获得全瘤感兴趣体积(volume of interest)(图1),并根据拉伸指数模型计算公式Sb/S0=exp[-(b×DDC)]α自动生成表观弥散系数(apparent diffusion coefficient, ADC)、分布弥散系数(distribute diffusion coefficient, DDC)和水分子各向异质性(alpha, α)的直方图参数,包括直方图分布的第5、25、50、75、95百分位数(5th、25th、50th、75th、95th)、平均值、偏度和峰度。对以上参数均测量3次,以平均值作为结果,并获得拉伸指数模型拟合曲线。

图1 患者男,52岁,HCC,MVI(+) A.轴位DWI(b=1 000 s/mm2),绿框区域为ROI; B.脂肪抑制T2WI; C.动态增强MR肝胆期图像; D.拉伸指数模型拟合曲线图; E.病理图(HE,×400)示管腔内癌细胞(短箭) (长箭示病灶)
1.4 分组 参考《原发性肝癌规范化病理诊断方案专家共识》[9],由2名病理学主任医师中的任意1名复阅病理切片,以镜下可见HCC周围肝组织中的门静脉或肝静脉、肝动脉、胆管及淋巴管有成团癌细胞并有明确血管内皮细胞环绕、且肉眼未发现肿瘤侵犯大血管为MVI(+);并据此将患者分为MVI(+)组(n=22)和MVI(-)组(n=21),记录其血清甲胎蛋白、HCC直径及分级和肝功能等。
1.5 统计学分析 采用SPSS 20.0和MedClac 18.2统计分析软件。以±s表示符合正态分布的计量资料,行独立样本t检验;对计数资料采用χ2检验或Fisher精确概率法进行比较。以组内相关系数(intra-class correlation coefficient, ICC)评估2名医师测量结果的一致性。采用受试者工作特征(receiver operating characteristic, ROC)曲线评估组间差异有统计学意义的参数预测HCC发生MVI的效能,计算其曲线下面积(area under the curve, AUC)、阈值、敏感度和特异度,并以DeLong检验比较各参数AUC的差异。将组间差异有统计学意义的参数纳入多因素Logistic回归分析,获得诊断效能最佳的参数。P<0.05为差异有统计学意义。
2 结果
2.1 组间一般资料比较 MVI(+)组HCC直径大于MVI(-)组(P=0.045),余差异均无统计学意义(P均>0.05),见表1。
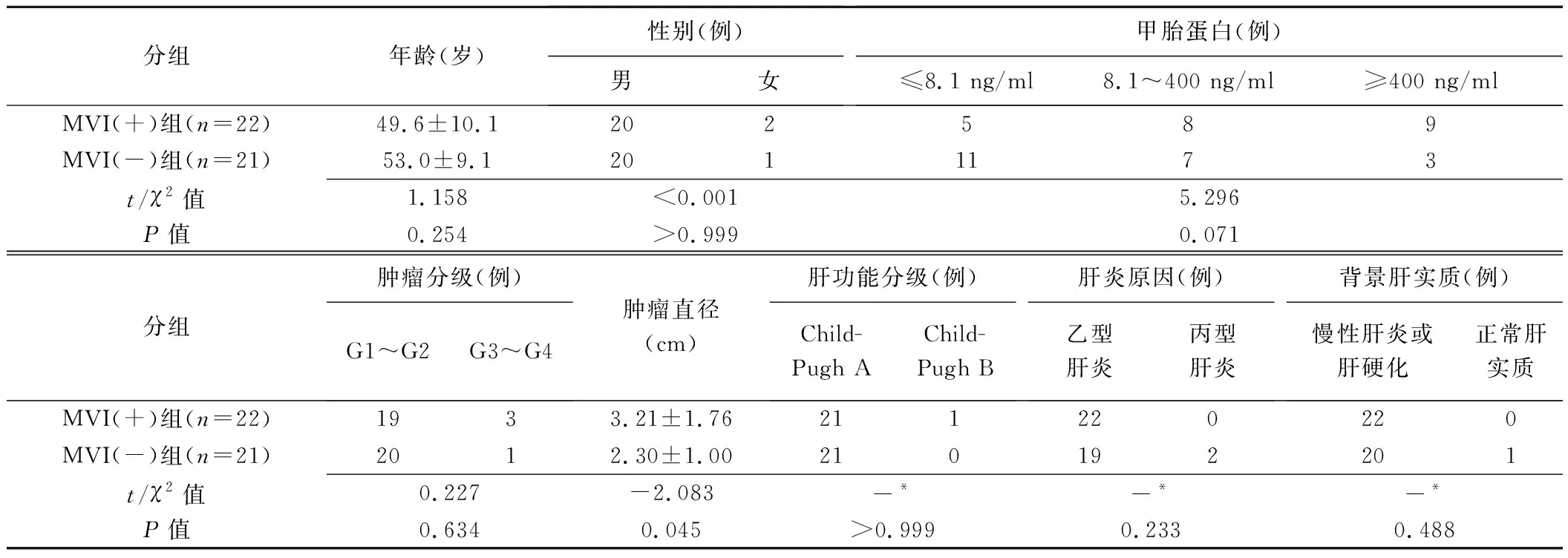
表1 MVI(+)与MVI(-)单发HCC患者一般资料比较
2.2 直方图参数 2名医师测量各直方图参数的一致性ICC为0.797~0.963(P均<0.05)。组间DDC平均值及5th、25th、50th和ADC 5th差异均有统计学意义(P均<0.05),α的直方图参数差异均无统计学意义(P均>0.05),见表2。

表2 MVI(+)与MVI(-)单发HCC患者直方图参数值比较
2.3 ROC曲线分析 组间差异有统计学意义的各参数中,DDC 5th预测MVI的AUC最大(0.86),阈值取0.58×10-3mm2/s时,其诊断敏感度及特异度分别为95.45%及66.67%,见表3及图2。DeLong检验显示,DDC 5th的AUC高于DDC(25th、50th)及平均值、ADC 5th和HCC直径(Z=1.96~2.91,P均<0.05),其余参数两两比较差异均无统计学意义(Z=0.12~1.91,P均>0.05)。

图2 根据DDC 5th、ADC 5th和HCC直径预测MVI的ROC曲线

表3 以直方图参数及HCC直径预测MVI的ROC曲线分析结果
2.4 多因素回归分析 将组间差异有统计学意义参数纳入多因素回归分析,结果显示DDC 5th是MVI(+)的独立预测因素(OR=18.60,P=0.005)。
3 讨论
HCC为常见恶性肿瘤,根治性手术切除是最佳选择,但HCC术后高复发率一直是困扰临床的问题。MVI是影响HCC术后生存率与复发的重要因素[1-3],术前预测MVI有利于改善预后。拉伸指数模型可反映组织内水分子连续分布弥散情况及组织异质性,同时生成DDC与α;DDC代表体素内ADC连续分布情况,α反映水分子扩散速率的异质性,主要与组织的不均质性密切相关,其变化范围0~1,α接近0表示组织扩散异质性较高,α接近1则提示组织内弥散异质性低[7-8]。近年来,拉伸指数模型已用于研究前列腺癌、胶质瘤分级及乳腺肿瘤[7,8,10]等。
ADC主要反映水分子呈高斯分布的情况,而DDC能更精确反映肿瘤细胞内水分子的非高斯扩散信息[7]。文献[4]报道,MVI(+)HCC细胞内微环境更复杂,细胞内水分子扩散更多表现为非高斯分布,而不仅是高斯分布。本研究MVI(+)组DDC(5th、25th、50th)及ADC 5th均低于MVI(-)组。相比MVI(-)HCC,MVI(+)HCC常侵犯细小门静脉、肝静脉或包膜下小血管,导致水分子扩散受限[4,6],且肿瘤细胞增殖更旺盛,肿瘤细胞增多,核质比相对较高,细胞内外水分子扩散受限更明显[4,6],故其DDC及ADC减低。DDC预测MVI的诊断效能较ADC高,其DDC 5th的AUC高于DDC(25th、50th)及平均值、ADC 5th,推测原因在于ADC包含灌注和扩散两方面的信息,而DDC反映组织平均扩散分布系数,是ADC的加权和,故能更准确地反映肿瘤扩散特征和平均扩散速率[8]。
拉伸指数模型比单指数模型的可靠性与可重复性更高,有利于临床应用[11]。本研究采用直方图分析得到多项反映肿瘤信息的参数,多因素分析显示DDC 5th是MVI的独立预测因素,其诊断效能最佳。DDC较小值的直方图参数主要反映HCC增殖旺盛区域,即肿瘤细胞密度较高及细胞结构更致密的区域,而这些因素均利于MVI发生;MVI(+)HCC肿瘤细胞增殖更快,更易侵犯周围细小血管,肿瘤血供降低,致细胞微环境不均衡,使肿瘤细胞易于坏死[12]。
本研究组间α差异无统计学意义,推测与纳入样本量较少有关。既往研究[13]通过勾画肿瘤局部ROI,在肿瘤最大层面或实性部分测量各参数,会丢失重要信息,使其结果不能代表全瘤异质性。本研究应用肿瘤全域直方图分析,可更好地反映整个肿瘤的异质性,且能减少因勾画局部ROI出现的选择性偏倚[14-15]。
综上所述,拉伸指数模型DWI直方图分析有助于术前预测HCC MVI,以DDC 5th的诊断效能最佳。本研究的局限性:①样本量小;②目前对于拉伸指数模型DWI肝脏扫描的b值大小和数量尚无统一标准,有待优化。
