粟酒裂殖酵母接种方式对黑比诺干红葡萄酒品质的影响
2021-12-26高娉娉温华婷
高娉娉,温华婷,赵 美,王 婧,*
(1.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
葡萄酒酿造过程是以酿酒酵母(Saccharomycescerevisiae,S.cerevisiae)为主导的酒精发酵,为了提高葡萄酒酒体微生物的稳定性,通常结合乳酸菌进行苹果酸-乳酸发酵(malolactic fermentation,MLF)。然而,乳酸菌主导的苹果酸-乳酸发酵是一个复杂的代谢过程,会产生一些影响葡萄酒质量的物质,如生物胺[1]。近年来,越来越多的研究开始关注非酿酒酵母(non-Saccharomycescerevisiae)在葡萄酒酿造方面的应用,以期提高葡萄酒品质。研究较多的非酿酒酵母主要有戴尔有孢圆酵母(Torulasporadelbrueckii)[2]、柠檬形克勒克酵母(Kloeckeraapiculata)[3]、有孢汉逊酵母(Hanseniasporauvarum)[4]、假丝酵母(Candidapulcherrima)[5]、粟酒裂殖酵母(Schizosaccharomycespombe)[6]、异常汉逊酵母(Hansenulaanomala)[7]和耐热克鲁维酵母(Lachanceathermotolerans)[8]。这些研究报告显示,酿酒酵母和非酿酒酵母菌株混菌发酵能够增加酒体中甘油、总酸、挥发性酯类物质含量,降低乙酸含量,形成稳定的吡喃型花色苷类物质,对提升葡萄酒感官品质具有积极影响。
粟酒裂殖酵母(Schizosaccharomycespombe,S.pombe)早期被认为是造成葡萄酒腐败变质的原因之一,其代谢产生的乙酸、乙醛和乙酸乙酯会给葡萄酒带来不良的风味[6]。近几年研究发现,一些优选的S.pombe具有独特的代谢特性,不仅能够作为生物脱酸剂将苹果酸转化为乙醇和二氧化碳,使葡萄酒口感柔和[9];而且可以用来提高葡萄酒中吡喃花青素的含量,改善红葡萄酒颜色稳定性[10]。同时,S.pombe产生的脲酶可减少氨基甲酸乙酯和组胺等生物胺的产生,提高葡萄酒安全性[11]。此外,S.pombe可以增加酒体的香气化合物,改善葡萄酒的复杂性[12]。据报道,S.pombe已经被用于工业规模的朗姆酒生产、棕榈酒生产、可可发酵、啤酒酿造和苹果果酒酿造等[13]。因此,研究S.pombe在葡萄酒酿造中的应用潜力具有非常重要的意义。
黑比诺喜欢温和或冷凉的气候,酿造的葡萄酒优雅细腻,具有丰富的花果香气。西北产区因其独特的气候条件(昼夜温差较大,气温偏低),酿酒葡萄成熟时间较短,成品酒酸度过高、香气复杂性欠缺[14]。为此,本实验以贺兰山东麓青铜峡市西鸽酒庄黑比诺葡萄为原料,采用S.pombe单独接种发酵及与S.cerevisiae同时接种或顺序接种发酵,检测其发酵过程中苹果酸、生物胺等理化指标的变化,测定发酵后的挥发性香气物质的含量,研究S.pombe的不同接种方式对黑比诺干红葡萄酒品质的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
黑比诺葡萄,采摘于贺兰山东麓青铜峡市西鸽酒庄葡萄种植基地,糖含量为226.8 g·L-1(以还原糖计),可滴定酸含量为6.8 g·L-1(以酒石酸计),pH值为3.67。
1.1.2 菌种与培养基
商业酿酒酵母(Saccharomycescerevisiae,S.cerevisiae),红佳酿Vintage Red,购于意大利Enartis公司;粟酒裂殖酵母(Schizosaccharomycespombe,S.pombe),甘肃农业大学葡萄酒微生物实验室保藏;商业酒酒球菌(Oenococcusoeni),OMEGA,购于法国Lallemand公司。
YPD固体培养基:无水葡萄糖10 g·L-1,蛋白胨10 g·L-1,酵母浸粉5 g·L-1,琼脂10 g·L-1。YPD液体培养基:无水葡萄糖10 g·L-1,蛋白胨10 g·L-1,酵母浸粉5 g·L-1。葡萄汁培养基:葡萄汁与无菌水为1∶1(体积比)。所有培养基均于121 ℃灭菌20 min。
1.1.3 主要试剂
果胶酶,EX-V,法国Lallemand公司;2-辛醇(色谱纯)购于SIGMA-ALDRICH(上海)贸易有限公司;偏重亚硫酸钠、L-苹果酸(色谱纯)、L-乳酸(色谱纯)等均购自上海源叶生物科技有限公司。
1.2 主要仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;H2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;Genesis 10s紫外-可见分光光度计,美国Thermo Scientific公司;Ultimate 3000高效液相色谱仪,美国Thermo Scientific公司;TRACE 1310-ISQ气相色谱质谱仪,美国Thermo Scientific公司。
1.3 试验方法
1.3.1 发酵试验
菌株活化:1)将商业活性干酵母S.cerevisiae按0.2 g·L-1添加量置于无菌水中,37 ℃水浴30 min后接种于YPD液体培养基中,于28 ℃培养48 h后以2%的接种量接种于葡萄汁培养基中扩培2次后进行接种试验。2)将保藏在斜面培养基上的S.pombe接种于YPD液体培养基中,28 ℃培养48 h,再以2%的接种量接种于葡萄汁培养基中,于28 ℃再培养48 h后进行接种试验。3)将商业酒酒球菌OMEGA活性干粉按0.02 g·L-1添加量置于无菌蒸馏水中,于30 ℃活化20 min。
发酵工艺:黑比诺葡萄→除梗破碎→装罐(添加40 g·L-1SO2,20 mg·L-1果胶酶)→15 ℃培养箱中浸渍48 h,皮渣分离→葡萄汁分装→65 ℃水浴20 min→冷却→25 ℃接种酵母进行酒精发酵(当还原糖低于4 g·L-1时,添加50 mg·L-1SO2终止发酵,满罐于15 ℃下贮存。)
4种发酵接种处理(均进行3次重复):1)S.cerevisiae单独接种发酵(细胞浓度为107CFU·mL-1),酒精发酵结束后进行苹果酸-乳酸发酵,为对照组,标记为SC+MLF;2)S.pombe单独接种发酵(细胞浓度为107CFU·mL-1),标记为SP;3)S.pombe与S.cerevisiae细胞浓度比为1 000∶1接种发酵(细胞浓度分别为107CFU·mL-1、104CFU·mL-1),标记为SP+SC;4)S.pombe提前S.cerevisiae8 d接种(细胞浓度均为107CFU·mL-1),标记为SP..SC。3个处理组(SP、SP+SC、SP..SC)酒精发酵结束后均不进行苹果酸-乳酸发酵。
1.3.2 指标测定
理化指标测定:1)总糖、总酸、酒精度和挥发酸等理化指标参照国家标准GB/T 15038—2006中的方法进行测定;单宁参照农业标准NY/T 1600—2008中的方法;总花色苷参照史肖等[15]的方法。2)柔和指数=酒精-(酸度+单宁)[16],其中酒精用体积百分数表示,单宁用g·L-1表示,酸度用g·L-1表示(以硫酸计)。3)色度色调参照李素岳[17]的方法。准确吸取酒样1 mL,用蒸馏水定容至10 mL容量瓶中,取稀释后的酒样于1 cm光程比色皿中,分别在420,520和620 nm下测定吸光度值,色度值(V1)和色调值(V2)的计算公式如下:
V1=D420+D520+D620;
(1)
V2=D420/D520。
(2)
苹果酸的测定:参照Buglass等[18]和Pérez-Ruiz等[19]的方法,采用高效液相色谱(HPLC)法测定,并略作修改。1)色谱条件:色谱柱为BDS HYPERSIL C18(250 mm×4.6 mm,5 μm);检测器为二极管阵列检测器;流动相为0.005 mol·L-1的硫酸水溶液;流速0.5 mL·min-1;柱温为30 ℃进样量20 μL;检测波长为210 nm。2)定性:将配好的苹果酸、乳酸单一标准溶液分别进样,确定各自的出峰时间,根据保留时间进行定性。3)定量:将配好不同浓度的苹果酸和乳酸混合标准液分别进样,进行定量分析。以不同混合酸标准液的浓度为自变量(x),出峰面积为因变量(y)绘制标准曲线,得到苹果酸的标准曲线方程为y=11.694x+0.027 6,R2=0.999 8;乳酸标准曲线方程为y=10.768x+0.035 5,R2=0.999 7。
组胺与氨基甲酸乙酯测定:分别参照GB 5009.208—2016、GB 5009.223—2014中的方法测定。
1.3.3 挥发性香气化合物测定
按照本实验室优化的方法进行。
香气物质富集:取8 mL酒样于顶空瓶中,加入2.4 g NaCl及10 μL内标物2-辛醇(88.2 mg·L-1),加转子密封,置于磁力搅拌器上,40 ℃下水浴平衡30 min后用50/30 μm(DVB/CAR/PDMS)的萃取头顶空萃取30 min。
GC-MS条件:TG-WAX色谱柱(60 m×0.25 mm,0.5 μm);升温程序为40 ℃保持5 min,以5 ℃·min-1升至230 ℃,保持10 min;载气(He)流速1 mL·min-1;不分流进样;电子电离源;电子能量70 eV;进样口温度、传输线温度、离子源温度均为250 ℃;质量扫描范围m/z50~450。
定性分析:GC-MS分析所得的样品质谱图经计算机在NIST、Wiley数据库检索比对,结合谱图分析,确定挥发性香气物质的化学成分。
定量分析:各成分的含量采用内标法进行半定量,计算样品中各香气组分的含量。
1.3.4 感官分析
由10位葡萄酒品尝员进行感官评价,分别从外观(颜色、澄清度)、口感(酸度、甜味、苦味)、香气(浓郁度、纯正度、还原味、氧化味)和总体评分四个方面对各葡萄酒样品进行评价,使用10分结构化数值尺度来量化,从0(无)到10(优)对10个指标进行评分。
1.3.5 数据处理
采用Excel 2010和Origin 9.0软件进行数据处理和图形绘制。使用SPSS 19.0绘制主成分分析图,并对数据进行差异显著性分析,采用Duncan检验两两比较,显著性水平P<0.05。
2 结果与分析
2.1 发酵过程分析
图1为不同接种方式发酵过程中的总糖消耗曲线。结果显示,处理组的发酵速度比对照组低。其中S.pombe与S.cerevisiae顺序接种发酵速度最低(SP..SC),于第18天完成酒精发酵,而S.pombe单独接种发酵与S.cerevisiae同时接种发酵分别在第14、16天完成酒精发酵(SP、SP+SC)。表明,SP、SP+SC和SP..SC都具一定的酒精发酵能力,该结果与前期有关S.pombe具有良好的乙醇发酵能力的研究结果一致[20]。

图1 发酵过程中总糖变化曲线
2.2 不同接种方式对葡萄酒品质的影响
2.2.1 主要理化指标的测定
表1显示了不同接种方式发酵结束后葡萄酒的基本理化指标。4种酒样的残糖含量在3.01~3.86 g·L-1,表明各试验酒样都能够完成酒精发酵;各试验组的酒精体积分数介于11.20%~12.10%;处理组酒样中总酸含量显著低于对照组,降低量在0.32~2.19 g·L-1,试验酒样的挥发酸含量没有显著差异。以上4个指标均符合国标GB 15037—2006对干红葡萄酒的要求。与对照组相比,处理组的pH值均有一定的增加,在4.00~4.19;经过苹果酸-乳酸发酵的对照组酒样中乳酸含量(0.99 g·L-1)显著高于处理组(P<0.05),但各处理组之间无显著差异(P>0.05)。单宁是影响葡萄酒质量的重要组成部分,赋予了葡萄酒独特的感官品质(收敛性),其含量与葡萄酒品质密切相关[21]。处理组酒样中的单宁含量与对照组之间没有显著差异(P>0.05)。处理组酒样的色度值、色调值和总花色苷含量与对照组之间没有显著差异(P>0.05)。SP..SC的酒样柔和指数与对照组和其他处理组之间差异显著(P<0.05),其值为6.87,柔和指数介于6~7,表明红葡萄酒丰满圆润,口感平衡[16]。综上所述,S.pombe和S.cerevisiae顺序接种发酵的葡萄酒,能够降低总酸的含量,增加葡萄酒的柔顺程度。
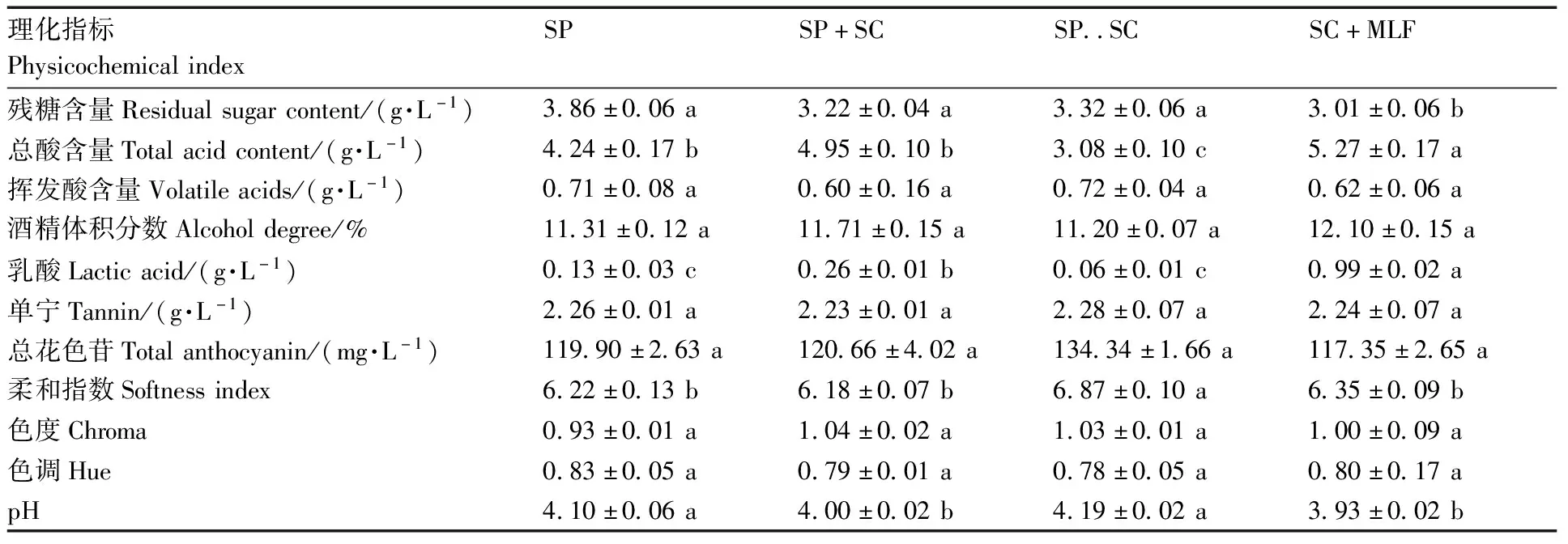
表1 不同接种方式下葡萄酒的理化指标变化
2.2.2 不同接种方式对葡萄酒苹果酸的影响
由图2可知,对照组单独接种酿酒酵母S.cerevisiae进行酒精发酵,苹果酸含量下降了21.05%,与其他研究结果一致[22-23],酒精发酵结束后进行的苹果酸-乳酸发酵,使苹果酸迅速下降至0.15 g·L-1。处理组苹果酸含量主要在发酵的前6 d迅速下降,酒精发酵结束后苹果酸几乎被完全降解,但处理组之间没有明显差异,含量为0.04~0.05 g·L-1,下降了95.49%~96.99%。许多研究也表明,根据所使用的S.pombe菌株不同,其苹果酸含量下降幅度在75%~100%[24]。表明,S.pombe菌株在葡萄酒中可以明显降低葡萄酒中苹果酸含量。

图2 不同接种方式对苹果酸含量的影响
2.2.3 不同接种方式对葡萄酒生物胺的影响
葡萄酒发酵过程中含氮化合物不完全代谢会生成氨基甲酸乙酯和组胺等生物胺,这是葡萄酒中重要的安全风险因子[25]。在对组胺和氨基甲酸乙酯进行检测时,未检测到氨基甲酸乙酯(表2)。所有发酵组中组胺的最终水平均低于目前的限量标准2 mg·L-1。处理组葡萄酒中组胺的含量显著低于对照组中组胺含量,其中SP..SC的组胺含量显著低于SP和SP+SC(P<0.05),为0.14 mg·L-1。以上结果表明,使用S.pombe进行葡萄酒发酵时,可以提高葡萄酒的安全性。

表2 不同接种方式对组胺和氨基甲酸乙酯含量的影响
2.3 不同接种方式对葡萄酒主要香气化合物的影响
香气是葡萄酒感官品质的重要方面。通过顶空固相微萃取(headspace solid phase microextraction,HS-SPME)与气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS)对试验酒样香气物质进行检测分析,共检出78种主要挥发性香气物质。包括22种醇类,26种脂类,14种酸类,9种萜烯类,7种其他类。
由图3可知,SC+MLF共检出45种香气物质,SP共检出46种香气物质,SP+SC共检出62种香气物质,SP..SC共检出78种香气物质。醇类物质是酵母代谢的次级产物之一,是葡萄酒中主要的香气物质,根据其在葡萄酒中组成和含量的不同,可能赋予葡萄酒怡人的花香和果香等气味[26]。SP、SC+MLF中醇类物质含量显著低于SP+SC、SP..SC,其中SP..SC醇类物质含量最高,为3 590.6 μg·L-1。酯类是葡萄酒通过酯化反应产生,也是酵母的代谢产物,能够为葡萄酒带来果香味[27]。SP中酯类物质含量显著低于对照组和其他处理组,但SP+SC、SP..SC和对照组之间没有显著差异,其中SP..SC酯类物质含量最高,为5 358.32 μg·L-1。葡萄酒中的酸类一般是酵母菌和乳酸菌代谢产生,具有腐败和奶酪的气味[27]。SP、SP+SC、SP..SC中酸类物质含量显著低于SC+MLF,其中SP中酸类物质含量最低,为1 115.35 μg·L-1。葡萄酒中的萜烯类物质感官阈值低,这类物质具有浓郁的香味,对葡萄酒的香气有很大的积极贡献。SP+SC、SP..SC中萜烯类物质含量显著高于SP、SC+MLF,其中SP+SC、SP..SC中萜烯类物质含量分别为47.35 μg·L-1和46.31 μg·L-1。不同接种方式下的葡萄酒中其他类物质含量没有显著差异,且含量相对较低。上述结果表明,S.pombe与S.cerevisiae同时和顺序接种发酵能够增加葡萄酒中酯类、醇类和萜烯类物质的总量和种类。
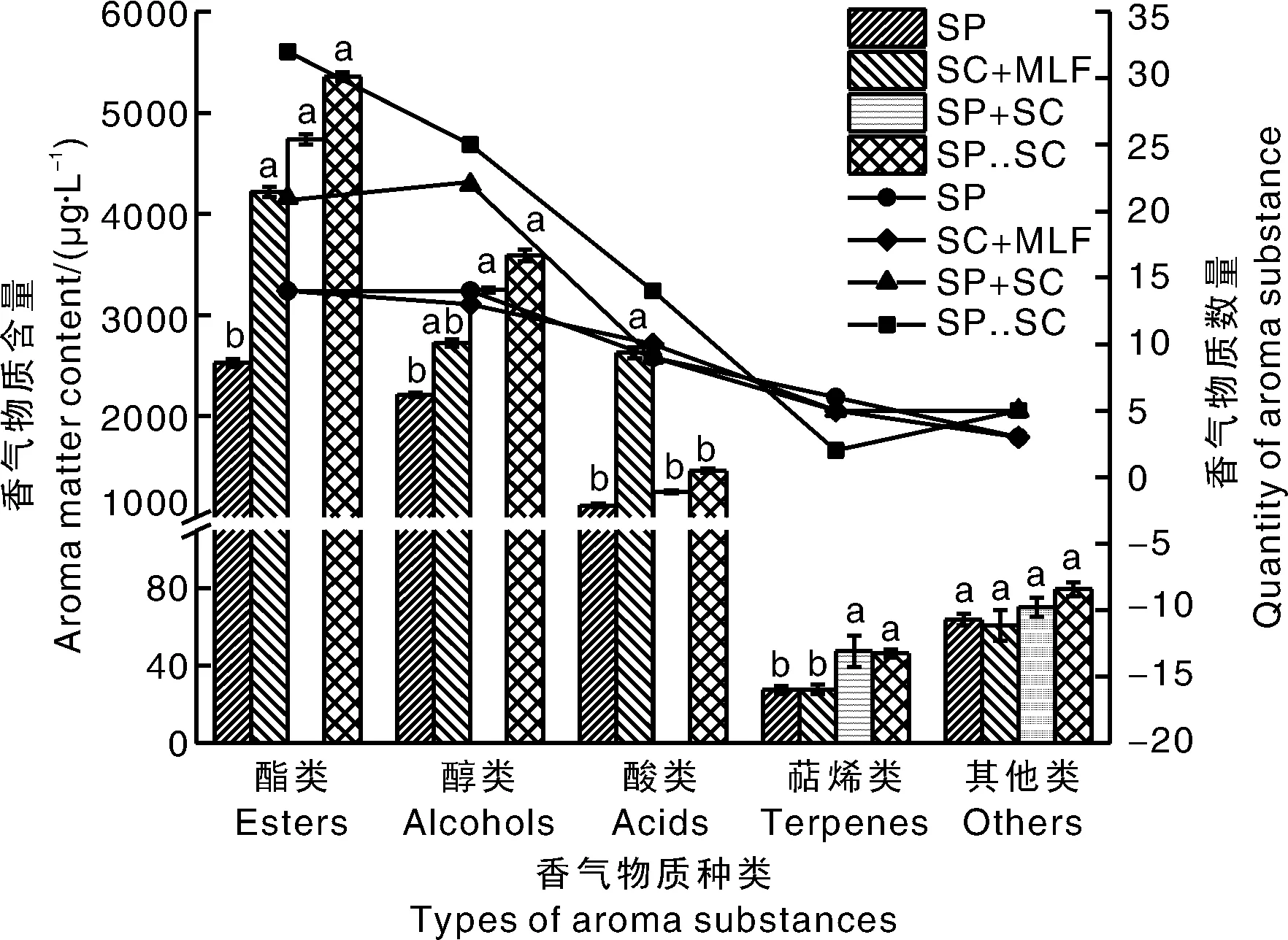
柱形图表示香气物质含量,折线图表示香气物质数量。不同处理间没有相同小写字母表示差异显著(P<0.05)。
气味活性阈值(odor activity value,OAV)是评价单一香气化合物对整体香气的贡献程度[28]。为进一步确定各种香气物质对葡萄酒香气的贡献大小,本试验将OAV>1的物质归为关键性香气物质。由表3可知,共有16种关键性香气物质,其中S.pombe与S.cerevisiae顺序接种发酵产生的关键性香气物质最多共8种,S.cerevisiae单独发酵的为7种,S.pombe与S.cerevisiae同时接种发酵的为7种,S.pombe单独发酵的为3种。
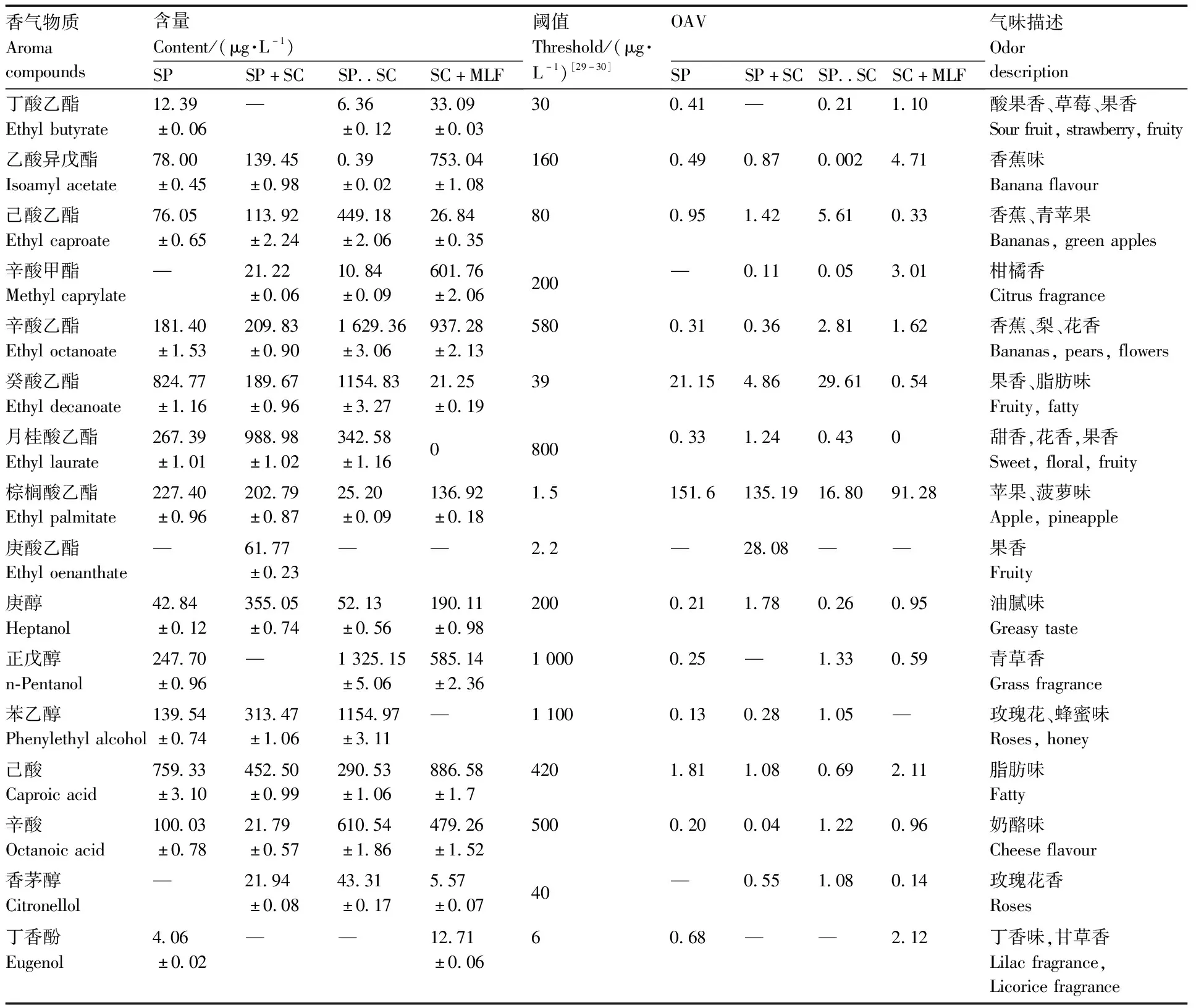
表3 关键性香气物质的OAV
由于葡萄酒香气成分复杂,为明确各个酒样的香气成分差异,将16种OAV >1的香气物质进行主成分分析(principle compounds analysis,PCA)。由图4可知,两个主成分(PC1和PC2)分别占总体方差的44.07%和42.81%,二者累计贡献率达到86.88%。SC+MLF位于PC1的正向端,与丁酸乙酯、辛酸甲酯、丁香酚、乙酸异戊酯等香气物质相关性强,能够为葡萄酒带来比较浓郁的果香、花香等气味,但也与己酸的相关性较强,会为葡萄酒带来脂肪味等不良气味;SP..SC位于PC2的正向端,与正戊醇、辛酸乙酯、己酸乙酯、苯乙醇、癸酸乙酯、香茅醇等香气物质具有紧密联系,能够为葡萄酒带来浓郁的花香、果香等气味;SP、SP+SC与月桂酸乙酯、庚酸乙酯、庚醇的相关性较强,月桂酸乙酯和庚酸乙酯能够为葡萄酒带来怡人的花香和果香,而庚醇为葡萄酒带来了油腻味等不良气味。相比之下,S.pombe和S.cerevisiae顺序接种发酵的葡萄酒产香性能优于对照组和其他处理组,并且产脂类、醇类物质能力最强。
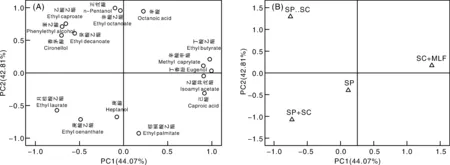
图4 香气化合物主成分分析的因子载荷图(A)和样品分布图(B)
2.4 感官分析
对不同接种发酵方式的葡萄酒进行感官分析(图5)。与对照组相比,3种不同的接种方式进行酒精发酵后的葡萄酒在澄清度、颜色、还原味等方面没有明显的差异;S.cerevisiae单独接种发酵后进行的苹果酸-乳酸发酵为葡萄酒带来了强烈的氧化味、酸味和苦味,处理组酒样的氧化味、酸味和苦味明显低于对照组,SP..SC的葡萄酒的酸味明显低于SP和SP+SC,处理组葡萄酒的氧化味和苦味之间没有明显差异。SP..SC的酒样在总体评分方面得到了最高的分数,酒样口感柔和,香气浓郁,具有良好的感官品质。上述结果表明,S.pombe与S.cerevisiae顺序接种发酵的葡萄酒感官评价最优。

图5 感官分析雷达图
3 结论
以黑比诺葡萄为原料,采用S.pombe单一菌株接种发酵及与S.cerevisiae同时或顺序接种发酵进行干红葡萄酒酿造时,其残糖、酒精度、总酸和挥发酸均符合国标GB 15037—2006《葡萄酒》对干红葡萄酒的要求;与对照组相比,其葡萄酒均能够完成酒精发酵,且能够显著降低葡萄酒中苹果酸和组胺的含量;其中,S.pombe与S.cerevisiae顺序接种发酵的葡萄酒中苹果酸和组胺含量明显低于对照组和其他处理组。S.pombe与S.cerevisiae同时和顺序接种发酵与对照组相比,均能够明显增加葡萄酒中的醇类、酯类和萜烯类物质的总量和种类,使葡萄酒中具有浓郁的果香和花香。通过感官评价发现,S.pombe和S.cerevisiae顺序接种发酵能够增加葡萄酒的香气,改善葡萄酒口感。综上所述,S.pombe单一菌株接种及与S.cerevisiae同时或顺序接种时,S.pombe和S.cerevisiae以顺序接种方式发酵能够明显增加酒体中醇类、酯类和萜烯类物质含量,降低苹果酸含量,在一定程度能够提升葡萄酒的感官品质,具有潜在的应用价值。
