CRISPR/Cas9基因编辑技术的发展及其在植物中的应用
2021-12-25廖嘉明李春梅张石虎李布野欧阳昆唏陈晓阳
廖嘉明, 李春梅, 张石虎, 李布野, 欧阳昆唏*, 陈晓阳*
(1.华南农业大学林学与风景园林学院, 广州 510642; 2.五华县林业局, 广东 梅州 514400)
基因编辑技术指能够靶向编辑生物体内的目标基因,实现对特定DNA片段的删除、插入、定点突变等的技术。与传统的类转录激活因子效应物核酸酶(transcription activator-like effector nucleases, TALEN)[1]和锌指核酸酶(zinc finger nuclease, ZFN)[2]基因编辑技术相比,成簇规律间隔短回文重复(clustered regularly interspaced short palindromic repeat, CRISPR)基因组编辑系统具有突变效率高、准确度高、载体构建简单等特点,成为全球最为流行的基因编辑技术,获得了2020年的诺贝尔化学奖[3]。CRISPR/Cas基因编辑技术极大地促进了生命科学的发展。除了用于疾病治疗、药物研发、基因功能研究,该技术在农作物的遗传改良领域也起到重要作用。
本文介绍了CRISPR/Cas系统的作用机理以及其在作物和林木遗传育种中的研究进展和应用,进一步就该系统在植物遗传育种应用中的技术优化进行了探讨,并对其发展前景进行了展望。
1 CRISPR/Cas系统
1.1 CRISPR/Cas系统的发现
1987年,Ishino等[4]在大肠杆菌iap基因的3′端侧翼区发现了一段由高度同源的29个核苷酸组成的重复序列,且彼此之间被32个核苷酸的间隔序列隔开(图1)。对原核生物基因组序列的分析结果显示,在古细菌和细菌的基因组中存在25~50 bp长度的短重复序列,中间间隔着大小相似的独特序列[5]。到2002年,将这种特殊的重复序列结构称为成簇规律性间隔的短回文重复序列(CRISPR),同时发现在CRISPR序列附近存在一些保守基因,这些基因被命名为Cas基因[6]。2005年,CRISPR中的间隔序列首次被证实与病毒和细菌的遗传物质序列具有同源性[7]。这些具有同源性的间隔序列是细胞受到外源遗传物质入侵后产生的痕迹,以使它们产生适应性免疫,因此,推测CRISPR序列在细菌基因组中的广泛存在可能对外来DNA的入侵起防御和保护作用[8]。Barrangou等[9]通过细菌和噬菌体的相关试验证明,细菌中CRISPR与相关的Cas基因一起对噬菌体产生抗性,表明CRISPR/Cas系统参与了细菌适应性免疫反应,因此,认为CRISPR/Cas系统可能被开发为一种病毒防御机制系统。之后研究发现,当噬菌体首次入侵宿主细菌时,CRISPR/Cas系统同时裂解噬菌体和质粒DNA,整合噬菌体的一段DNA序列到基因组CRISPR位点中,然后表达CRISPR RNA(crRNA);当噬菌体再次入侵时,crRNA表达,Cas蛋白利用crRNAs靶向外源遗传物质干扰噬菌体的入侵[10-12]。也就是说,当噬菌体入侵时,CRISPR/Cas系统的防御保护作用由RNA介导,是一种获得性免疫系统,初步验证了CRISPR/Cas系统的生物学功能。

图1 大肠杆菌iap基因重复序列比较[4]
1.2 CRISPR/Cas系统的分类
有一组保守的CRISPR相关基因与CRISPR的重复序列和间隔序列相邻,它们编码Cas蛋白,不同的Cas蛋白可能参与CRISPR/Cas系统作用的一个或多个阶段[6]。根据Cas蛋白的种类及组合的不同可将CRISPR/Cas系统分为三种主要类型:TypeⅠ、TypeⅡ和TypeⅢ,其中Cas1和Cas2蛋白在所有类型中都存在[13-14]。
Type Ⅰ的特征蛋白是一个大型蛋白Cas3(图2),具有单链解旋酶和DNase活性以及水解ATP的能力。Cas3将外源DNA作为目标,识别并解旋外源DNA的互补链,使其与crRNA配对形成R环结构,再利用核酸酶活性使非互补链断裂。TypeⅡ的特征蛋白是Cas9(图2),最典型的Cas9蛋白首次发现于酿脓链球菌(Streptococcuspyogenes)中,该蛋白中至少含有两个核酸酶结构域、一个类RuvC的核酸酶结构域(N端附近)和一个HNH核酸酶结构域[13]。双链RNA结构由反式作用crRNA(trans-activating crRNA,tracrRNA)与crRNA通过碱基互补配对形成,引导CRISPR相关蛋白Cas9在目标DNA中引入双链断裂,其中核酸酶结构域HNH裂解互补链,而类RuvC结构域裂解非互补链[13-14]。由于TypeⅡ免疫系统需要的Cas蛋白相对简单,因此CRISPR/Cas9系统是目前应用最普遍的系统。TypeⅢ型Cas蛋白又可分为两种亚型:TypeⅢ-A和TypeⅢ-B。TypeⅢ-A亚型的靶向是DNA;而TypeⅢ-B亚型的靶向是RNA,主要参与crRNA的成熟以及剪切外源入侵遗传物质[13],其特征蛋白为Cas10(图2)。
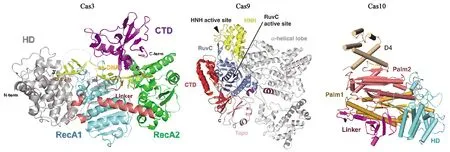
图2 Cas3[15]、Cas9[16]、Cas10[17]蛋白主要结构域
1.3 CRISPR/Cas及其衍生系统的作用机制
1.3.1CRISPR/Cas系统 CRISPR/Cas9系统作为研究最为深入且应用最为广泛的系统,主要由Cas9蛋白、crRNA和tracrRNA三部分组成。首先,tracrRNA和RNaseⅢ对precrRNA(precursor crRNA)进行加工得到成熟的crRNA,crRNA与tracrRNA互补配对后引导Cas9蛋白结合并剪切双链DNA[11],其中Cas9蛋白通过与目标序列3′端的PAM序列(通常为“NGG”)进行识别。为了使CRISPR/Cas9系统的使用更加地简便,研究者将crRNA和tracrRNA合并设计成一个sgRNA(single guide RNA),经验证sgRNA能引导Cas9蛋白切割双链DNA[14-18]。Cas9蛋白与目标DNA结合后,利用核酸内切酶活性切割靶序列,产生DNA双链断裂(double-strand break,DSB)。而修复DSB有两种方式[19]:一种是自然条件下的非同源末端连接(nonhomologous end-joining,NHEJ)方式,修复概率高,但修复过程容易出错,如引入个别碱基的插入、缺失或替换;另一种方式是同源重组修复(homology-directed repair,HDR),可以将外源DNA供体片段重组整合到DNA双链断裂的位置,但在自然条件下出现的概率较低,所以细胞修复DSB的方式主要为NHEJ[18](图3)。这两种DSB修复方式在真核生物细胞中高度保守,因此,在很多物种中均可以进行精确的基因编辑[20]。
另一种使用较为广泛的是CRISPR/Cas12a系统(也称CRISPR/Cpf1),能特异性识别5′端连续2个或3个胸腺嘧啶(T)的PAM序列[21]。相较于CRISPR/Cas9系统,CRISPR/Cpf1系统不需tracrRNA参与,仅需在crRNA引导下即可对DNA双链进行切割;且该系统中crRNA比sgRNA更短,其蛋白也比Cas9蛋白更小,有助于构建装载量小和多基因编辑的载体[22-23]。
1.3.2CRISPR/Cas衍生系统 科学家们还开发出了不依赖DSB的CRISPR/Cas系统,包括碱基编辑器[24]和引导编辑器[25]等在内的精准基因编辑系统。
目前常用的碱基编辑系统主要有胞嘧啶碱基编辑器(cytosine base editor,CBE)和腺嘌呤碱基编辑器(adenine base editor,ABE)(图3),这两类碱基编辑系统主要利用胞嘧啶脱氨酶或腺嘌呤脱氨酶与Cas9缺口酶(nicking Cas9,nCas9)融合,融合蛋白在sgRNA介导下对靶位点进行精准的碱基编辑,最终实现C·G碱基对向T·A碱基对的转换或A·T碱基对向G·C碱基对的转换。虽然碱基编辑器是可用于进行碱基转换的强大工具,但不能用于进行碱基颠换、插入或缺失。因此,在植物中寻找可使用的新型基因组工程方法显得尤为重要。
Anzalone等[25]开发的引导编辑器(prime editors,PEs)(图3)能弥补碱基编辑器存在的问题。PEs系统由nSpCas9(H840A)、引导编辑向导RNA(prime editing extended guide RNA,pegRNA)和逆转录酶M-MLV(moloney murine leukemia virus reverse transcriptase)三部分组成。其中,pegRNA是在gRNA序列的3′末端添加引物结合位点(prime binding sites,PBS)和携带编辑信息的逆转录(reverse transcription,RT)模板。PEs系统是切口酶H840A-逆转录酶M-MLV融合蛋白,主要在pegRNA介导下进行编辑,可在植物基因组的特定位点引入碱基-碱基转换或少量碱基的定点缺失和插入,也可以在没有供体DNA或双链断裂的情况下对哺乳动物细胞中的碱基进行编辑,这种编辑器将基因组编辑提升到了一个新的水平。另外,Lin等[26]对一种引导编辑系统(prime editing system,PPE)进行优化,通过密码子、启动子和编辑条件优化调整了启动子编辑器在植物中的应用,编辑效率高达21.8%。尽管PPE系统的效率低于碱基编辑器,但在开展植物育种和功能基因组学研究中具有巨大的潜力。
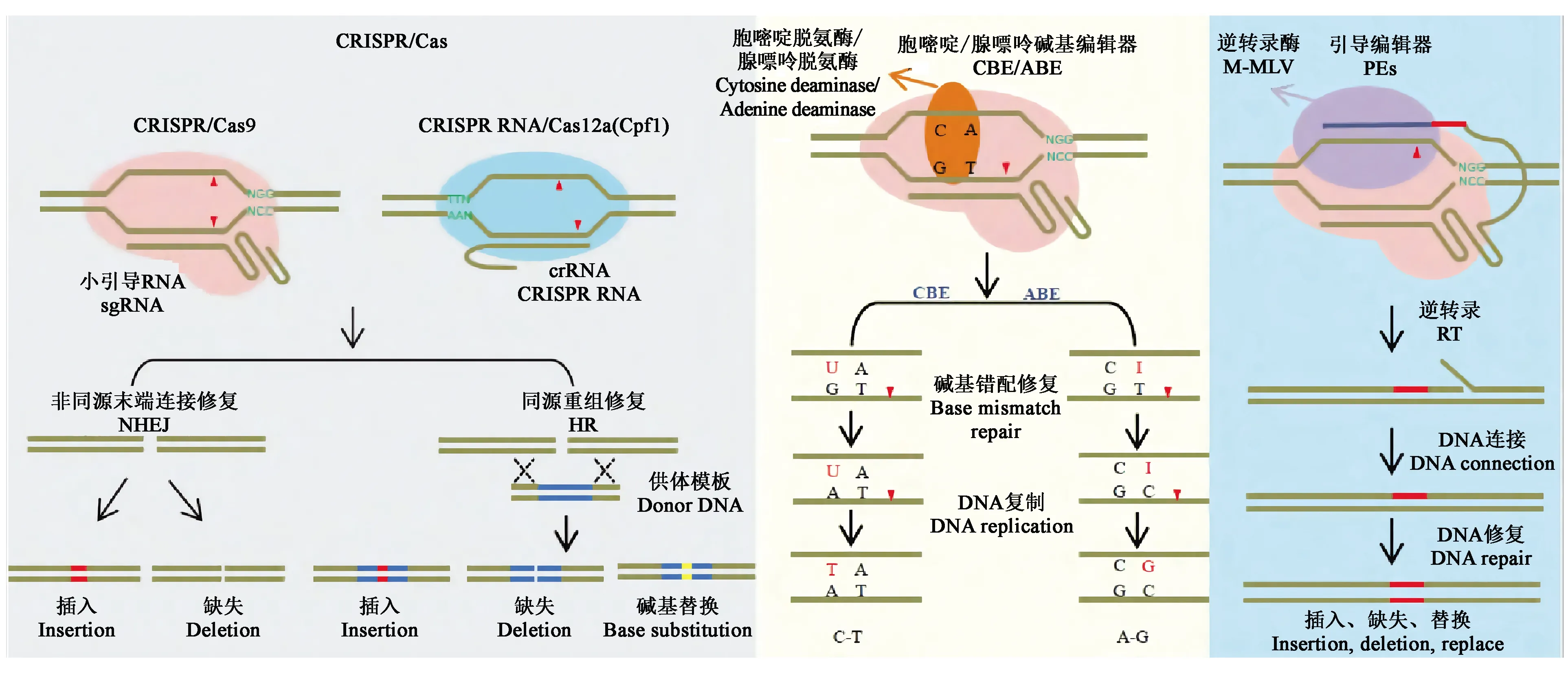
图3 CRISPR/Cas系统及衍生技术示意图[23]
2 CRISPR/Cas9系统的应用
2013年,Li等[27]利用CRISPR/Cas9基因编辑技术在拟南芥和烟草中进行基因精准编辑,首次在植物基因组中运用CRISPR/Cas9系统且验证了其在植物基因编辑方面的可行性。随后,研究人员也陆续在不同植物中开展CRISPR/Cas9系统的应用研究。目前,该系统还处于初始应用阶段,随着技术的不断完善进步,它将会改变传统育种方式,在植物性状改良、加快育种进程等方面发挥重要作用。
2.1 在农作物基因编辑中的应用
与传统育种方法相比,CRISPR/Cas系统能快速精准改良目标性状、显著缩短育种周期。目前,CRISPR/Cas系统在改良作物产量、品质、抗病性和抗除草剂以及基因功能研究中均起到了重要作用。
王加峰等[28]利用CRISPR/Cas9系统靶向突变了调控水稻千粒重的TGW6基因,结果表明,T1代纯合缺失突变体千粒重显著增加。Li等[29]以中花11作为转化材料定点敲除了Gn1a、DEP1、GS3及IPA1基因,T2代纯合缺失突变体植株的籽粒数目及籽粒长度显著增加。改变细胞分裂素稳态可提高谷物产量,Wang等[30]和Zhang等[31]对小麦、水稻中的细胞分裂素激活酶通过编辑或敲除编码细胞分裂素氧化酶/脱氢酶(CKX)基因均得到了高产的株系[30-31]。
研究者利用CRISPR/Cas9系统对作物的品质进行改良,如对水稻的香气基因OsBADH2进行编辑,获得了香米突变体[32],加快了香稻的育种进程;山东省农业科学院作物研究所小麦分子育种创新团队利用农杆菌介导的CRISPR/Cas9系统分别对与面粉吸水率密切相关的Pinb基因、与淀粉品质相关的Waxy基因、与面团褐变相关的Ppo基因以及面粉黄色素含量相关的Psy基因进行精准打靶,获得了一批具有新优异等位基因的小麦新资源[33]。Waltz[34]定向突变了双孢菇(Agaricusbisporus)的多酚氧化酶基因PPO,发现突变体材料的多酚氧化酶活性降低了30%,抗褐变能力得到显著提高。此外,该系统还有助于培育富含类胡萝卜素[35]和γ-氨基丁酸[36]、减少植酸[37]和高油酸含量[38]的优质作物。
利用CRISPR/Cas9系统修饰相关基因可获得抗性植株。袁隆平团队与Tang等[39]通过靶向敲除水稻中与镉离子吸收和积累相关的基因,得到了对抗镉毒害的水稻品种。试验表明,对水稻中的SWEET11、SWEET13和SWEET14基因的启动子进行突变,可产生具有广谱抗性的水稻品系[40]。敲除植物敏感基因也是产生广谱病毒抗性的有效途径,如敲除黄瓜eIF4E基因,可以使黄瓜获得对马铃薯病毒的广谱抗性[41]。
编辑除草剂靶向基因也可以获得内源抗性的作物。Li等[42]以NHEJ修复方式对水稻EPSPS基因保守区域两个重要氨基酸进行定点置换,T0代即得到了抗草甘膦的水稻突变体;Zhang等[43]通过CRISPR/Cas9系统诱导小麦A1992V取代ACCase获得了抗喹禾灵小麦。
CRISPR/Cas9系统可同时对多个基因进行编辑,因此,基于CRISPR/Cas9系统的多基因编辑技术应运而生,Shan等[44]运用CRISPR/Cas9系统对水稻的四个基因进行定点编辑,得到了白化且矮化的T1代植株。CRISPR/Cas9系统编码优化RNA时也可以同时在多个位点产生突变,且这种突变能够正常遗传给后代[45];Ma等[20]同时对水稻中7个基因进行敲除;Yu等[46]通过CRISPR/Cas9系统同时对拟南芥中多个基因编辑得到了传统杂交难以得到的三基因突变体。由此可见,多基因编辑技术尤其适用于家族成员多或功能冗余的基因功能研究。
2.2 在林木基因编辑中的应用
与农作物相比,传统林木育种具有育种周期长、遗传背景复杂等生物学特点,导致林木遗传改良的进程缓慢。将CRISPR/Cas9系统应用于林木改良极大地促进了林木基因组功能和遗传改良的研究进程。
杨树作为林木中的模式植物,CRISPR/Cas9系统在杨树功能基因组研究和基因工程育种中都有着广泛的应用。2015年,Fan等[47]利用该系统靶向敲除了毛白杨(Populustomentosa)的八氢番茄红素脱氢酶基因(phytoenedesaturase,PDS)获得白化表型植株。同年,Zhou等[48]利用该系统成功靶向编辑种间杂种银灰杨(P.tremula×alba)中4CL1和4CL2基因,突变体茎秆呈红褐色,且发现SNP接近或位于PAM位点内时能完全抑制基因打靶作用。对参与调控杨树侧芽发生的直系同源基因BRC1和BRC2进行靶向敲除时,BRC2基因突变体的分支数显著多于野生型,且在茎节处产生异位叶片;BRC1基因突变体的分支数也明显增加;由此表明,BRC1和BRC2参与调控杨树侧芽发生,且有着不同的作用机制和表达模式[49]。由CRISPR/Cas9介导产生的杨树NST/SND同源基因四重突变体的木质部和韧皮部部分细胞缺少次生细胞壁,包括木纤维细胞、木射线薄壁细胞和韧皮纤维细胞,导致该突变体几乎无法直立,由此说明NST/SND同源基因参与杨树次生壁的形成[50]。综上所述,CRISPR/Cas9系统可快速高效地敲除两个以上内源基因,从而获得多重突变体杨树株系,为开展基因功能研究和杨树遗传改良奠定了基础。
近年来,CRISPR/Cas9系统被用于林木抗病性、生长发育和果实品质等特性的改良[51]。在柑橘属(Citrusspp.),应用CRISPR/Cas9定向编辑柑橘中调控溃疡病感病反应的关键基因CsLOB1及其启动子序列,提高了柑橘对溃疡病的抗性[52]。Charrier等[53]首次利用CRISPR/Cas9系统定向突变梨树的PcTFL1.1基因,获得了花期提前的突变体植株。Chang等[54]利用CRISPR/Cas9系统同时对石榴中的两个UDP-糖基转移酶基因PgUGT进行编辑,突变体安石榴苷的含量降低了40%。
咖啡、可可和橡胶树的CRISPR/Cas9基因编辑系统也相继被建立。利用CRISPR/Cas9系统靶向编辑咖啡树CcPDS基因,得到表型黄化、弱小的纯合突变体[55]。可可黑果病可造成可可大面积减产,研究表明,降低可可TcNPR3基因的表达有利于提高可可对疫霉菌的抗性[56],从而降低黑果病的得病率。Fister等[57]发现在可可离体叶片上注射含CRISPR/Cas9基因编辑载体的农杆菌,48 h后接种疫霉菌后,实验组的病斑面积较对照组显著减小。Fan等[58]率先建立了橡胶树CRISPR/Cas9系统,直接传递CRISPR/Cas9核糖核蛋白(ribose nucleoprotein,RNPs)在橡胶树中靶向诱变,以橡胶树FT和TFL基因为靶点,设计了5种sgRNA,利用PEG介导法将含有Cas9-sgRNA重组质粒导入橡胶的原生质体中,靶向突变频率为3.74%~20.11%。
3 CRISPR/Cas9系统的优化与发展
尽管CRISPR/Cas9基因编辑技术发展迅速,且得到了广泛应用,但目前,该系统一些技术方面的问题仍有待进一步改进和探讨:如脱靶现象、PAM区的限制性、编辑效率以及生物安全监管等。脱靶现象严重限制了该技术的应用。研究表明,通过使用合适的Cas蛋白或提高sgRNA序列的特异性可降低或者消除脱靶现象[59];靶点GC含量在50%~70%时打靶效率较高[20]。有效拓展CRISPR系统PAM位点范围是该技术在育种中广泛应用的关键所在。由于Cas9需要靶位点NGG的PAM序列,限制了基因组中靶位点选择的自由度,为解决此问题,开发出了可增强基因组编辑范围的新型CRISPR/Cas9工具。虽然来自酿脓链球菌的Cas9(SpCas9)使用最广泛,但是仅极少数DNA序列符合靶位点旁边存在两个G碱基这一特殊要求。Chatterjee等[60]从犬链球菌(Streptococcuscanis)中鉴定出Cas9(ScCas9),发现ScCas9具有更广泛地靶向DNA序列的能力;Cas9酶将靶向位置从最初基因组上的10%位点扩大到将近50%;并进一步设计出具有增强基因组编辑能力的新蛋白,极大地拓宽了DNA序列[61-62]。人工改造的变体xCas9、SpCas9-NG[63]和SpRY[64]也极大地扩展了CRISPR/Cas系统的编辑范围。提高同源重组(homologous recombination,HDR)效率也至关重要,Aird等[65]将供体DNA与Cas9/gRNA核糖核蛋白复合体连接,使DSB处供体DNA的浓度增加,从而提高Cas9介导的同源重组修复效率。
相较于草本植物和农作物,木本植物中CRISPR/Cas9系统的应用尚处于基因编辑体系建立的初步阶段。除上述几种普遍存在的问题外,林木自身特性也存在一些限制:①木本植物sgRNA在线设计软件数据库较少,因此,建立针对木本植物的sgRNA设计和检测脱靶效应的公共网络平台,收集并建立更多树种的基因组数据库能显著提高CRISPR/Cas9系统在林木林木遗传育种的应用效率[66];②传统遗传转化方法常伴有外源基因的插入,生长周期较短的植物可通过后代分离群体获得无外源基因污染的转化植株,但木本植物普遍采用无性繁殖方式且生长周期较长,其突变体后代通常带有外源DNA的污染,由此可能会产生基因污染等生态风险问题。向细胞内导入Cas9/sgRNA核糖核蛋白复合物可解决外源DNA污染问题,但多数木本植物的组培再生体系或稳定的遗传转化体系还未完全完善,极大地限制了CRISPR系统在林木中的应用,因此,建立和完善木本植物原生质体制备及再生体系将促进基因编辑育种在林木中的应用[66]。
CRISPR/Cas系统作为一项变革性的新兴技术,随着基因编辑技术的普及可能导致生物安全监管困难等问题。各国都没有现成的监管经验,在技术监管和风险防控上均保持较高的谨慎态度。近期开发的一种外源成分检测器(foreign element detector,FED)可在外源成分信息未知的情况下对全基因组重测序数据进行分析,可精确鉴定出外源成分的片段长度及在基因组上的插入位置,为全球基因组编辑产品的应用和安全监管提供了一个重要工具平台[67]。我国基因编辑技术的研发虽然居全球领先地位,但仍然尚未出台基因编辑产品的相关管理政策,其相关产业面临技术领先、管理滞后、应用空白的局面。该平台的建立有望为我国基因编辑产品的开发和应用提供安全保障。
4 展望
CRISPR/Cas系统是一种功能强大的基因组编辑系统,它对基因功能研究以及作物性状的遗传改良具有重要意义,显著促进了植物科学的快速发展。虽然目前该编辑系统还存在很多不足,但其相较于传统育种的优势显而易见,尤其在林木育种方面,将极大地缩短林木育种周期,对林木基因功能研究也起到巨大的推动作用。经过优化和改良的CRISPR/Cas基因编辑系统将成为培育植物新品种的主要手段之一,在植物遗传改良方面具有广阔的发展和应用前景。
