神经生长因子过表达的人脐带血间充质干细胞来源外泌体修复大鼠坐骨神经慢性压迫损伤的效果及作用机制研究
2021-12-24郑良良张弛
郑良良,张弛
(金华市中心医院,浙江 金华 321000)
神经损伤包括中枢神经损伤和外周神经损伤,坐骨神经损伤是常见的外周神经损伤,多由慢性疾病导致[1-2]。神经损伤的修复始终是临床上的热点和难点问题。目前,临床常采用电疗法、营养神经药物疗法及干细胞移植疗法等[3-4]。干细胞具有多向分化潜能,如人脐带血间充质干细胞(human umbilical cord blood-derived mesenchymal stem cells,hUCB-MSCs)可以分化为脂肪细胞和神经细胞等[5-6]。但干细胞易老化且分化方向不易控制,限制了干细胞在神经损伤修复中的广泛应用[7-8]。外泌体(exosome,Exo)是一类由细胞分泌的具有双层磷脂结构的囊泡,其携带大量遗传物质,能够通过膜融合和胞吞的方式,将遗传信息传递至受体细胞中,影响受体细胞的增殖、分化[9-12]。神经生长因子(nerve growth factor,NGF)是由神经元分泌的重要生长因子,能够促进神经元增殖和分化。研究表明,NGF能够促进骨髓间充质干细胞向神经元分化,具有保护神经胶质细胞的作用[13]。为了探究NGF过表达的hUCB-MSCs来源Exo(NGF-hUCB-MSCs-Exo)修复大鼠坐骨神经慢性压迫损伤(chronic constriction injury,CCI)的效果及作用机制,我们围绕NGF-hUCB-MSCs-Exo开展了相关的实验研究,现总结报告如下。
1 材料和仪器
1.1 实验材料hUCB-MSCs(中国科学院上海生命科学研究院生物化学与细胞生物学研究所)。雄性Sprague Dawley大鼠(浙江中医药大学实验动物中心),均为无特定病原体动物,年龄(3.46±0.12)周,体质量(255±32)g,实验动物许可证:SYXK(浙)2019-0024。实验方案经金华市中心医院医学动物实验伦理委员会审查通过。
1.2 实验试剂胎牛血清和DMEM培养基(美国Gibco公司),非特异性兔抗鼠CD34、CD45、CD90和CD105一抗(英国Abcam公司),荧光素标记整合素avb3抗体免疫球蛋白(immunoglobulin,Ig)G、多聚甲醛、磷钨酸溶液、辣根过氧化物酶标记的山羊抗鼠IgG二抗、罗丹明标记鬼笔环肽、水合氯醛、增强型DAB显色试剂盒(北京伊塔生物科技有限公司),基因合成引物、重组慢病毒载体由上海吉凯基因生物科技有限公司制备,放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液(上海梵态生物科技有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(上海吉至生化科技有限公司),兔抗鼠CD63、CD9、CD81、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、白细胞介素(interleukin,IL)-1、半胱氨酸天冬氨酸蛋白酶(cysteine aspartic acid specific protease,Caspase)-1、Caspase-3和β-肌动蛋白(β-actin)一抗(英国Abcam公司),SuperSignalTMWest Femto最大灵敏度底物(上海研卉生物科技有限公司),PKH67荧光探针细胞膜染色试剂盒(上海西格生物科技有限公司),4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色液、末端脱氧核苷酸转移酶、生物素化鼠抗地高辛(北京百奥莱博科技有限公司),抗荧光淬灭剂(北京雷根生物技术有限公司),4.0铬制羊肠线(上海金环生物有限公司),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、蛋白酶K(北京索莱宝科技有限公司),ECL化学发光试剂盒(北京碧云天试剂公司)。
1.3 实验仪器流式细胞仪(美国NovoCyte公司),倒置荧光显微镜(日本奥林巴斯公司),透射电子显微镜(北京欧波同光学技术有限公司),凝胶成像分析系统(杭州申花科技有限公司),IITC动物热痛刺激仪(美国IITC公司)。
2 方 法
2.1 hUCB-MSCs的鉴定取第2代hUCB-MSCs接种于25 mL培养瓶中。待细胞汇合率达到80%~90%时,向培养瓶中加入1 mL胰蛋白酶溶液(0.25%),消化1~2 min后,加入1 mL含胎牛血清的DMEM培养基终止消化反应。轻轻吹打悬浮细胞后,转入 5 mL 的无菌离心管,以1200 r·min-1(离心半径:5 cm)离心8 min。去上清,PBS洗涤2次,用含胎牛血清的DMEM培养液进行重悬,调整细胞浓度至1.0×106~1.0×107个·mL-1。取100 μL细胞液至EP管,依次加入非特异性兔抗鼠CD34、CD45、CD90和CD105一抗(稀释比例为1∶5000)各100 μL,于室温避光孵育35 min,以1200 r·min-1(离心半径:5 cm)离心8 min。去上清,PBS洗涤2次,加入 500 μL PBS悬浮。加入20 μL荧光素标记整合素avb3抗体IgG,常温下避光孵育30 min,1200 r·min-1(离心半径:5 cm)离心8 min,去上清,PBS洗涤3次。以PBS悬浮细胞,加入500 μL 1%多聚甲醛溶液,加入流式管中,采用流式细胞仪检测hUCB-MSCs的表面蛋白CD34、CD45、CD90和CD105的表达。
2.2 重组慢病毒的构建与转染
2.2.1NGF过表达慢病毒载体的构建 根据NGF基因序列(5’-TGGCTGGTCCT-3’)设计NGF基因合成引物:正义链为5’-ACCTGCCATTGCCT-3’,反义链为5’-TTGCTAGTGCCTCGA-3’。采用LV3载体构建NGF过表达慢病毒载体,并进行慢病毒包装。
2.2.2重组慢病毒的转染 取2 mL培养至第2代的hUCB-MSCs接种于6孔板中,于温度37 ℃、CO2浓度5%的细胞培养箱中培养。待细胞汇合率达50%时,根据慢病毒转染说明书进行慢病毒转染,感染复数为50,慢病毒滴度为3.0×107转导单位(transducing units,TU)·mL-1。转染72 h后,于倒置荧光显微镜下观察并测定hUCB-MSCs转染率,随机选择5个区域,统计细胞数量。hUCB-MSCs转染率=荧光视野细胞数/白光视野细胞数×100%。
2.3 NGF-hUCB-MSCs-Exo的提取和鉴定
2.3.1NGF-hUCB-MSCs-Exo的提取 重组慢病毒转染72 h,弃去培养基,PBS洗涤3次,加入2 mL DMEM培养基,于温度37 ℃、CO2浓度5%的细胞培养箱中孵育48 h。收集培养液,于4 ℃条件下以 300 r·min-1(离心半径:5 cm)离心10 min;转移上清于离心管,于4 ℃条件下以2000 r·min-1(离心半径:5 cm)离心20 min;取上清,经0.22 μm过滤器过滤后转移至离心管中,于4 ℃条件下以10 000 r·min-1(离心半径:5 cm)离心70 min;取沉淀,PBS洗涤1次,于4 ℃条件下以10 000 r·min-1(离心半径:5 cm)离心70 min;小心弃去上清,即得到NGF-hUCB-MSCs-Exo沉淀,于-80 ℃冰箱中保存备用。
2.3.2NGF-hUCB-MSCs-Exo形态的鉴定 在NGF-hUCB-MSCs-Exo沉淀中加入100 μL PBS重新悬浮NGF-hUCB-MSCs-Exo,取30 μL NGF-hUCB-MSCs-Exo悬液,置于载样铜网上,室温下静置3 min,加入30 μL磷钨酸溶液(3%)进行染色,5 min 后弃去染色液,室温下静置至铜网干燥,采用透射电子显微镜观察NGF-hUCB-MSCs-Exo形态。
2.3.3NGF-hUCB-MSCs-Exo标志蛋白的鉴定分别取一定量的hUCB-MSCs悬液和NGF-hUCB-MSCs-Exo悬液于EP管,置于冰上预冷,采用RIPA裂解液分别提取hUCB-MSCs和NGF-hUCB-MSCs-Exo总蛋白。采用BCA蛋白浓度测定试剂盒测定蛋白浓度,调整蛋白上样量为30 μg,采用SDS-PAGE分离蛋白。电泳结束后,采用电转移的方式将凝胶上的蛋白转到聚偏氟乙烯膜。将膜浸入封闭液中,在室温下于摇床上封闭2 h;加入兔抗鼠CD63、CD9、CD81和GAPDH一抗(稀释比例为1∶10000),4 ℃ 过夜孵育;用TBST缓冲液洗膜3次,每次5 min;加入辣根过氧化物酶标记的山羊抗鼠IgG二抗(稀释比例为1∶2000),室温避光孵育10 min;用TBST缓冲液洗膜3次,每次5 min;加入SuperSignalTMWest Femto最大灵敏度底物,于凝胶成像分析系统显影并拍照。
2.4 hUCB-MSCs摄取内化NGF-hUCB-MSCs-Exo的观察在NGF-hUCB-MSCs-Exo沉淀中加入100 μL PBS重新悬浮NGF-hUCB-MSCs-Exo,加入4 μL PKH67荧光探针溶液,于室温下孵育 10 min;加入1 mL的10%BSA溶液,采用超速离心法收集PKH67标记的NGF-hUCB-MSCs-Exo以备用。将hUCB-MSCs分为对照组和实验组,分别接种于预先铺有盖玻片的24孔板中,每孔接种300 μL细胞液(细胞浓度约1.0×106个·mL-1),每组接种 3个复孔。待贴壁细胞占爬片面积的60%以上,弃去培养基,PBS洗涤3次。实验组中加入100 μL PKH67标记的NGF-hUCB-MSCs-Exo混悬液,对照组加入100 μL PBS,置于温度为37 ℃、CO2浓度5%的细胞培养箱中孵育12 h。孵育后加入10 μL的鬼笔环肽,室温下避光孵育20 min,弃去染色剂,PBS洗涤3次,使用4%的多聚甲醛溶液固定30 min;再加入适量的DAPI染色液,室温下避光孵育15 min;PBS洗涤3次;加入抗荧光淬灭剂,指甲油封片,于荧光显微镜下观察。
2.5 NGF-hUCB-MSCs-Exo修复大鼠坐骨神经CCI的观察
2.5.1造模及模型鉴定方法 取大鼠20只,随机取15只构建坐骨神经CCI模型,另外5只不做处理。于大鼠腹腔注射3%水合氯醛麻醉,用量0.4 mL·kg-1。麻醉后于右下肢背侧做2 cm纵形切口,逐层切开皮肤、皮下组织,钝性分离股二头肌,暴露坐骨神经主干。采用4.0铬制羊肠线环扎坐骨神经,环绕4圈,每圈间距1 mm,松紧度以单环恰可上下活动为度;注意保护神经外膜血供。碘伏消毒,逐层缝合切口。分别于术后第1天、第3天、第5天、第7天采用IITC动物热痛刺激仪测定大鼠机械刺激缩足反射阈值(paw withdrawal mechanical threshold,PWMT)和热刺激缩足反射潜伏期(paw withdrawal thermal latency,PWTL)。
2.5.2Exo与hUCB-MSCs混合液的制备方法 根据方法2.2分别采用空载体慢病毒和重组慢病毒转染hUCB-MSCs,并制备空载体慢病毒转染hUCB-MSCs来源Exo(hUCB-MSCs-Exo)和NGF-hUCB-MSCs-Exo。取100 μL hUCB-MSCs-Exo和100 μL NGF-hUCB-MSCs-Exo分别与900 μL DMEM培养基混匀,分别加入至1 mL hUCB-MSCs(细胞浓度1.0×108个·mL-1),制成Exo与hUCB-MSCs混合液。
2.5.3干预方法 造模成功后,取未做处理的5只大鼠为正常对照组,不做任何处理;将15只坐骨神经CCI模型大鼠随机分为坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组。坐骨神经CCI模型组大鼠于尾静脉注射1 mL PBS,hUCB-MSCs-Exo注射组大鼠于尾静脉注射 1 mL hUCB-MSCs-Exo和hUCB-MSCs混合液,NGF-hUCB-MSCs-Exo注射组大鼠于尾静脉注射1 mL NGF-hUCB-MSCs-Exo与hUCB-MSCs混合液。每周注射1次,连续注射3周。将所有大鼠于温度20~25 ℃、相对湿度50%~65%条件下正常饲养。
2.6 NGF-hUCB-MSCs-Exo修复大鼠坐骨神经CCI的效果评价
2.6.1病理学检查方法 3周后处死大鼠,取L4~L5制备冷冻切片,切片厚度8μm,采用HE染色试剂盒进行染色,于显微镜下观察脊髓后角灰质的病理变化。采用Allen脊髓后角灰质病变评分标准[14]进行评分:0分,未观察到病变;1分,灰质中含有1~5个嗜酸性神经元;2分,灰质中含有6~10个嗜酸性神经元;3分,灰质中含有10个以上嗜酸性神经元;4分,灰质梗死灶面积<灰质面积的1/3;5分,灰质面积的1/3≤灰质梗死灶面积<灰质面积的1/2;6分,灰质梗死灶面积≥灰质面积的1/2。
2.6.2细胞凋亡检测方法 采用TUNEL染色法评估L4~L5脊髓组织的细胞凋亡情况。取L4~L5制备冷冻切片,放置于载玻片,采用4%多聚甲醛固定 30 min,PBS洗涤3次,每次5 min。加入一定量的含有20 μg·mL-1蛋白酶K溶液,于室温下孵育 15 min,PBS洗涤3次,每次5 min。加入3%H2O2溶液孵育5 min,PBS洗涤3次,每次5 min。再加入末端脱氧核苷酸转移酶缓冲液孵育1 h,PBS洗涤3次,每次5 min。再加入生物素化鼠抗地高辛溶液孵育 30 min,PBS洗涤3次,每次5 min。采用增强型DAB显色试剂盒显色。于显微镜下观察,随机选择5个区域,统计细胞总数及凋亡细胞数量。细胞凋亡率=凋亡细胞数/细胞总数×100%。
2.6.3炎症反应和细胞凋亡相关基因的蛋白表达分析方法 收集各组大鼠脊髓组织各1 mg,分别加入 1 mL RIPA裂解液,于冰上裂解30 min。转移至 1.5 mL 离心管,在4 ℃下以5000 r·min-1(离心半径:10 cm)离心5 min;取上清,在4 ℃下以12 000 r·min-1(离心半径:10 cm)离心10 min;取沉淀,加入100 μL PBS重悬后,取1 μL重悬液测定蛋白浓度,剩余加入上样缓冲液,采用SDS-PAGE分离蛋白。将凝胶上的蛋白转移至聚偏氟乙烯膜,加入2 mL 5%脱脂奶粉溶液封闭30 min,分别加入100 μL兔抗鼠NLRP3、IL-1β、Caspase-1、Caspase-3和β-actin一抗稀释液(稀释比例1∶10 000)于封闭液中,于4 ℃避光孵育过夜。PBST洗膜3次,每次5 min。将ECL化学发光试剂盒中的A液和B液等比例混合后,加在膜上进行显色。拍照后采用Image-J图像处理软件处理图片,提取蛋白条带灰度值,比较蛋白表达水平。
2.7 数据统计采用SPSS16.0统计软件对所得数据进行统计学分析。坐骨神经CCI模型大鼠与正常大鼠不同时间点PMWT、PWTL的组间比较均采用t检验;正常对照组、坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠Allen脊髓后角灰质病变评分、脊髓组织细胞凋亡率以及脊髓组织中NLRP3、IL-1β、Caspase-1、Caspase-3的蛋白表达量的组间比较均采用单因素方差分析,组间两两比较均采用q检验。检验水准α=0.05。
3 结 果
3.1 hUCB-MSCs鉴定结果流式细胞仪检测第2代hUCB-MSCs,CD34阳性率0.4%,CD45阳性率0.6%,CD90阳性率95.8%,CD105阳性率98.3%,符合hUCB-MSCs表面蛋白表达特征。
3.2 重组慢病毒转染hUCB-MSCs结果重组慢病毒转染72 h,hUCB-MSCs转染率(89.22±6.91)%(图1)。
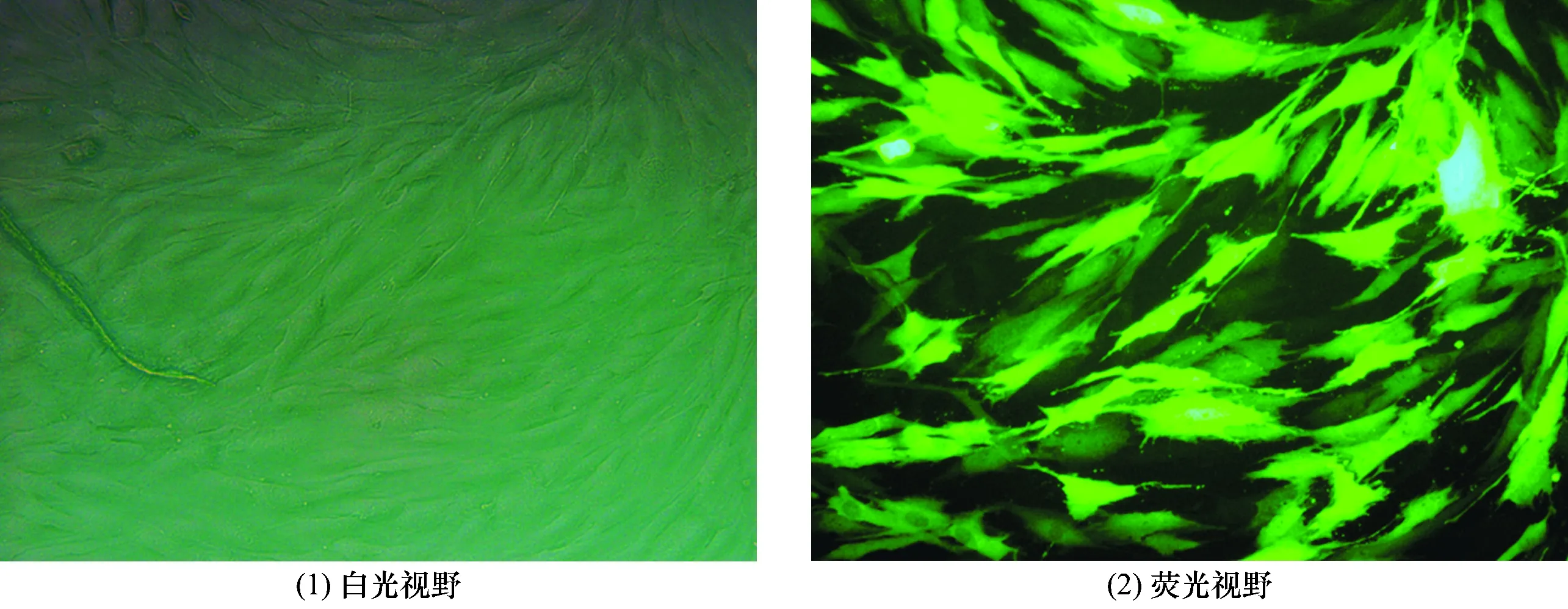
图1 重组慢病毒转染72 h后的脐带血间充质干细胞(×400)
3.3 NGF-hUCB-MSCs-Exo鉴定结果透射电子显微镜结果显示,NGF-hUCB-MSCs-Exo为杯口状结构(图2)。蛋白印迹法检测结果显示,NGF-hUCB-MSCs-Exo标志蛋白CD63、CD9和CD81表达量高于hUCB-MSCs,表明Exo提取成功(图3)。
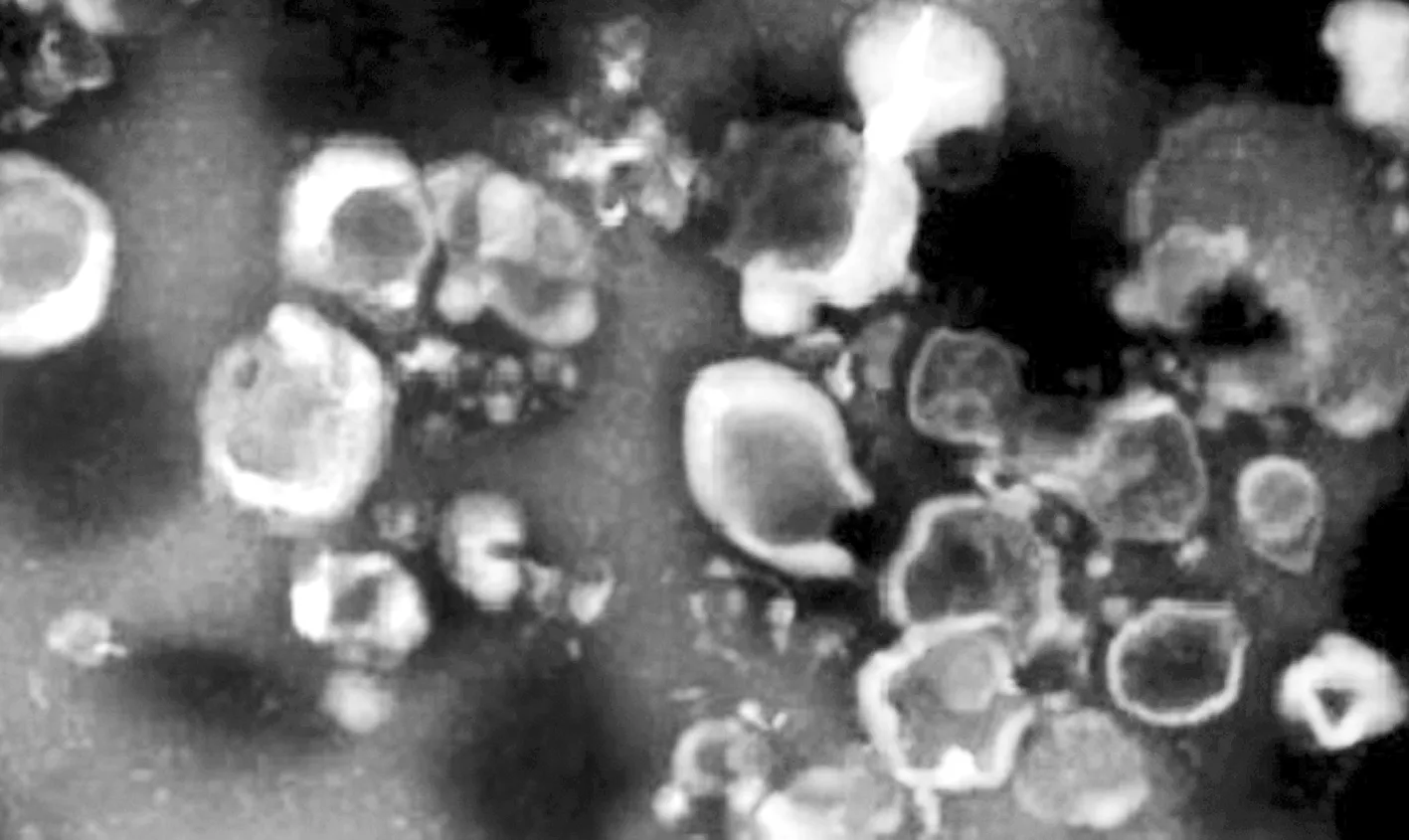
图2 透射电子显微镜下的外泌体(×200 000)

GAPDH:甘油醛-3-磷酸脱氢酶;①人脐带血间充质干细胞;②神经生长因子过表达人脐带血间充质干细胞来源外泌体。
3.4 hUCB-MSCs摄取及内化NGF-hUCB-MSCs-Exo观察结果hUCB-MSCs与NGF-hUCB-MSCs-Exo共培养12 h后,观察到hUCB-MSCs摄取并内化NGF-hUCB-MSCs-Exo(图4)。
3.5 大鼠坐骨神经CCI模型鉴定结果术后第1天、第3天、第5天、第7天,坐骨神经CCI模型大鼠的PWMT和PWTL均低于正常大鼠,表明造模成功(表1)。
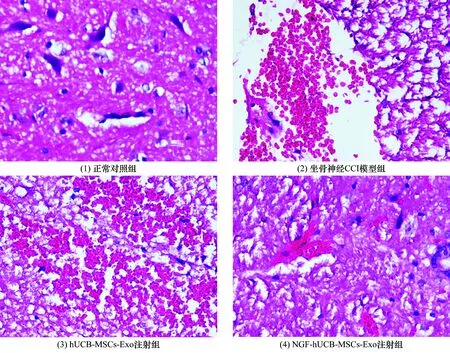
3.6 病理学检查结果正常对照组、坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠Allen脊髓后角灰质病变评分比较,差异有统计学意义[(0.32±0.04)分,(4.21±0.11)分,(4.09±0.15)分,(1.89±0.17)分,F=11.714,P=0.000]。坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠Allen脊髓后角灰质病变评分均高于正常对照组(q=2.783,P=0.015;q=3.921,P=0.000;q=3.784,P=0.000);hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠Allen脊髓后角灰质病变评分均低于坐骨神经CCI模型组(q=2.059,P=0.024;q=2.071,P=0.021);NGF-hUCB-MSCs-Exo注射组大鼠Allen脊髓后角灰质病变评分低于hUCB-MSCs-Exo注射组(q=2.809,P=0.013)。见图5。
3.7 细胞凋亡检测结果正常对照组、坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织细胞凋亡率比较,差异有统计学意义[(0.15±0.02)%,(8.98±0.37)%,(8.14±0.29)%,(3.46±0.31)%,F=9.908,P=0.012]。坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织细胞凋亡率均高于正常对照组(q=2.142,P=0.017;q=3.287,P=0.000;q=2.275,P=0.025);hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织细胞凋亡率均低于坐骨神经CCI模型组(q=2.021,P=0.021;q=2.086,P=0.024);NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织细胞凋亡率低于hUCB-MSCs-Exo注射组(q=3.008,P=0.011)。见图6。
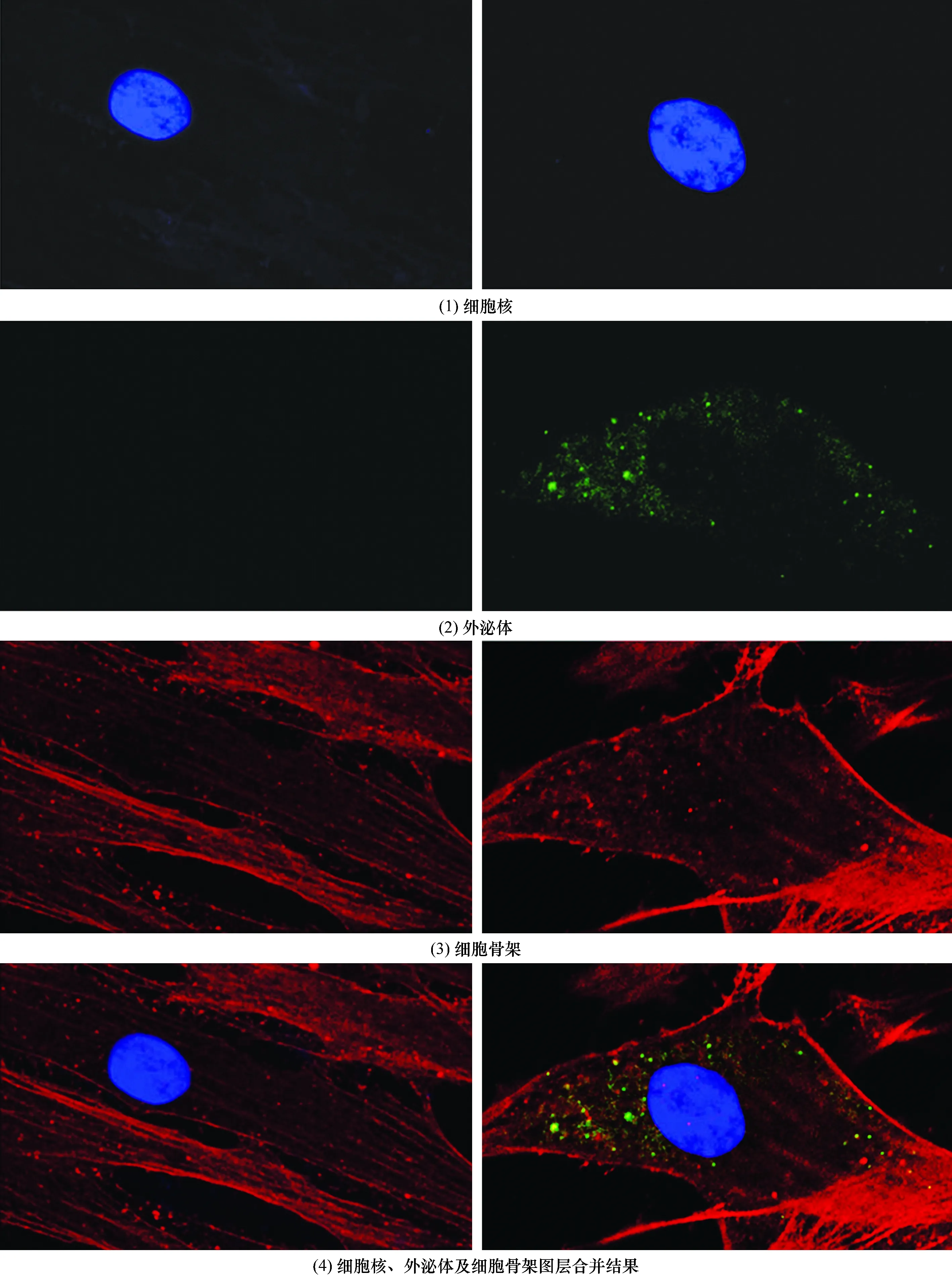
图4 荧光显微镜下间充质干细胞摄取及内化外泌体观察结果(×800)
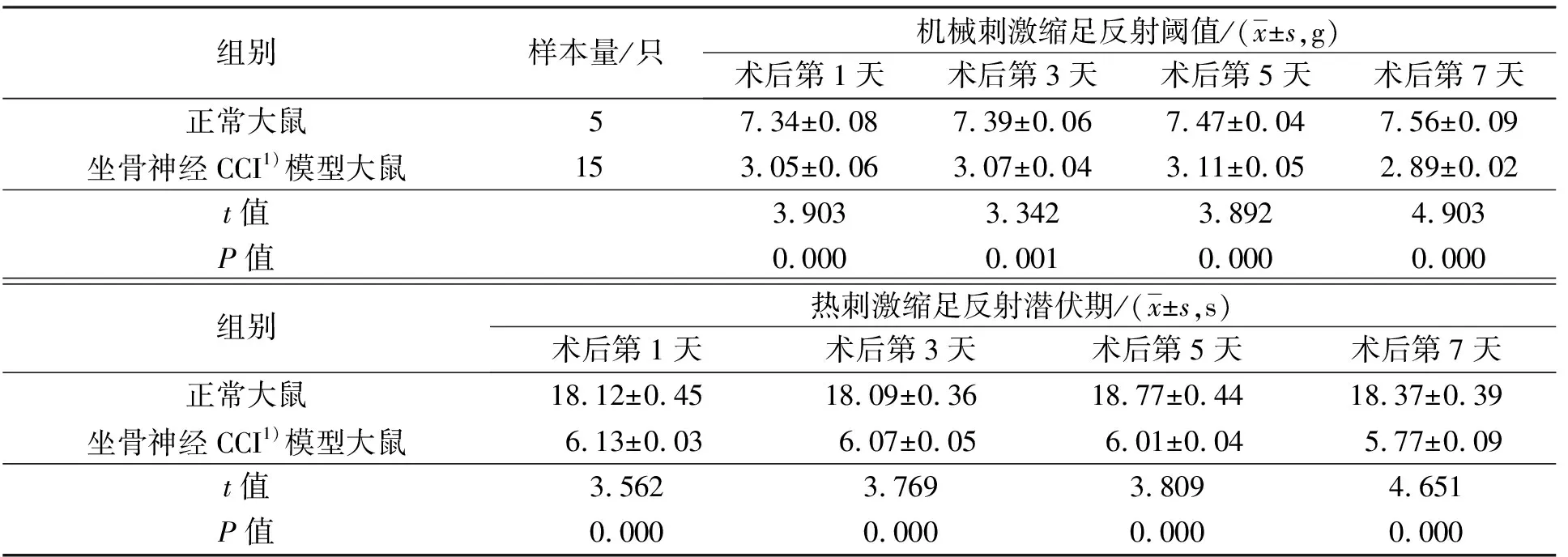
表1 2组大鼠术后机械刺激缩足反射阈值和热刺激缩足反射潜伏期
CCI:慢性压迫损伤;hUCB-MSCs:人脐带血间充质干细胞;Exo:外泌体;NGF:神经生长因子。
3.8 炎症反应及细胞凋亡相关基因的蛋白表达分析结果正常对照组、坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3蛋白表达量比较,组间差异均有统计学意义。坐骨神经CCI模型组、hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3蛋白表达量均高于正常对照组(坐骨神经CCI模型组:q=3.709,P=0.000;q=3.328,P=0.000;q=3.145,P=0.000;q=2.974;P=0.000;hUCB-MSCs-Exo注射组:q=2.893,P=0.019;q=2.944,P=0.013;q=3.008,P=0.009;q=3.852,P=0.000;NGF-hUCB-MSCs-Exo注射组:q=2.428,P=0.022;q=4.903,P=0.000;q=3.884,P=0.000;q=4.382,P=0.000);hUCB-MSCs-Exo注射组和NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3蛋白表达量均低于坐骨神经CCI模型组(hUCB-MSCs-Exo注射组:q=3.609,P=0.000;q=3.811,P=0.000;q=3.476,P=0.000;q=3.889,P=0.000;NGF-hUCB-MSCs-Exo注射组:q=2.338,P=0.000;q=3.098,P=0.000;q=2.358,P=0.000;q=3.775,P=0.000);NGF-hUCB-MSCs-Exo注射组大鼠的脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3蛋白表达量均低于hUCB-MSCs-Exo注射组(q=3.798,P=0.000;q=3.573,P=0.000;q=2.998,P=0.000;q=3.208,P=0.000)。见表2、图7。
4 讨 论
神经损伤的原因包括直接暴力和慢性疾病,其中腰椎间盘突出症、梨状肌综合征、肘管综合征等是导致神经损伤的常见慢性损伤性疾病[15-16]。神经损伤严重影响患者的生活质量,而神经损伤的修复较为缓慢,研究表明在无张力条件下神经损伤的最快修复速度是1~2 nm·d-1[17-18]。NGF是由神经元分泌的生长因子,是由α、β、λ 3个亚基构成的蛋白三聚体;

CCI:慢性压迫损伤;hUCB-MSCs:人脐带血间充质干细胞;Exo:外泌体;NGF:神经生长因子。
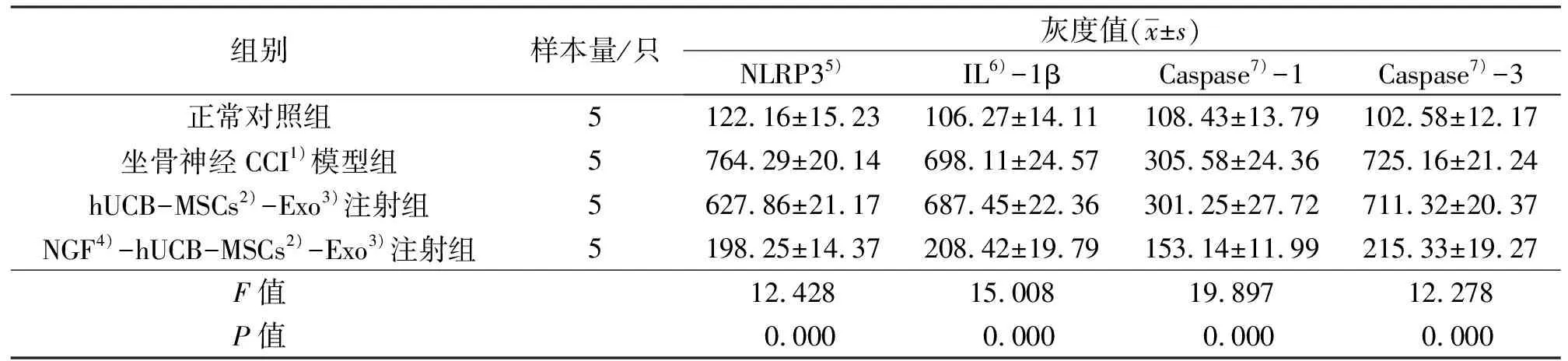
表2 4组大鼠脊髓组织中炎症反应及细胞凋亡相关基因蛋白表达量
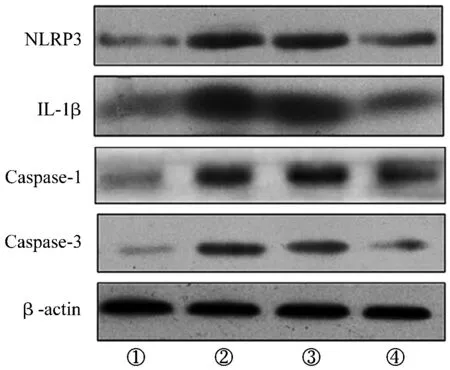
NLRP3:NOD样受体蛋白3;IL:白细胞介素;Caspase:兔抗鼠半胱氨酸天冬氨酸蛋白酶;β-actin:β-肌动蛋白;①为正常对照组;②为坐骨神经慢性压迫损伤模型组;③为人脐带血间充质干细胞外泌体注射组;④为神经生长因子过表达人脐带血间充质干细胞外泌体注射组。
其中β亚基与神经细胞的修复和再生密切相关[19]。研究表明,NGF可以与Trk蛋白相结合,通过MAPK信号通路调节神经细胞的增殖和分化[20]。干细胞具有多向分化潜能,在特定条件诱导下可向神经细胞分化,但NGF过表达干细胞存在易老化、传代后分化方向不确定等不足,难以充分发挥NGF的诱导作用。因此,从NGF过表达干细胞中提取Exo,可以利用Exo携带NGF基因信息的特点发挥长期诱导干细胞向神经细胞分化的作用。我们通过构建NGF过表达慢病毒载体,通过慢病毒将NFG基因导入hUCB-MSCs,并成功提取NGF-hUCB-MSCs-Exo,将NGF-hUCB-MSCs-Exo与hUCB-MSCs注入坐骨神经损伤的大鼠体内,发挥NGF诱导hUCB-MSCs向神经元分化的作用,进而修复大鼠坐骨神经损伤。研究结果表明,NGF-hUCB-MSCs-Exo能够抑制脊髓后角灰质发生病变、降低脊髓组织细胞凋亡率、抑制脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3等蛋白的表达,发挥修复神经损伤的作用,为临床神经损伤的治疗提供新的思路和方法。
坐骨神经损伤与神经组织中炎症因子的表达关系密切。陈亚军等[21]研究发现,炎症因子能够刺激大鼠脊髓小胶质细胞表达NLRP3炎症小体,进而引起大鼠神经性疼痛加剧。IL-1是由单核细胞产生的细胞因子,能促进免疫应答,参与炎症反应;其中IL-1β作为NLRP3的下游因子,可通过NLRP3/Caspase-1信号通路介导小鼠急性脊髓损伤的炎性疼痛反应[22]。Caspase家族是一类结构相似的蛋白水解酶,具有较高的同源性,在细胞程序性死亡过程中发挥着重要作用。Caspase-1是参与炎症反应信号通路的关键蛋白,其作为NLRP3的下游分子,在炎性反应的传递中发挥重要作用[23-24]。Caspase-3是细胞凋亡的执行者,能够促进细胞凋亡,其可被炎症反应、机械损伤等多种因素刺激而活化[25]。本研究结果表明,NGF-hUCB-MSCs-Exo注射组大鼠脊髓组织中NLRP3、IL-1β、Caspase-1和Caspase-3蛋白相对表达量显著低于坐骨神经CCI模型组和hUCB-MSCs-Exo注射组,提示NGF-hUCB-MSCs-Exo能够显著抑制坐骨神经CCI大鼠脊髓组织中的炎症反应和细胞凋亡。
本研究结果表明,NGF-hUCB-MSCs-Exo治疗大鼠坐骨神经CCI,能够抑制脊髓后角灰质病变和脊髓细胞凋亡,其作用机制可能与抑制NLRP3、IL-1β、Caspase-1和Caspase-3的表达有关。
