Cd胁迫下SA和NO互作对小麦幼苗根生长和叶绿素含量的影响
2021-12-24黎桂英王兆丰李嘉敏蒋晓煜杨颖丽
黎桂英,王兆丰,张 娅,李嘉敏,蒋晓煜,杨颖丽
西北师范大学生命科学学院, 兰州 730070
随着工业化进程的加快,我国环境遭到严重污染。《全国土壤污染状况调查公报》显示,我国土壤总污染率为16%,其中重金属污染约占全部污染的82%,尤以镉污染为重[1]。《中国生态环境状况公报》中也指出,重金属是影响农用土壤环境质量的主要污染物,其中镉为首要污染物[2]。过量的镉不仅对植物的生长发育造成严重的破环[3- 4],也严重威胁着人类的身体健康。
水杨酸(SA)作为一种酚类物质广泛存在于各种植物中,其在植物的种子萌发、呼吸、气孔关闭、开花和衰老等方面起着非常重要的作用[5- 6]。此外,SA也参与植物对生物和非生物胁迫的耐受性调节机制,如重金属胁迫[6- 8]。近年来,SA对植物Cd胁迫耐受性的调节机制成为研究者关注的热点,众多的研究者在对水稻、大麦、蓖麻、豌豆、小麦、亚麻、大豆和花生等多种植物研究时发现SA可以增强植物对Cd胁迫的耐受性[9- 16]。这种耐受性调节机制主要包括以下几个方面:稳定细胞膜的完整性[12- 14]、维持离子平衡[10,14]、影响其他激素的含量[13]、改变Cd的摄取和分配[15-16]、增强抗氧化防卫系统[9,12]、增强光合作用[11,13]以及调节其他的信号通路[9]等。一氧化氮(NO)是普遍存在于动植物中的一种活性分子,它可以作为抗氧化剂,直接清除因胁迫引起的活性氧(ROS)积累;在抵抗重金属胁迫时,NO可以增加植物细胞壁果胶和半纤维素的含量,从而增强植物对Cd的耐受性[17],但是NO的这种保护效应主要还是依赖于植物种类、作用剂量和作用时间等[18-19]。此外,NO可以和多种激素形成交叉作用从而调节植物的生长发育。已有研究发现NO可以和乙烯(ETH)信号交互作用,调节植物抗病性、细胞死亡以及包括盐、重金属在内的非生物胁迫的耐受性[20]。如Mur等[21]研究发现,烟草发生由细菌病原体引起的超敏反应时会迅速产生NO,在NO产生6 h后ETH产生,这可能是在高NO浓度下ETH合成基因被启动,而后NO和ETH相互作用,起到抵御疾病,调节细胞死亡的作用;刘菁等[22]实验观察到ETH可以诱导拟南芥保卫细胞 NO水平升高,而清除NO则会减弱这种诱导效应;有研究者发现,盐胁迫初期拟南芥愈伤组织中NO和ETH会迅速增加,并且ETH的产生依赖于NO,二者相互作用调控离子平衡,以此来提高植物对盐胁迫的耐受性[23];袁满等[24]以荷花为实验材料,研究发现外源添加SNP和ETH信号转导抑制剂可以显著缓解Cd胁迫处理下荷花叶片的毒害症状。另有研究报道,植物在重金属与盐的耐受性调节、衰老、细胞程序性死亡、气孔关闭和丹酚酸B的积累等方面与NO和SA的交互作用有关联[25- 30]。如SA和NO可显著降低锌对红花的毒性、减缓盐胁迫对番茄幼苗的损伤等[25- 26];此外,外源SA可诱导植物大量产生NO,从而延缓叶片的衰老,调节气孔关闭,而若将NO清除,效应则会消失[27,29]等。诸多研究者以不同植物为实验材料研究表明,SA可以诱导NO的产生,NO也可以影响SA的积累[31-32]。然而在以小麦为材料的研究中,SA和NO对Cd胁迫的耐受性调节机制仍不清楚。
小麦是全球最重要的粮食作物之一,供养着全世界大约三分之一的人口,但是近年来由于人为及自然等因素,全球重金属污染土壤面积不断扩大,尤以镉污染为重[1]。过量的镉不仅严重影响小麦等植物的生长发育,且通过食物链进入人体,严重危害人类的健康,所以如何减少小麦对Cd的吸收,增强小麦的耐Cd能力,一直是研究者关注的热点。本研究以“陇春27”号小麦幼苗为研究材料,探讨SA和NO互作在小麦对Cd胁迫响应过程中的调节作用,为小麦早期抗Cd胁迫的调节机制研究提供理论依据。
1 材料与方法
1.1 植物材料的培养
“陇春27”号小麦购自甘肃省农业科学院,种子用0.1%的氯化汞消毒10 min,流水冲洗10 h,黑暗中萌发24 h,挑选均一饱满、发芽基本一致的种子于小烧杯中(培养条件为12 h/12 h(光照/黑暗)、温度(25±2)℃及光照强度300 μmol m-2s-1),用1/4 Hoagland营养液培养3 d后:(1)100 μmol/L的氯化镉(CdCl2)分别处理0 h、6 h、12 h、24 h和48 h;(2)0、50、100、200、400 μmol/L和800 μmol/L的SA或SNP预处理小麦幼苗6 h后,用100 μmol/L的CdCl2胁迫处理24 h;(3)分别用SA(400 μmol/L)、c-PTIO(100 μmol/L)、L-NAME(100 μmol/L)、Tungstate(100 μmol/L)单独处理小麦幼苗6 h,再培养24 h;用CdCl2(100 μmol/L)胁迫处理小麦幼苗24 h;分别用SA(400 μmol/L)、SA(400 μmol/L)+c-PTIO(100 μmol/L)、SA(400 μmol/L)+L-NAME(100 μmol/L)、SA(400 μmol/L)+Tungstate(100 μmol/L)预处理小麦幼苗6 h,再用CdCl2(100 μmol/L)胁迫处理24 h,取小麦根测定相关指标,剩余根剪下于液氮中迅速冷冻,放置于-80℃下保存用于后续实验。对照组均用1/4 Hoagland营养液处理,每个实验至少重复3次。
1.2 测定方法
1.2.1SA含量的测定
SA含量的测定参考马莉等[33]的方法,采用反相高效液相色谱法(HPLC);以AT. Lichrom ODS(4.6 mm×250 mm,5 m)为色谱柱,流动相乙腈-1%醋酸水溶液(25:75),检测波长225 nm,流速1.0 mL/min,柱温为室温。
1.2.2NO含量的测定
参照Orozco-Ca′rdenas[34]和Murphy[35]等的方法测定NO的含量。将0.5 g小麦幼苗根在100 U过氧化氢酶(CAT)和100 U的超氧化物歧化酶(SOD)中孵化5 min,除去内源ROS,然后加入5 mL 10 μmol/L的氧合血红蛋白,37℃孵育5 min后,使用分光光度法测定在401 nm处和421 nm处提取物中氧合血红蛋白转化成甲基血红蛋白的量来计算NO的含量。
1.2.3根长和叶绿素含量的测定
不同处理培养小麦后,用直尺测量小麦幼苗根长;叶绿素的测定参照Lichtenthaler等[36]的方法,取0.5 g小麦幼苗叶片,加入适量的95%乙醇研磨,离心后收集上清液,向沉淀中再次加入95%乙醇进行洗涤离心,收集上清液,合并两次收集的上清液,定容至25 mL,测定其在470 nm,663 nm,646 nm处的吸光值,并计算其含量。
1.2.4NR活性的测定
按照Tian等[37]的方法测定NR的活性。取0.2 g小麦幼苗根加入2 mL提取缓冲液(50 mmol/L Hepes-KOH(pH 7.5),5%甘油,10 mmol/L MgCl2、1 mmol/L二硫苏糖醇(DTT)、1 mmol/L苯甲基磺酰氟(PMSF)、1 mmol/L苯甲脒和10 μmol/L腺嘌呤黄素(FAD)),研磨成匀浆,4℃,15000 g离心20 min。250 μL上清液中加入250 μL的反应缓冲液(50 mmol/L Hepes-KOH(pH 7.5)、10 mmol/L MgCl2、1 mmol/L DTT、2 mmol/L KNO3、10 μmol/L烟酰胺腺嘌呤二核苷酸),30℃下反应5 min后,用50 μL 0.5 mol/L乙酸锌、150 μL 1%磺胺和150 μL 0.02% N-(1-萘基)乙二胺盐酸盐混合液终止反应,然后15000 g离心2 min,取上清液在540 nm处其吸光值,计算NR的活性。
1.2.5NOS活性的测定
按照Murphy等[35]的方法测定NOS的活性,略有改动。1 g小麦幼苗根在2 mL提取缓冲液(50 mmol/L Tris-HCl(pH 7.4)、1 mmol/L乙二胺四乙酸(EDTA)、320 mmol/L蔗糖、1 mmol/L DTT,1 μmol/L亮抑蛋白、1 μmol/L胃抑蛋白和1 mmol/L PMSF,0.1%聚乙烯吡咯烷酮)中研磨成匀浆,然后4℃、10000 g离心30 min,取适量上清液加入5 mL 100 U的CAT和100 U的SOD,孵化5 min,然后加入5 mL 10 μmol/L氧合血红蛋白,在37℃下孵育30 min后,使用分光光度法测定在401 nm处和421 nm处测定其吸光值并计算NOS活性。
1.3 统计学分析
每个数据平行3次实验,用SPSS Statistics 23.0、Origin 2018和 Adobe Photoshop CC 2018对实验数据进行统计学分析及整理作图,P<0.05表示有显著性差异。
2 结果与分析
2.1 Cd胁迫对小麦幼苗根中内源SA和NO含量的影响
由图1可以看出,小麦幼苗根中SA含量的变化趋势是随着Cd处理时间的延长逐渐下降,与对照相比,处理6 h和12 h时SA含量分别降低了15.8%和39.8%,处理时间为24 h和48 h时,分别降低了65%和63.8%,可以看出SA的含量在这两个时间点之间并无显著差异,而由图1可以看到,小麦幼苗根中内源NO含量随着时间的延长呈现先上升后降低的趋势,与对照相比,100 μmol/L的CdCl2处理后,小麦幼苗根中内源NO的含量在6 h时达到最大,是对照的1.5倍,处理24 h和48 h后,其根中内源NO含量明显低于对照,分别降低为对照的83%和62%。

图1 100 μmol/L的CdCl2处理小麦幼苗不同时间后其根中SA和NO含量的变化Fig.1 The changes of SA and NO content in roots of wheat seedlings treated with 100 μmol/L CdCl2 for different timeSA: 水杨酸 Salicylic Acid; NO: 一氧化氮 Nitric Oxide;图中各小写字母表示各处理间差异显著(P<0.05)
2.2 SA和NO对Cd胁迫下小麦幼苗的缓解作用
由图2可以看出,Cd胁迫下,外源添加不同浓度的SA和SNP预处理小麦幼苗,随着SA或SNP浓度的增加,小麦幼苗根长和叶绿素含量均呈现先升高后降低的趋势,其中添加400 μmol/L SA和200 μmol/L SNP预处理对Cd抑制的缓解效果最好,小麦幼苗根长和叶绿素含量基本恢复正常水平,用400 μmol/L SA预处理后其叶绿素含量甚至略微高于对照,之后随着SA或SNP浓度的升高,根长和叶绿素含量均显著降低。
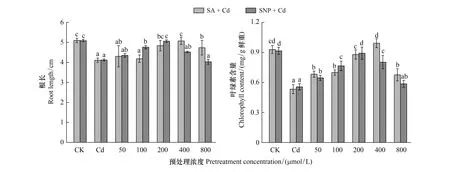
图2 不同浓度SA和SNP预处理的小麦在100 μmol/L CdCl2胁迫下其幼苗根长和叶绿素含量变化Fig.2 The changes of root length and chlorophyll content of wheat seedlings under 100 μmol/L CdCl2 stress after being pretreated with different concentrations of SA and SNPCd: 100 μmol/L氯化镉 Cadmium chloride; SNP: 硝普钠 Sodium Nitroprusside;图中各小写字母表示各处理间差异显著(P<0.05)
2.3 不同处理对小麦幼苗根长及叶绿素和内源NO含量的影响
如表1所示,与对照相比,单独的c-PTIO、L-NAME、Tungstate预处理显著降低了小麦幼苗的根长,而对其叶绿素含量影响不大。此外,单独400 μmol/L SA预处理使小麦幼苗内源NO含量显著升高,而单独c-PTIO、L-NAME、Tungstate预处理的效果与其相反,呈现显著降低的趋势。在Cd胁迫下,外源添加400 μmol/L SA预处理小麦幼苗使根的长度,叶绿素和内源NO的含量得到显著增加,但是外源SA的诱导效应被c-PTIO和Tungstate所抑制,而添加L-NAME对外源SA的诱导效应几乎没有影响。另外,与单独的400 μmol/L SA预处理相比,400 μmol/L SA预处理使Cd胁迫下小麦幼苗表现出更好的根系长势,但是SA对Cd胁迫下小麦幼苗根长的保护效应在添加c-PTIO和Tungstate预处理后被逆转。

表1 不同处理下小麦幼苗根长(cm)及叶绿素(mg/g Fw)和内源NO含量(μmol/g Fw)的变化
2.4 SA对Cd胁迫下NR和NOS活性的影响
从图3可以看出,与对照相比,单独外源400 μmol/L SA预处理使得小麦幼苗根中NR的活性显著升高为对照的2.4倍,而单独Cd处理显著抑制了NR的活性,使其降低为对照的81%,添加外源SA预处理后这种抑制作用被解除,相比之下,不同处理下NOS的活性(图3)不受影响。

图3 SA预处理的小麦幼苗在Cd胁迫下其根中NR和NOS活性的变化Fig.3 The changes of NR and NOS activities in the roots of wheat seedlings under Cd stress after being pretreated with SANR:硝酸还原酶 Nitrate Reductase; NOS:一氧化氮合成酶 Nitric Oxide Synthase;图中各小写字母表示各处理间差异显著(P<0.05)
3 讨论
3.1 Cd胁迫下小麦幼苗根中SA和NO含量的变化
SA广泛存在于植物体内,不仅在植物的生长发育中起着重要的作用,而且能够通过调节各项生理活动,从而降低逆境胁迫对植物的伤害[5- 6]。在重金属胁迫下,SA可以通过螯合重金属从而降低重金属引起的毒性并使ROS分解,因此从而提高植物对重金属胁迫的耐受性[38]。郑慧芳[39]研究发现,Cd胁迫导致杨树茎中SA含量显著降低,这与本研究的结果相似。本研究中,随Cd胁迫处理时间的延长,小麦幼苗根中SA含量呈现逐渐降低的趋势(图1),可能是因为其与Cd螯合,减少了Cd胁迫引起的毒性,并使ROS分解,从而导致SA含量降低。
NO是调节植物生长和发育的关键气体信号分子,能够在多种胁迫环境下维持植物正常的生理生化活动,从而增强植物对胁迫环境的耐受能力[37,40]。研究发现,铝(Al)诱导了小麦Al耐受性品种Jian- 864中NO含量早期的爆发,这种爆发发生在3 h,随后在6 h下降,12 h和24 h时又开始上升,且其含量全部高于对照,进一步深入研究发现这种早期NO含量的剧增对于小麦耐受Al胁迫具有非常重要的意义,但是在对Al敏感的小麦品种中并未发现类似的现象[41]。胡炎[42]的研究中也发现类似的现象,发现东南景天超积累生态型和非超积累生态型根系NO含量分别在镉处理24 h和36 h时达到最大,随后随着时间的加长逐渐降低,这种短期的镉胁迫诱导植物根系NO的积累可能与其对镉的耐受性有关。本实验通过测定小麦幼苗在不同时间Cd处理后内源NO的含量发现,NO含量在6 h时相比对照极显著地升高了,随后持续下降(图1)。因此,本研究中6 h时NO含量的升高可能对小麦抵抗Cd胁迫起着非常重要的作用。
3.2 外源SA或SNP预处理对Cd胁迫下小麦幼苗根长及叶绿素含量的影响
大量的研究表明,当胁迫环境诱导特定物质(抗氧化分子、激素、信号分子等)减少时,通过外源添加缓解物质或补偿特定的供体能部分或完全恢复植物的耐受性。一定浓度的外源SA预处理可以减轻Cd胁迫对番茄生长的毒害作用,促进其根茎的生长[43];此外,外源SA也显著促进了Cd胁迫下甜瓜幼苗的生长,提高了叶片叶绿素的含量[44]。相似,本实验中外源添加一定浓度的SA显著促进了小麦幼苗根的生长,并使叶片叶绿素含量显著增加(图2),其中以400 μmol/L SA预处理效果最好,可见外源添加SA能降低小麦幼苗因Cd胁迫造成的伤害,说明Cd胁迫下SA对小麦幼苗具有直接的保护作用,但是这种保护作用与其含量息息相关。
诸多研究报道,当植物遭遇胁迫环境时,外源添加缓解物质可有效促进植物的生长发育。敬岩等[45]研究报道,缺铁胁迫下,外源加入NO诱导剂能显著促进玉米叶片中叶绿体的发育,并提高光合链的电子传递速率, 从而显著地增加了叶片的光合活性;此外,适宜浓度的SNP可以显著缓解Cd胁迫导致的苎麻根长减短和叶绿素含量降低的状况,但是若SNP浓度过高则缓解作用不显著[18]。本实验也得到相似的结果,使用一定浓度的SNP预处理小麦幼苗,Cd胁迫下其根长及叶绿素含量显著升高(图2),其中以200 μmol/L SNP预处理效果最好,过高浓度则缓解效果不明显,说明一定浓度的外源SNP能够缓解Cd胁迫对植物生长的抑制作用。
3.3 Cd胁迫下SA与NO互作的效应
众多研究发现,SA和NO交互作用参与了植物许多的生理过程。例如Ji等[27]研究报道,外源SA可诱导拟南芥叶片中NO大量产生,从而延缓叶片衰老,而清除NO则会使这种延缓效果减弱,SA也能够和NO相互作用从而调节蚕豆气孔的关闭[29]。此外,在根形态的发生、次生代谢物的产生以及非生物胁迫等方面SA和NO也有着紧密的联系[46- 49],那么二者在Cd胁迫下是否也存在着相互作用。本研究发现,外源添加SA预处理可显著缓解由Cd胁迫造成的小麦幼苗根长减短及叶绿素含量降低的状况,而这种缓解作用却被c-PTIO或Tungstate所逆转,且小麦幼苗根中NO含量的变化也与此相似(表1)。这些结果说明:在Cd胁迫下,SA和NO存在着一定的相互作用,且SA对Cd胁迫下小麦幼苗的这种保护作用可能是因为影响了NO的合成。
植物中NO的合成包括酶促与非酶促途径,NR和NOS是两种潜在的酶促来源。NO的合成具体由哪个酶催化,受环境条件、生长时间、植物种类、外源物质等因素的影响[50-52]。小麦对Al胁迫响应中的NO是由NR介导产生的[41],而干旱诱导三叶草NO的合成过程中,NOS可能发挥着更重要的作用[51]。砷胁迫下,外源添加SA提高了水稻根中NR的活性[48],表明NR参与了SA诱导的水稻根中NO的合成。本研究也得到相似的实验结果,外源添加SA预处理小麦使其幼苗根中NR活性显著升高,而NOS活性不受影响(图3),表明外源SA诱导了Cd胁迫下小麦幼苗根中NO的产生,且NO的合成依赖于NR途径,这种依赖性可以进一步被Tungstate处理下NO含量产生的变化所确定(表1)。
4 结论
Cd胁迫导致小麦幼苗根内源SA含量降低,而NO含量先升高后降低;外源SA或SNP预处理可以减缓Cd胁迫对小麦幼苗根生长的抑制作用,增加叶绿素的含量;外源SA通过影响NO的产生从而提高小麦幼苗对Cd胁迫的耐受性,最终缓解了Cd对小麦幼苗的植物毒作用。
