奥尼罗非鱼及其亲本感染无乳链球菌后生理响应变化
2021-12-24祝璟琳李大宇邹芝英薛良义
祝璟琳 李大宇 邹芝英 肖 炜 喻 杰 杨 弘* 薛良义*
(1. 中国水产科学研究院淡水渔业研究中心, 农业农村部淡水渔业和种质资源利用重点实验室, 无锡 214081;2. 宁波大学海洋学院, 宁波 315211)
罗非鱼(Oreochromisspp.)是世界上第二大经济养殖鱼类, 也是世界范围内蛋白质的主要来源之一。无乳链球菌(Streptococcus agalactiae)是一种革兰氏阳性菌, 也是鱼类感染的常见病原菌, 由无乳链球菌等引起的链球菌病已严重危害全球罗非鱼养殖业, 造成巨大的经济损失[1,2]。据中国渔业年鉴统计, 我国罗非鱼主产区为广东、海南、广西、云南和福建等省区, 2018年产量为162.45×107kg,总产量和出口量都居世界首位。自2009年以来, 我国罗非鱼暴发了大规模的链球菌病感染, 死亡率高达30%—90%, 病原菌90%以上是无乳链球菌[3,4]。使用抗生素和疫苗可以在短期内减轻罗非鱼链球菌病, 然而, 抗生素使用有导致耐药性和药残的风险, 造成潜在的食品安全隐患; 疫苗虽在实验室取得较好的免疫保护率, 但离批文的获得和产业化应用还有很长的距离, 短期内通过疫苗防治链球菌病仍有很大困难[2,5]。
作为一种长期的解决方案, 培育抗病品系可以有效地控制疾病。鱼类和甲壳类对特定疾病的抗病品系培育都取得了一定进展, 如鲑鳟类[6—9]和虾[10,11]。由于链球菌病对全球罗非鱼产业的影响,国外学者已将对该疾病的抗病性选育作为育种目标[12—14]。我们前期研究表明奥尼罗非鱼(Oreochromis niloticus♀×O. aureus♂)比其他罗非鱼选育品种抗链球菌病能力更强[15]。杂交育种技术是提高罗非鱼生长速率和雄性率, 并从遗传本质上提高罗非鱼内在抗病力的根本手段[16,17]。很少有研究直接比较水生动物的亲本及其杂种之间的免疫力和病原菌抵抗力[18]。Arias等[19]曾报道杂交斑点叉尾鮰(Ictalurus punctatus×I. furcatus)对柱形病的抵抗力明显高于亲本。Bunlipatanon等[20]研究表明杂交石斑鱼(Epinephelus lanceolatus×E. fuscoguttatus)的白细胞数、溶菌酶活性和清除病原菌的能力都很高, 而亲本虎斑石斑鱼(E. fuscoguttatus)则较低,相应地虎斑石斑鱼感染创伤弧菌(Vibrio vulnificus)后的存活率最低。本实验的目的是比较杂交子一代奥尼罗非鱼与亲本尼罗罗非鱼(O. niloticus)和奥利亚罗非鱼(O. aureus)在腹腔注射无乳链球菌后的生理响应变化, 研究它们对无乳链球菌的敏感性和免疫反应, 评估杂交种奥尼罗非鱼相对于其亲本的抗病性, 以期深入了解奥尼罗非鱼中观察到的抗病性杂种优势的生理和分子基础。
1 材料与方法
1.1 实验用鱼
实验鱼均来自农业农村部罗非鱼遗传育种中心南泉科研基地, 奥利亚罗非鱼 “夏奥1号”(简称为AX奥利亚罗非鱼)鱼体质量为(145±30) g; 尼罗罗非鱼埃及品系(简称NE尼罗罗非鱼)鱼体质量为(121±30) g; 奥尼罗非鱼为(NE尼罗罗非鱼♀×AX奥利亚罗非鱼♂)的杂交子一代(简称EX奥尼罗非鱼),鱼体质量(150±40) g。每种罗非鱼随机取200尾运回实验室后在循环水养殖系统中暂养7d, 养殖桶体积为360 L, 水温(33±1)℃, 在按常规饲养方法管理。攻毒开始后每个养殖桶单独控温(33±1)℃。实验菌株编号LB110808-2, 保存于本实验室, 经16S rDNA分子鉴定为无乳链球菌(GenBank登录号:JQ990153), 复壮后使用。
1.2 人工感染实验
感染实验①: 经预实验确定NE尼罗罗非鱼的半致死浓度为6.5×107cfu/mL, 1.2×108cfu/mL无乳链球菌分别腹腔注射3种罗非鱼, 按每100 g鱼体腹腔注射菌液0.1 mL, 每种罗非鱼每组10尾, 设3个平行, 人工感染后连续观察7d, 并统计7d内累积死亡率, 实验期间不投喂。
感染实验②: 另每种罗非鱼取120尾, 分为4组,其中3组2.2×107cfu/mL无乳链球菌腹腔注射, 按每100 g鱼体腹腔注射菌液0.1 mL, 剩余1组注射等量的无菌生理盐水, 用于分析感染后血液生理指标、血清生化指标和脾脏促炎性细胞因子的变化规律,研究奥尼罗非鱼及其亲本感染无乳链球菌后生理响应变化。
实验期间不投饵, 周围保持安静, 减少干扰。在感染实验②中, 在注射感染后第2天每种罗非鱼随机取1—2条有症状的鱼解剖, 无菌操作取脾脏在脑心浸液琼脂(BHIA)培养基上划线分离细菌, 28℃培养24h后用API 20 Strep快速鉴定条(梅里埃公司)鉴定。
1.3 样品采集
感染实验②中注射生理盐水腹腔注射后0, 无乳链球菌腹腔注射后7h、24h、48h、72h、120h和168h每组罗非鱼随机取9尾鱼, 用2.5 mL注射器鱼尾静脉取血后, 分成2份, 1份制作抗凝血用作血液生理指标和呼吸暴发测定, 另一份室温静置2—4h后, 4000 r/min离心15min后, 吸取上层血清转移到新的1.5 mL离心管中, 放置-20℃冰箱待实验。同时取脾脏放入加有1 mL Trizol试剂的冻存管中,液氮速冻后保存-70℃冰箱。
1.4 罗非鱼血液生理指标和血清生化指标测定
血液中白细胞、红细胞、血红蛋白和红细胞压积在贝克曼库尔特LH 750全自动血液分析仪上测定; 血清中总蛋白、葡萄糖、甘油三酯和胆固醇指标在日立7600型全自动生化分析仪上测定; 溶菌酶活力采用南京建成生物工程研究所有限公司生产的试剂盒, 按照说明书操作。
呼吸暴发活力采用NBT(硝基四氮唑蓝)还原法进行测定。采样当日采集的100 μL的抗凝新鲜血液中加入100 μL 0.2% NBT(Nitroblue tetrazolium,Sigma), 37℃孵育30min, 之后取15 μL 反应液, 加入300 μL N, N′-二甲基甲酰胺(DMF), 充分混匀, 在2000 r/min, 4℃条件下离心5min, 取200 μL上清液于540 nm下读取吸光值, 以200 μL DMF为空白对照, 呼吸暴发活性用OD540nm表示。
1.5 总RNA的抽提及cDNA的合成
将保存在超低温冰箱中的脾脏样品取出, 放入Sceintz-48型高通量组织研磨机(宁波新芝公司)中研磨匀浆。按照Trizol试剂使用说明书提取总RNA。提取的RNA经Nanodrop超微量紫外分光光度计(Thermo公司)测定RNA的浓度及A260/A280, 并用琼脂糖凝胶电泳检测RNA的完整性。按照PrimeScriptTMRT反转录试剂盒(TaKaRa公司)说明书合成cDNA。
1.6 实时荧光定量PCR分析
目标基因和内参基因引物序列见表 1, 在7900HT Fast Real Time PCR仪(ABI公司)上进行qRT-PCR检测。反应体系(20 μL)为: 2×SYBR Green I real-time PCR Master Mix (Toyobo公司) 10 μL, cDNA模板1 μL, 上下游引物(10 μmol/L) 各0.8 μL, 无RNA水7.4 μL; PCR扩增程序: 95℃ 预变性5min; 95℃ 变性15s, 60℃退火延伸 1min, 40个循环; 目的基因和内参基因扩增效率基本一致的前提下, 用2-ΔΔCt法分析计算TNF-α、IL-1β和IL-6 mRNA 的相对表达量。

表1 引物序列表Tab. 1 The sequence of primer
1.7 数据统计分析
数据用Excel 2016初步处理后, 用SPSS 19软件进行单因素方差分析检验(One-way ANOVA), 当差异显著时(P<0.05), 则进行Duncan’s多重比较, 用GraphPadPrism8软件作图。血液生理生化指标以平均值±标准差(mean±SD)表示, 定量数据以平均值±标准误(mean±SE)表示。
2 结果
2.1 奥尼罗非鱼及亲本群体感染无乳链球菌后累计死亡率差异
如图 1可见, 感染实验①中每组罗非鱼死亡主要集中在无乳链球菌感染后72h内, 实验组EX奥尼罗非鱼感染后各时间点的累积死亡率都显著低于亲本NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05),感染后7d累积死亡率NE尼罗罗非鱼(64.07%)>AX奥利亚罗非鱼(56.00%)>EX奥尼罗非鱼(43.33%),而对照组3种罗非鱼的累积死亡率均为0, 表明EX奥尼罗非鱼对无乳链球菌的耐受力显著强于亲本。在感染实验②中, 在人工感染后2d, 每种奥尼罗非鱼的脾脏中均分离到了细菌, 用API 20 Strep快速鉴定试剂条鉴定均为无乳链球菌。

图1 奥尼罗非鱼及亲本群体感染无乳链球菌后累计死亡率变化Fig. 1 Changes of cumulative mortality of tilapia and its parents artificially infected with Streptococcus agalactiae
2.2 奥尼罗非鱼及亲本群体感染无乳链球菌后血液生理指标变化
EX奥尼罗非鱼和AX奥利亚罗非鱼白细胞数在感染后7h显著性升高(P<0.05), 感染后24h达峰;NE尼罗罗非鱼在感染后24h显著性升高(P<0.05),EX奥尼罗非鱼和NE尼罗罗非鱼白细胞数感染后168h都恢复到感染前水平, 而此时AX奥利亚罗非鱼的白细胞数还未恢复到感染前水平。感染前、感染后7h和24h EX奥尼罗非鱼白细胞数显著高于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染后48h和72h AX奥利亚罗非鱼的白细胞数最高, 感染120h后每种罗非鱼之间没有显著性差异(P>0.05; 图 2A)。
3种罗非鱼感染无乳链球菌后红细胞数都呈现先下降后上升的趋势, EX奥尼罗非鱼在感染后72h红细胞数最低, NE尼罗罗非鱼和AX奥利亚罗非鱼红细胞数分别在感染后24h和48h数目最低。感染前EX奥尼罗非鱼红细胞数显著高于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染后7h和24h NE尼罗罗非鱼的红细胞数显著低于EX奥尼罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染后48h每种罗非鱼之间红细胞数没有显著性差异(P>0.05; 图 2B)。

图2 奥尼罗非鱼及亲本群体感染无乳链球菌后血液白细胞(A)和红细胞(B)数量变化Fig. 2 Changes of white blood cell (A) and erythrocyte (B) after artificial infection of S. agalactiae in hybrid tilapia and its parents
3种罗非鱼感染后血红蛋白含量均显著性下降(P<0.05), EX奥尼罗非鱼和NE尼罗罗非鱼在感染后24h显著降低, AX奥利亚罗非鱼在感染后7h就显著降低, 感染120h后3种罗非鱼的血红蛋白均降到最低值。感染前EX奥尼罗非鱼和AX奥利亚罗非鱼血红蛋白含量显著高于NE尼罗罗非鱼(P<0.05), 感染后48h和72h AX奥利亚罗非鱼血红蛋白含量则显著高于其余2种罗非鱼(P<0.05; 图 3A)。
3种罗非鱼感染无乳链球菌后红细胞压积在7h就显著降低(P<0.05), 整体呈现先降低后升高的趋势, 在感染后48h最低。感染前EX奥尼罗非鱼红细胞压积显著高于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染24h后 NE尼罗罗非鱼红细胞压积则显著低于其余两种罗非鱼(P<0.05; 图 3B)。

图3 奥尼罗非鱼及亲本群体感染无乳链球菌后血液血红蛋白(A)和红细胞压积(B)数量变化Fig. 3 Changes of hemoglobin (A) and hematocrit (B) in blood after artificial infection of S. agalactiae in hybrid tilapia and its parents
2.3 奥尼罗非鱼及亲本群体感染无乳链球菌后血清生化指标变化
3种罗非鱼感染后总蛋白均呈现先降低后升高的趋势, 在感染后7h最低。感染前EX奥尼罗非鱼的总蛋白含量在2个亲本中间, NE尼罗罗非鱼的总蛋白含量显著低于AX奥利亚罗非鱼(P<0.05), 在感染后7—48h AX奥利亚罗非鱼的总蛋白最高, 感染后120—168h则NE尼罗罗非鱼的总蛋白含量显著低于其余2种罗非鱼(P<0.05; 图 4A)。
EX奥尼罗非鱼和NE尼罗罗非鱼的葡萄糖在感染后都呈现先升高后降低的趋势, EX奥尼罗非鱼在感染后72h达到峰值, 在感染后120h恢复到感染前水平; NE尼罗罗非鱼在感染后24h就达到峰值,在感染后48h恢复到感染前水平; AX奥利亚罗非鱼的葡萄糖在感染后呈现下降趋势。3种罗非鱼的葡萄糖在感染前没有显著性差异(P>0.05), 在感染后EX奥尼罗非鱼的葡萄糖显著高于亲本(P<0.05; 图 4B)。

图4 奥尼罗非鱼及亲本群体感染无乳链球菌后血液总蛋白(A)和葡萄糖(B)数量变化Fig. 4 Changes of total protein (A) and glucose (B) in blood after artificial infection of S. agalactiae in hybrid tilapia and its parents
EX奥尼罗非鱼和NE尼罗罗非鱼的总胆固醇感染后呈现先降低后升高的趋势, AX奥利亚罗非鱼则表现为先升高再降低的趋势, 在感染后24h达到峰值。EX奥尼罗非鱼的总胆固醇含量在感染前后介于2个亲本中间, NE尼罗罗非鱼的总胆固醇在感染前后都最低(图 5A)。
3种罗非鱼的甘油三酯感染后都呈现先降低后升高的趋势, EX奥尼罗非鱼和NE尼罗罗非鱼在感染后24h最低, AX奥利亚罗非鱼在感染后48h最低,感染后168h NE尼罗罗非鱼和AX奥利亚罗非鱼恢复到感染前水平。感染前EX奥尼罗非鱼的甘油三酯显著高于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染后168h EX奥尼罗非鱼的甘油三酯显著低于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05;图 5B)。

图5 奥尼罗非鱼及亲本群体感染无乳链球菌后血清总胆固醇(A)和甘油三酯(B)数量变化Fig. 5 Changes of serum total cholesterol (A) and triglyceride (B) after artificial infection of S. agalactiae in hybrid tilapia and its parents
3种罗非鱼的溶菌酶感染后都呈现先升高后降低的趋势, EX奥尼罗非鱼在感染后48—120h显著升高(P<0.05), 在感染后168h恢复到感染前水平;NE尼罗罗非鱼和AX奥利亚罗非鱼在感染后7h就显著升高(P<0.05), 在感染后168h仍然显著高于感染前水平(P<0.05)。感染前、感染后72h和120h EX奥尼罗非鱼的溶菌酶显著高于NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 感染后168h EX奥尼罗非鱼的溶菌酶仍然显著高于AX奥利亚罗非鱼(P<0.05;图 6A)。
3种罗非鱼血液呼吸暴发强度在感染后均出现显著性下降(P<0.05)。感染前的血液呼吸暴发强度AX奥利亚罗非鱼>NE尼罗罗非鱼>EX奥尼罗非鱼,感染后7—72h 的呼吸暴发强度则AX奥利亚罗非鱼<NE尼罗罗非鱼<EX奥尼罗非鱼, 在感染后120h, 3组呼吸暴发水平相近, 没有显著性差异(P>0.05; 图 6B)。
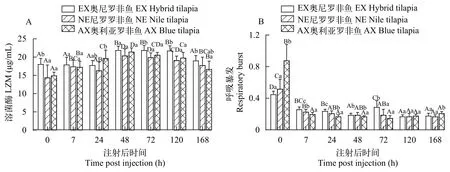
图6 奥尼罗非鱼及亲本群体感染无乳链球菌后血清溶菌酶(A)和呼吸暴发(B)变化Fig. 6 Changes of serum lysozyme (A) and respiratory burst (B) after artificial infection of S. agalactiae in hybrid tilapia and its parents
2.4 奥尼罗非鱼及亲本群体感染无乳链球菌后脾脏促炎性细胞因子表达量的变化
3种罗非鱼的脾脏TNF-α表达量在感染后都显著性升高(P<0.05), 且都在感染后7h达到峰值, 之后显著性下降, 但在感染后168h仍然显著高于感染前水平(P<0.05); 感染前和感染后48h NE尼罗罗非鱼TNF-α表达量显著低于EX奥尼罗非鱼和AX奥利亚罗非鱼, 其余时间点EX奥尼罗非鱼TNF-α表达量都显著高于亲本NE尼罗罗非鱼和AX奥利亚罗非鱼(图 7A)。
3种罗非鱼在感染后脾脏IL-1β的表达量都呈现先上升再下降的趋势(P<0.05), 且在感染后168hIL-1β的表达量都还显著高于感染前水平(P<0.05)。EX奥尼罗非鱼IL-1β的表达量在感染后48h达到峰值, NE尼罗罗非鱼IL-1β的表达量在感染后24—48h达到峰值, AX奥利亚罗非鱼IL-1β的表达量在感染后72h达到峰值。感染后72—120h AX奥利亚罗非鱼脾脏IL-1β表达量显著高于其余2种罗非鱼, 在其余时间点都是EX奥尼罗非鱼IL-1β的表达量显著高于亲本NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05;图 7B)。
3种罗非鱼的脾脏IL-6的表达量在感染后都呈现先升高后下降的趋势, 且都在感染后7h达到峰值,随后逐步降低, 在感染后120h 恢复到感染前水平。感染前和感染后7—48h EX奥尼罗非鱼的脾脏IL-6的表达量在感染前后都显著高于亲本NE尼罗罗非鱼和AX奥利亚罗非鱼(P<0.05), 而在感染后72—168h的感染后期NE尼罗罗非鱼的IL-6的表达量显著低于EX奥尼罗非鱼和AX奥利亚罗非鱼(P<0.05; 图 7C)。

图7 奥尼罗非鱼及亲本群体感染无乳链球菌后脾脏中TNF-α(A)、IL-1β(B)和IL-6(C)相对表达量变化Fig. 7 Changes of relative expression of TNF-α (A), IL-1β (B)and IL-6 (C) in spleen of hybrid tilapia and its parents artificially infected with S. agalactiae
3 讨论
3.1 奥尼罗非鱼及亲本群体感染无乳链球菌后累计死亡率差异分析
虽然在自然疾病暴发中幸存下来的鱼被认为具有抵抗力, 但由于环境的不可控, 它们不适合用于评估抗病力。在大多数鱼类育种中, 人工感染通常被用来评估抗病性。通过不同的方法感染实验鱼, 包括浸泡、同居挑战和腹腔/肌肉注射[21,22]。虽然注射感染鱼类在一定程度上绕过了先天免疫反应(即皮肤和黏膜防御), 但注射感染已被用于评估鱼类对许多细菌性病原体的抵抗力[23]。与无乳链球菌浸泡或同居挑战通常会导致较低的死亡率和不一致的结果不同的是, 使用注射感染可确保每条鱼都接受相同的病原菌剂量, 能获得可重复性的试验结果[13]。本实验用无乳链球菌人工腹腔注射3种罗非鱼后, EX奥尼罗非鱼在各时间点的累积死亡率都显著低于亲本NE尼罗罗非鱼和AX奥利亚罗非鱼, 表明奥尼罗非鱼对无乳链球菌的耐受力显著强于亲本尼罗罗非鱼和奥利亚罗非鱼, 这与之前的研究结果一致[15], 再次证实了杂交育种途径能显著提高鱼体的抗病力。
3.2 奥尼罗非鱼及亲本群体感染无乳链球菌后血液生理指标变化分析
对鱼血液学参数的评估可作为监测生理和病理变化的良好指标, 因为它提供了有关应激、代谢异常、生殖功能障碍和疾病的基本信息[24]。白细胞具有吞噬功能, 可吞入并杀伤或降解病原体, 参与对炎症和免疫反应的调控。在本实验中, 3种罗非鱼在感染无乳链球菌后白细胞都显著性升高。白细胞总数增加, 提示它们可能通过吞噬和产生抗菌蛋白来保护鱼体免受入侵病原体的侵袭[25]。在本实验中, 感染前EX奥尼罗非鱼白细胞数最高, 感染120h后每组罗非鱼之间没有显著性差异。有报道表明白细胞水平较高的物种将能够比其他物种更有效地对抗感染, 因为白细胞计数和免疫反应之间存在直接关联[26]。这说明奥尼罗非鱼比亲本尼罗罗非鱼和奥利亚罗非鱼更能有效对抗链球菌病感染。
红细胞特性可能决定氧气从呼吸系统到组织的运输效率, 血红蛋白和红细胞计数等红细胞值是氧化状态的一个很好的指示器[24]。红细胞压积是检查贫血状况以及与营养、疾病和应激状态相关的鱼类健康的可靠指标[26]。在本实验中, 3种罗非鱼感染无乳链球菌后红细胞数和红细胞压积都呈现先下降后上升的趋势, 血红蛋白含量显著性下降,在感染120h后降到最低值。Zhou等[27]也研究发现无乳链球菌高毒力株 HN016能显著降低罗非鱼红细胞和红细胞压积的含量。红细胞压积和血红蛋白降低可能是因为病原菌感染后造血器官的破坏而导致的失血[28]。感染前EX奥尼罗非鱼红细胞数和红细胞压积最高, EX奥尼罗非鱼的红细胞数和血红蛋白含量在感染前后都更接近AX奥利亚罗非鱼, 表明奥尼罗非鱼运输氧气的效率更高, 杂交子一代奥尼罗非鱼的血液生理指标与父本奥利亚罗非鱼更为接近。
3.3 奥尼罗非鱼及亲本群体感染无乳链球菌后血清生化指标变化分析
血清总蛋白浓度是鱼类健康、应激和营养状况的临床指标[26]。迟缓爱德华氏菌(Edwardsiella tarda)感染降低了鲶(Silurus asotus)[28]和尼罗罗非鱼[29]体内的总蛋白浓度。Zhou等[27]研究表明无乳链球菌高毒力株 HN016能显著升高罗非鱼总蛋白、白蛋白和球蛋白的含量。在本实验中, 3种罗非鱼感染后总蛋白均呈现先降低后升高的趋势, 和之前报道尼罗罗非鱼中的变化趋势一致[30]。血糖是鱼类的一个主要应激指标, 当鱼类面对不同的应激源时, 血糖会通过刺激碳水化合物代谢而增加[31]。在迟缓爱德华氏菌感染后, 尼罗罗非鱼[29]和牙鲆(Paralichthys olivaceus)[31]中的葡萄糖水平明显升高。在本实验中, 奥尼罗非鱼和尼罗罗非鱼的葡萄糖在感染后都呈现先升高后降低的趋势, 进一步证实了细菌感染初期对鱼体生理条件产生严重影响,然后逐渐恢复到正常水平, 这和Mao等[32]的研究结果一致。在本实验中, 感染前3种罗非鱼的葡萄糖没有显著性差异, 感染后EX奥尼罗非鱼的葡萄糖显著高于其他两组, 说明奥尼罗非鱼在感染细菌后的糖原动员分解能力更强, 维持鱼体抵抗病原菌的能量消耗需要。
能量代谢产物水平是鱼类的重要健康参数[33]。甘油三酯通常作为肝功能指标[34], 总胆固醇水平可指示鱼体营养状态, 肝脏脂质和脂蛋白代谢的功能障碍[35]。在加州鲈(Micropterus salmoides)患白云病[36], 吉富罗非鱼、新吉富罗非鱼和埃及尼罗罗非鱼感染海豚链球菌(S. iniae)[37], 奥尼罗非鱼感染无乳链球菌[16]后, 血清甘油三酯和胆固醇的水平都显著下降了。这与本试验结论相似, 说明无乳链球菌感染后引起罗非鱼营养不良, 肝功能和脂代谢障碍。Kim等[31]研究发现, 与血浆胆固醇水平较高的鱼相比, 血浆胆固醇水平较低的鱼对疾病的抵抗力较低。在本实验中, 尼罗罗非鱼的总胆固醇在感染前后都最低, 说明3种罗非鱼中尼罗罗非鱼抗病力最低, 这与攻毒感染后尼罗罗非鱼累计死亡率最大的结果相一致。
溶菌酶是体液免疫中产生的一种抗菌酶, 是鱼类天然免疫的重要参数[38]。具有较高溶菌酶活性的鲤鱼家系对嗜水气单胞菌(Aeromonas hydrophila)感染表现出更强的抵抗力[39]。我们之前研究也表明溶菌酶水平和罗非鱼抗链球菌病能力呈一定的正相关[15]。在本研究中, 3种罗非鱼的溶菌酶感染后都呈现先升高后降低的趋势, 感染前、感染后72h和120h EX奥尼罗非鱼的溶菌酶都显著高于亲本。白细胞产生的呼吸暴发在吞噬过程中攻击入侵的病原体, 可作为评估鱼类对病原体的防御能力的重要指标[40,41]。细鳞鲳(Piaractus mesopotamicus)感染嗜水气单胞菌后白细胞呼吸暴发活性增强[42], 而在本研究中, 3种罗非鱼在感染无乳链球菌后都显示呼吸暴发抑制, 类似情况也在感染鳗弧菌(Vibrio anguillarum)[43]和海豚链球菌[44]的鱼类巨噬细胞中发现, 这一事实可能是这些病原菌的致病机制之一。它们不仅通过抑制呼吸暴发, 而且通过抑制凋亡的半胱氨酸天冬氨酸蛋白酶诱导吞噬细胞存活来逃避宿主的免疫反应, 有助于其在宿主中的传播和生长[43,45]。在本实验中, 感染后1周内3种罗非鱼呼吸暴发活性都抑制, 而Huang等[46]研究表明奥尼罗非鱼、新吉富罗非鱼(O. niloticus ♀×O. ni-loticus♂)和吉奥罗非鱼(NEW GIFT ♀×O. aureus♂) 感染无乳链球菌后2周和4周时呼吸暴发都显著升高, 这种看似矛盾的结果也在迟缓爱德华氏菌的巨鲶(Pangasius pangasius)中发现, 其呼吸暴发活性在感染后5d时显著降低, 但在感染后10d时显著升高[47]。虽然感染前EX奥尼罗非鱼呼吸暴发活性最低, 但感染后7—72h 则是EX奥尼罗非鱼最高。Huang等[46]也研究表明奥尼罗非鱼在攻毒后第4周的NBT活性明显高于新吉富罗非鱼和吉奥罗非鱼, 说明奥尼罗非鱼对病原菌的侵染具有更强的防御能力。
3.4 奥尼罗非鱼及亲本群体感染无乳链球菌后脾脏中促炎性细胞因子的变化分析
鱼类主要依靠先天免疫来抵御疾病, 脾脏是硬骨鱼的重要免疫器官, 也是无乳链球菌感染罗非鱼的主要靶器官[48]。在受到细菌侵袭时, 细胞因子及其系列效应分子能够诱导特定白细胞的富集并激活其抗菌途径[49]。在无乳链球菌感染尼罗罗非鱼后, 头肾和脾脏的IL-6表达均显著上调, 并在6h达到高峰, Wei等[50]研究表明IL-6可能参与了尼罗罗非鱼抵抗细菌感染的宿主防御和促进抗体的产生。弗兰西斯菌(Francisella)感染罗非鱼后24h,TNF-α和IL-1β的表达明显增强, 并持续至96h[51]。在本实验中, 3种罗非鱼在感染后脾脏TNF-α、IL-1β和IL-6的mRNA表达量都显著上升, 3种罗非鱼的TNF-α和IL-6在感染后7h达到峰值, 奥尼罗非鱼IL-1β在感染后48h达到峰值, 尼罗罗非鱼IL-1β在感染后24—48h达到峰值, 奥利亚罗非鱼IL-1β在感染后72h达到峰值。这些促炎性细胞因子通过促进吞噬、凋亡、淋巴细胞激活和白细胞的迁移, 在对细菌感染的即时和早期反应中对病原菌起到防御作用, 是宿主防御机制的重要组成部分[50—53]。
此外, Dong等[54]研究表明无乳链球菌感染诱导免疫组织产生抗炎细胞因子来抑制宿主免疫反应,从而使鱼体逃避无乳链球菌攻击引起感染。在本实验中, EX奥尼罗非鱼在感染前后TNF-α和IL-6表达量都最高,IL-1β在感染前和感染后7—48h表达量都显著高于亲本, 但感染后120h 表达量最低。奥尼罗非鱼的促炎性细胞因子在感染前后表达水平较高, 表明其启动和调节免疫功能的能力较强, 后期却能更好地控制炎症反应。结合攻毒后累计死亡率最低的结果, 可以推断奥尼罗非鱼的免疫应答比亲本更活跃, 表现出抗病力杂种优势。
4 结论
本研究比较分析了杂交种EX奥尼罗非鱼及其亲本群体NE尼罗罗非鱼、AX奥利亚罗非鱼对无乳链球菌人工感染后的累积死亡率差异, 血液生理生化响应和脾脏中促炎性细胞因子表达变化。结果发现奥尼罗非鱼的累积死亡率显著低于亲本, 证实了杂交育种途径能显著提高鱼体的抗病力。感染前奥尼罗非鱼白细胞数、红细胞数和红细胞压积最高, 感染后3种罗非鱼的白细胞都显著性升高;红细胞数、红细胞压积和血红蛋白显著性下降, 呼吸暴发抑制; 其血液生理指标与父本奥利亚罗非鱼更为接近。奥尼罗非鱼在感染细菌后的血糖、溶菌酶水平和呼吸暴发更强, 对病原体的侵染具有更强的防御能力。定量PCR分析表明3种罗非鱼的促炎性细胞因子都显著升高, 可能参与了宿主对细菌感染的防御, 但奥尼罗非鱼的促炎性细胞因子在感染后表达水平较高, 推断奥尼罗非鱼的免疫应答比亲本更活跃, 表现出抗病力杂种优势。然而, 杂种优势的分子基础是复杂的, 杂种优势起源于亲本和杂种基因型之间的遗传密码差异, 下一代基因组测序、转录组和表观遗传学等手段有助于我们全面理解杂种优势现象, 应该在今后的奥尼罗非鱼杂种优势研究工作中加以应用。
