加米霉素注射液细菌内毒素检查(凝胶法)方法学研究
2021-12-23于小婷,张漫,鄢明华,王俊菊,姜淋洁,王猛,程雪娇
于小婷,张漫,鄢明华,王俊菊,姜淋洁,王猛,程雪娇
摘要:参照《中华人民共和国兽药典》2015版一部附录1143细菌内毒素检查法的有关规定,对加米霉素注射液内毒素限度及检查方法进行了研究。结果显示,加米霉素注射液通过调节pH并将供试品稀释到498倍及以上时,对细菌内毒素检查无干扰,内毒素限值确定为0.83EU/mg。对3批产品进行检查,结果均符合规定。因此,细菌内毒素检查方法(凝胶法)可用于加米霉素注射液的细菌内毒素检查。
关键词:加米霉素注射液;内毒素检查;凝胶法
加米霉素[1,2]属大环内酯类抗生素,是由法国梅里亚公司研发的第二代大环内酯类抗生素的代表药物之一,在兽医临床具有广阔的应用前景。细菌内毒素是革兰氏阴性菌的细胞壁成分,可引起人和动物发热[3,4]。药品如果被细菌内毒素污染会产生严重的安全问题,尤其是对身体机能较差的患病及幼龄动物。目前国内已有数家兽药企业进行了加米霉素注射液的研发和新兽药申报,但不同厂家研发的加米霉素注射液处方、工艺不尽相同,这也决定了企业需根据自身产品的特点,建立相应的内毒素检查方法学。为保证加米霉素注射剂在使用过程中的安全性,本研究对加米霉素注射液细菌内毒素检查的可行性进行了方法学验证,为该产品细菌内毒素的检查提供依据。
1 试验材料
1.1 仪器
单人净化工作台,苏州净化设备有限公司;
101型电热鼓风干燥箱,北京中兴伟业世纪仪器有限公司;
QL-861型旋涡混合器,江苏海门其林贝尔仪器制造有限公司;
DZKW-4恒温水浴锅,北京中兴伟业仪器有限公司;
试验所用玻璃器皿经250℃烘烤1h以上。
1.2 药品与试剂
细菌内毒素工作标准品(批号:150601-201784,规格:80EU/支,中国食品药品检定研究院)细菌内毒素检查用水(批号:1807130,规格:5mL/支,湛江安度斯生物有限公司)鲎试剂(TAL)(批号:1706022,灵敏度:0.25EU/mL,规格:0.1mL/支,湛江安度斯生物有限公司)鲎试剂(TAL)(批号:1704203,灵敏度:0.25EU/mL,规格:0.1mL/支,湛江博康海洋生物有限公司)Tris缓冲液(批号:1808240,规格:4mL/支,湛江安度斯生物有限公司)加米霉素注射液(批号:201801001,201801002,201801003,
202001001,202001002,202001003规格:150mg/mL,天津市中升挑战生物科技有限公司)。
2 方法与结果
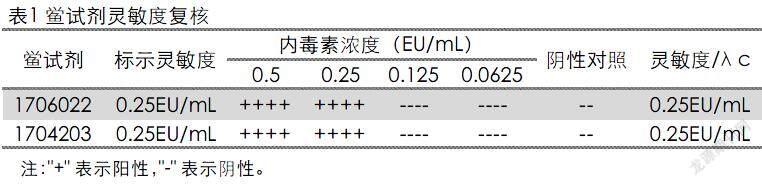
2.1 鲎试剂灵敏度复核试验
根据《中华人民共和国兽药典》2015版附录1143“细菌内毒素检查法”[5],进行鲎试剂的标示灵敏度复核。结果见表1。结果显示2种不同厂家的鲎试剂的复核灵敏度λc均在0.5~2.0λ之间,符合规定。
2.2 细菌内毒素限值(L)的确定
根据公式:L=K/M[6],式中,M为每千克体重每小时最大剂量,本药品的推荐剂量为6mg/kg·bw,一个疗程仅用1次,确定M为6mg/(kg·h);K为注射剂的致热阈值K=5EU/(kg·h),则L=5EU/(kg·h)/6mg/(kg·h)=0.83EU/mg。为保障安全用藥,故将加米霉素注射液的内毒素限值确定为0.83EU/mg。
2.3 加米霉素注射液最大有效稀释倍数(MVD)的确定
根据公式MVD=L×C/λ,其中L为加米霉素注射液的细菌内毒素限值0.83EU/mg,浓度C为150mg/mL,λ为鲎试剂标示灵敏度,目前市售鲎试剂灵敏度λ通常在0.5~0.03EU/mL。则加米霉素注射液的对应最大有效稀释倍数为:MVD 0.5~MVD 0.03分别为249、498、996、1,992和3,984倍。
2.4 干扰试验预实验
由于处方中含有一定浓度的丁二酸,经测制剂pH为5.0左右,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0之间为宜,因此加米霉素注射液在稀释过程中加入内毒素检查专用Tris缓冲液,使其稀释液pH维持在7.0左右。
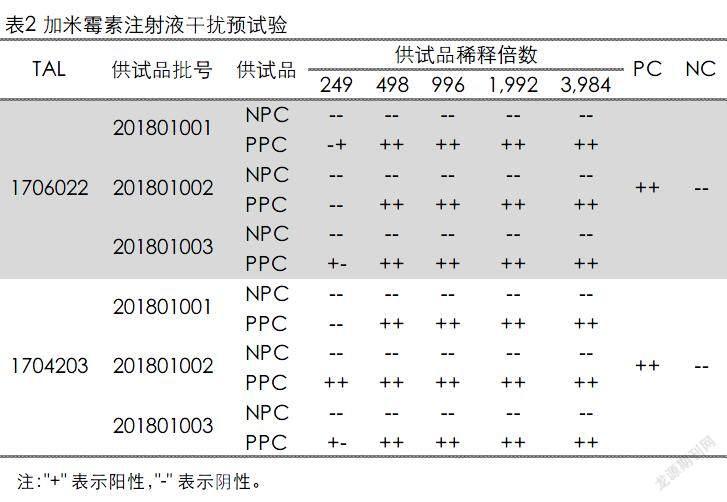
取加米霉素注射液,用细菌内毒素检查用水进行稀释,在稀释过程中加入Tris缓冲液,并最终稀释至249、498、996、1,992和3,984倍,依法检测,结见表2。预试验结果显示供试品稀释到498倍及以上稀释倍数时,供试品溶液对鲎试剂反应无干扰,根据上述结果初步选定供试品有效稀释倍数为498倍。
2.5 正式干扰试验
现依法进行正式干扰试验。取3批加米霉素注射液,用细菌内毒素检查用水将供试品进行498倍的稀释(NPC),依法检测,结果见表2。结果显示3批依法添加内毒素的供试品溶液的反应结果均在0.5~2.0λ之间,依据《中华人民共和国兽药典》2015版附录1143细菌内毒素检查法的要求,认为供试品在该浓度下无干扰作用。
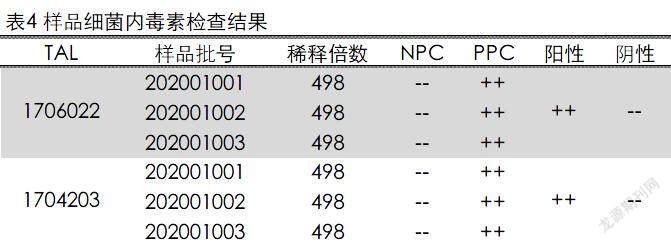
样品细菌内毒素检查。取加米霉素注射液3批,用内毒素检查用水将样品稀释成498倍的供试品溶液(NPC),在稀释的过程中加入Tris缓冲液调节pH,依法检测,结果见表4。结果表明3个批次的498倍稀释的供试品溶液的内毒素含量均小于0.25EU/mL,说明3批加米霉素注射液样品的内毒素含量低于0.83EU/mg,符合要求。
3 讨论
在预干扰试验期间,发现阳性供试品溶液(PPC)经常出现无规律的阴性结果,而阳性对照和阴性对照结果均正常,说明试验材料、操作及环境均正常。经过一系列因素排查,推测是供试品溶液pH引起的问题。由于处方中含有一定浓度的丁二酸,498倍稀释液pH为5.6左右,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0之间为宜,因此在样品稀释过程中加入Tris缓冲液,使供试品溶液pH维持在7.0左右,再进行预干扰试验,PPC便没有再发生不凝集的现象。
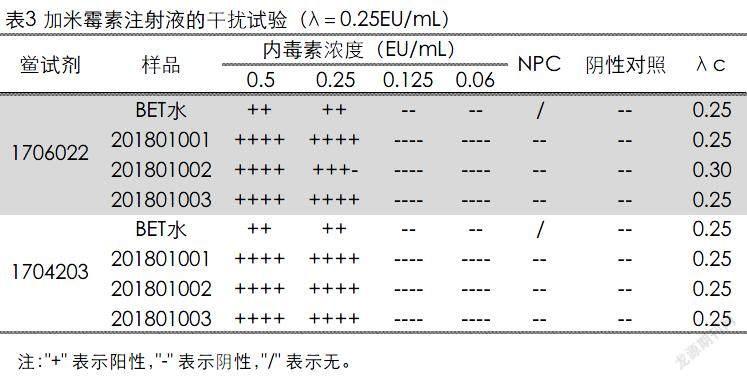
本试验用两个厂家的鲎试剂对加米霉素注射液共3个批次的样品进行了干扰试验,结果表明:样品在稀释的过程中加入pH 7.2的Tris缓冲液调节pH,并最终稀释至498倍(浓度为0.3mg/mL)的供试品溶液对细菌内毒素和鲎试剂反应无干扰,确定所采用的方法可行。加米霉素注射液可适用细菌内毒素检查法,用灵敏度为0.25EU/mL的鲎试剂按凝胶限度检查法对3批产品进行细菌内毒素检查,结果均符合规定。
4 結论
本研究建立了加米霉素注射液的细菌内毒素检查法,试验结果表明加米霉素注射液可适用细菌内毒素检查法(凝胶法);由于加米霉素注射液具有一定的酸性,在做细菌内毒素检查时,会对鲎试剂产生一定的干扰作用,可以通过加入内毒素检查专用Tris缓冲液解决这一问题。
本研究建立的细菌内毒素检查法适用于天津市中升挑战生物科技有限公司生产的加米霉素注射液,由于不同厂家的处方工艺不尽相同,内毒素检查干扰因素也不相同,因此对于不同厂家生产的加米霉素注射液应根据实际情况建立与其适应的内毒素检查方法,以便于更好的控制产品质量。
参考文献:
[1] Menninger JR. Functional consequences of binding macrolidesto ribosomes[J]. Journal of Antimicrobial Chemotherapy, 1985, 16(Suppl. A):23-34.
[2] Zactran: EPAR-Scientific Discussion [EB/OL]. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Scientific_Discussion/veterinary/000129/WC500068716.pdf.
[3] 陈新宇,曹春然,孙圆媛.枸橼酸细菌内毒素检查(凝胶法)方法学研究[J].中国药品标准,2021,22(1):61.
[4] 朗青.无菌原料药头孢噻肟钠细菌内毒素的控制[J].煤炭与化工,2014,37(6):41.
[5] 中华人民共和国兽药典2015年版.一部[S].2015:200.
[6] 中华人民共和国药典2015年版.四部[S].2015:154.
