甘蔗及甘蔗近缘属内生菌的筛选、鉴定与功能研究
2021-12-23狄义宁谢林艳谷书杰刘鲁峰何丽莲李富生
狄义宁 谢林艳 谷书杰 马 豪 刘鲁峰 何丽莲, 李富生,*
(1.云南农业大学 农学与生物技术学院,昆明 650201;2.云南农业大学 甘蔗研究所,昆明 650201)
甘蔗(SaccharumofficinarumL.)是制作蔗糖、乙醇和甜味剂的主要原材料,也是世界上最重要的经济能源作物之一[1],我国每年甘蔗制糖量占消费者食糖总质量的80%以上[2]。云南省作为中国仅次于广西的第二大甘蔗产区,每年甘蔗的产量都是地区经济发展的重要支柱和农民增收的主要经济来源,因此如何提高甘蔗产量是我国甘蔗产业研究的重点。甘蔗生长周期长,需肥量大,施肥是为提高其产量的首要选择。然而,不合理、不科学施肥及一味追求产量的栽培方式对甘蔗产区的土壤及环境带来了危害。为改善这一情况,迫切需要一系列新型肥料,力求在保证甘蔗产量的前提下,减少化学肥料施入,从而达到绿色、环保的目的。20世纪80年代,促进植物生长的细菌(Plant growth promoting bacteria,PGPB)的发现开辟了一种新型的农业栽培方式。这类细菌可以通过直接或间接的方式抑制植物周边病原菌侵害植物本体并促进植物生长,在促进植物生长的过程中,采取如分泌植物激素、有机酸等物质,或通过固氮溶磷解钾等方式促进植物的生长以及对养分的充分吸收。在抑制病原菌方面,通过产生嗜铁素、多糖等[3-7],在减少周边病原菌数量的同时促进植物生长,持续地提高作物产量。同时这类资源属于自然生物体,具有环保和绿色的特性。PGPB可分为2类:一类是植物根际促生菌(Plant growth promoting rhizobacteria,PGPR);另一类则是存活在植物内部的促生内生菌(Plant growth-promotingendophytes,PGPE)。其中,促生内生细菌是指全部或者部分生活史定殖在健康的植物组织内,不会引起寄主明显的病害症状或使其组织结构发生明显变化,并且具有促进植物生长特性的一类细菌微生物[8-9]。在农业生产中应用内生菌后,不少作物在产量、长势、表型性状等都得到显著的提升,如在水稻、高粱、玉米等方面的研究都证实了促生内生菌的应用潜力[10-12]。此外,内生菌的促生长功能容易受环境和宿主基因型的制约[13],导致内生菌的应用存在地域及物种的特异性现象,不同的促生长细菌可能因为地区气候等的影响而影响自身活性,因此开发与挖掘本土促生内生菌资源尤为重要。
自1958年开始甘蔗内生菌的研究以来,先后从甘蔗的根际和根中被分离出大量的内生菌,包括固氮螺菌属Azospirillum、伯克霍尔德氏菌属Burkholderia、克雷伯氏菌属Klebsiella、肠杆菌属Enterobacter、欧文氏菌属Erwinia等[14]。公认的菌系包括重氮营养葡糖酸醋杆菌Gluconacetobacterdiazotorphicus[15-18]、红苍白草螺菌Herbaspirillumrubrisubulbicans、织片草螺菌H.seropedicae等[19-21]。并且不同地区分离的内生菌种类也不同:Magnani等[22]对巴西巴拉那州东北部甘蔗茎部的内生菌进行分离获得4个类群,分别为肠杆菌属Enterobacter、泛菌属Pantoea、克吕沃氏菌属Kluyvera与克雷伯氏菌属Klebsiella;Gangwar[23]在印度旁遮普农业大学中从8份甘蔗材料里分离了8株甘蔗内生菌,经鉴定8株内生菌归类于芽孢菌属Bacillus、固氮螺菌属Azospirillum、肠杆菌属Enterobacter和假单胞菌属Pseudomonas;王丽等[24]从广州园区内种植的甘蔗品种‘拔地拉’茎部共分离得到20 株内生菌,鉴定为16 个属,包括葡萄球菌属Staphyococcus、赖氏细菌属Leifsonia、短杆菌属Curtobacterium、微杆菌属Microbacterium、胺杆菌属Amnibacterium、甲基杆菌属Methylobacterium、根瘤菌属Rhizobium、鞘氨醇单胞菌属Sphingomonas等。几个上述内生菌未在其他甘蔗种植地区被分离报导,由此可见内生菌的种类会随着地域及品种差异而改变[24],研究不同地区内生菌的种类变化很有必要。
目前关于甘蔗内生菌的研究普遍集中在探求其固氮功能方面[25]。虽然菌株的固氮功能是属于促生菌株促进植物生长的一项重要机制,由菌株自身产生固氮酶等物质使氮分子转化为能被植物消化、吸收的氮原子,在土壤氮含量缺乏时可以帮助植株固氮。除此之外,促生菌株的促生长机制还包括溶磷、解钾及铁螯合等作用为植物提供更多可利用的P、K及Fe等元素[26-28]。在甘薯内生菌分离筛选试验中,已有分离并挖掘其功能的宿主多为甘蔗栽培种。除此之外,还有很多与甘蔗关系密切的近源属种,它们都是与甘蔗起源密切相关的近缘内交群,具有抗逆,耐瘠,根系发达等优良性状。这些野生资源包括割手密、芒,斑茅,蔗茅,五节芒等[29-31]。目前这些野生资源的内生菌相关研究较少,对其内生菌的功能缺乏了解,因此有必要展开筛选近缘物种中功能内生菌研究。因此,为进一步探索甘蔗近缘物种内生菌资源,筛选功能菌株并进行合理开发,本研究拟以本课题组前期在甘蔗栽培种及其近缘物种中分离纯化后得到589 株内生菌为基础,采用平板分离筛选、液体培养扩繁、分光光度法及液相色谱法等方法综合评估菌株促生长功能,以期获得具有上述功能的优势菌株,创建具有促生长功能的微生物菌株群的资源库,为今后开发用于甘蔗微生物制剂提供材料基础,也为后续研究提供参考。
1 材料与方法
1.1 菌株来源
本课题组前期采用表面消毒法[32-33]与稀释涂布平板法[34]从云南农业大学甘蔗研究所资源圃中种植的12个甘蔗栽培品种/系以及5个野生种无性系的根、茎、叶中分离并纯化589株内生菌菌株。其中:12个甘蔗栽培品种包括:新台糖10、新台糖22、粤糖86-368、粤糖93-359、桂糖11、云蔗99-91、闽糖69-421、崖城89-9、滇01-47、滇蔗01-58、滇蔗04-14、滇蔗09-38;5个野生种为割手密(Saccharumspontaneum)、斑茅(Erianthusarundinaceus)、蔗茅(E.fulvus)、五节芒(Miscanthusfloridulus)、河八王(Narengaporphyrocoma)。以上品种材料均保存于云南农业大学甘蔗研究所资源圃[35],分离纯化得到的微生物菌株置于-80 ℃冰箱保存。
1.2 供试培养基
供试培养基包括LB[36];Ashby无氮培养基[37];PVK培养基[38];NBRIP培养基[39];优化解钾培养基[40];Landy培养基[41];植酸钙培养基[41],CAS培养基[42]。LB培养基主要用于细菌的培养与活化;Ashby无氮培养基用于菌株固氮活性的评价与筛选;PVK、NBRIP、植酸钙培养基用于溶磷菌株的筛选以及菌株溶磷能力的定量测定;优化解钾培养基用于菌株解钾能力的评价与测定;Landy培养基用于菌株IAA的检测;CAS检测平板用于测定菌株是否产生嗜铁素。
1.3 功能菌株筛选及其固氮溶磷解钾活性的测定
采用平板透明圈法,根据平板上透明圈大小来作为菌株固氮溶磷解钾活性的判定指标。具体方法为:将分离保存的菌株经过LB固体培养基培养活化后,采取点接方式,将待测菌株接种于固体Ashby平板中,随后放置至28 ℃恒温培养箱中培养,5 d后使用直尺测量菌落直径(d)和溶磷圈直径(D),通过计算透明圈与菌落直径比(D/d)用于评定菌株固氮酶活性大小,根据同样的方法,通过PVK、NBRIP、植酸钙培养基3 类测定菌株对无机磷源与有机磷源的溶磷活性,通过优化解钾固体培养基测定菌株解钾活性[43-45]。
为进一步探究菌株溶磷解钾能力,上一步平板筛选结果较好的菌株接种于液体培养法,以不接菌摇瓶为对照(CK),将各待测菌株挑取单菌落接种至已灭菌(1 MPa,121 ℃高压蒸汽灭菌 30 min)的NBRIP、植酸钙液体培养基中,每个处理设置3个重复,接种完成后放于28 ℃、160 r/min恒温摇床中震荡培养。分别吸取培养1、3、6、10 d的菌株发酵液,采用钼蓝法[46]测定可溶性磷含量。通过同样的试验设计,采用火焰分光光度计测定接种菌株的解钾液体培养基中7 d时的可溶性钾含量,用于评价菌株解钾能力[47]。
1.4 菌株分类及鉴定
菌株的鉴定包括传统生理生化检测以及现代分子片段扩增测序两种方法。其中传统生理生化检测主要参照《伯杰氏细菌鉴定手册》[48],主要包括檬酸盐的利用、淀粉水解、硝酸盐还原、吲哚产生、明胶液化、硫化氢等指标测定。分子片段测序则通过Cheng等[49]方法提取细菌DNA,扩增16srRNA与gyrB2个细菌看家基因,其中16srRNA采用通用引物27F,1492R[24];gyrB引物采用UP-1S,UP-2Sr[50]进行相应基因片段PCR扩增,扩增产物电泳分离回收后交由擎科公司(北京擎科生物科技有限公司)以扩增引物进行直接测序,所得结果在删除两端可靠性较低的部分序列后提交到GenBank数据库用于获得登录号,同时基因序列通过NCBI数据库BlastN搜索工具对菌株进行分类鉴定。菌株间的进化树及聚类分析则通过 MEGA6软件,建树模型选择为Kimura 2-parameter,统计方法选择Maximum Likelihood Bootstrap,重复值设置1 000次[51]。
1.5 菌株有机酸定性及定量测定
在无菌环境下吸取各接种菌株后培养7 d的NBRIP培养基500 μL转移至离心管内,14 000 r/min离心10 min后,吸取上清液准备进行SPE固相净化分析。SPE C18(1 mg)准备条件如下:采用80%甲醇(2 mL)活化固相小柱,超纯水(2 mL)平衡固相小柱,取100 μL 离心后的上清样品上样,同时提供200 μL的超纯水洗脱小柱收集有机酸样品。通过高效液相方法将收集的样品进行检测分析。该试验有机酸标样包括酒石酸、丁二酸、苹果酸、乳酸、乙酸、柠檬酸、丙酸,均来自上海阿拉丁生化科技股份有限公司;色谱仪为Agilent 1260,色谱柱为Welth ultimate Plus-C18 250×4.6 mm,5 μm;流动相A为0.05%磷酸水溶液,流动相B为甲醇;设置流速为1 mL/min;柱温为35 ℃;DAD检测器检测波长为210 nm。所得到的化合物的色谱图采集和积分由软件Agilent Chemstation进行处理分析。
1.6 菌株产生IAA能力测定
IAA的定量测定参照Glickmann[47]的方法,将12株活化的供试菌株 接种含有L-色氨酸与不含有的色氨酸的液体Landy培养基中,放于28 ℃、160 r/min 转速的摇床中连续培养5 d后取1 mL菌液于10 000 r/min离心5 min,上清液作为待测样。采用Salkowski比色法对待测样中的IAA进行比色测定,通过制备IAA标准曲线获得IAA的分泌量。
1.7 嗜铁素的定性与种类的测定
采用CAS 检测平板法进行嗜铁素活性测定[42],采用FeCl3试验[42]、高氯酸铁试验[53]、Arnow’s试验[54]及Shenker’s试验[55]分析和确定菌株产生嗜铁素的类型。
1.8 菌株对甘蔗种苗的促生长试验
试验意图通过泡种的方式对探究菌株的促生长能力。将供试菌株接种于LB液体营养基中并放于28 ℃,160 r/min摇床下进行扩繁培养,培养3 d待液体浑浊后将菌株发酵液移至离心管中,在12 000 r/min 离心5 min后用无菌水重悬,此操作重复3 次,取菌体悬浮液,以无菌水稀释菌体浓度为108CFU/mL用于接种液的制备。对甘蔗种苗的促生长试验则选取大小长度相对统一的甘蔗单芽茎经2%石灰水浸泡24 h进行表面灭菌,待上一步完成后用清水冲洗附着在表面的石灰,将甘蔗种苗整齐放在不锈钢盘(50 cm×35 cm×4.8 cm)中,采用106CFU/mL浓度的供试菌株悬浮液浸泡催芽,设置无菌清水为对照,催芽7 d后观察并测定甘蔗种苗的芽长与根长。
1.9 数据的测量与分析
试验采用Excel 2010对数据进行统计,并通过SPSS 23.0软件的单因素方差分析(One-way ANOVA)、LSD法对各处理组与对照组数据进行显著性比较分析,差异显著性水平设定为P=0.05,极显著为P=0.01;通过Microsoft Office软件进行绘图制作。
2 结果与分析
2.1 菌株固氮溶磷解钾生物学活性测定
将分离纯化好的菌株接种在Ashby固体培养基5 d后,具有固氮活性的菌株在菌落周围出现了明显的透明圈,透明圈大小不一。对具有较大透明圈的菌株进行统计,固氮圈以及菌落直径的测定结果见表1。透明圈比值与菌株的固氮能力成正比,透明圈越大代表菌株固氮酶活性更强。通过比较透明圈与菌落直径比D/d可发现,固氮活性较强的菌株有4株,比值最大为菌株M3,其固氮圈半径与菌落半径比值为3.19,其次为菌株D5、C9、L9,3 株菌株比值分别为2.94、2.60、1.84。在筛选具有溶磷功能的内生菌时,将菌株接种于以不同磷源为底物的固体培养基中,如含无机磷源的PVK与NBRIP培养基与代表有机磷源的植酸钙培养基,结果显示有7 株菌株具有较强的溶磷能力,包括了之前筛选的部分具有固氮活性的菌株,如D5、C9等,但菌株的溶磷能力各有不同。具有较强溶磷功能的细菌在平板上会出现较明显的溶磷圈。以菌株产生的透明圈与菌落直径比大于2作为溶磷筛选标准,将各菌株对应的生长情况和透明圈大小见表2。由表2可见:在PVK固体培养基中,菌株C9表现最好,虽然菌体较小,但透明圈面积较大,由此可以推断该菌株溶磷能力较强,且具有高效溶磷的潜力;除C9菌株以外,溶磷能力较强的菌株还包含G3、F5、M3与J8等。在NBRIP固体培养基中,菌株C9表现也最好,菌落较小但是溶磷圈较大;其次为D5菌株,透明圈与菌落直径比值为2.88,B7与E12分别以比值2.56与2.17次之。具有固氮溶磷功能的菌株也有解钾的活性,但是透明圈没有在溶磷平板中表现明显,各菌株的透明圈比值为1.0~1.5,其中菌株M3表现较优,比值为1.6,其次为菌株E12、O9与G3。

表1 菌株在无氮培养基Ashby中的生长情况及透明圈大小Table 1 Growth condition and clear zone ring size of strain in nitrogen-free medium Ashby
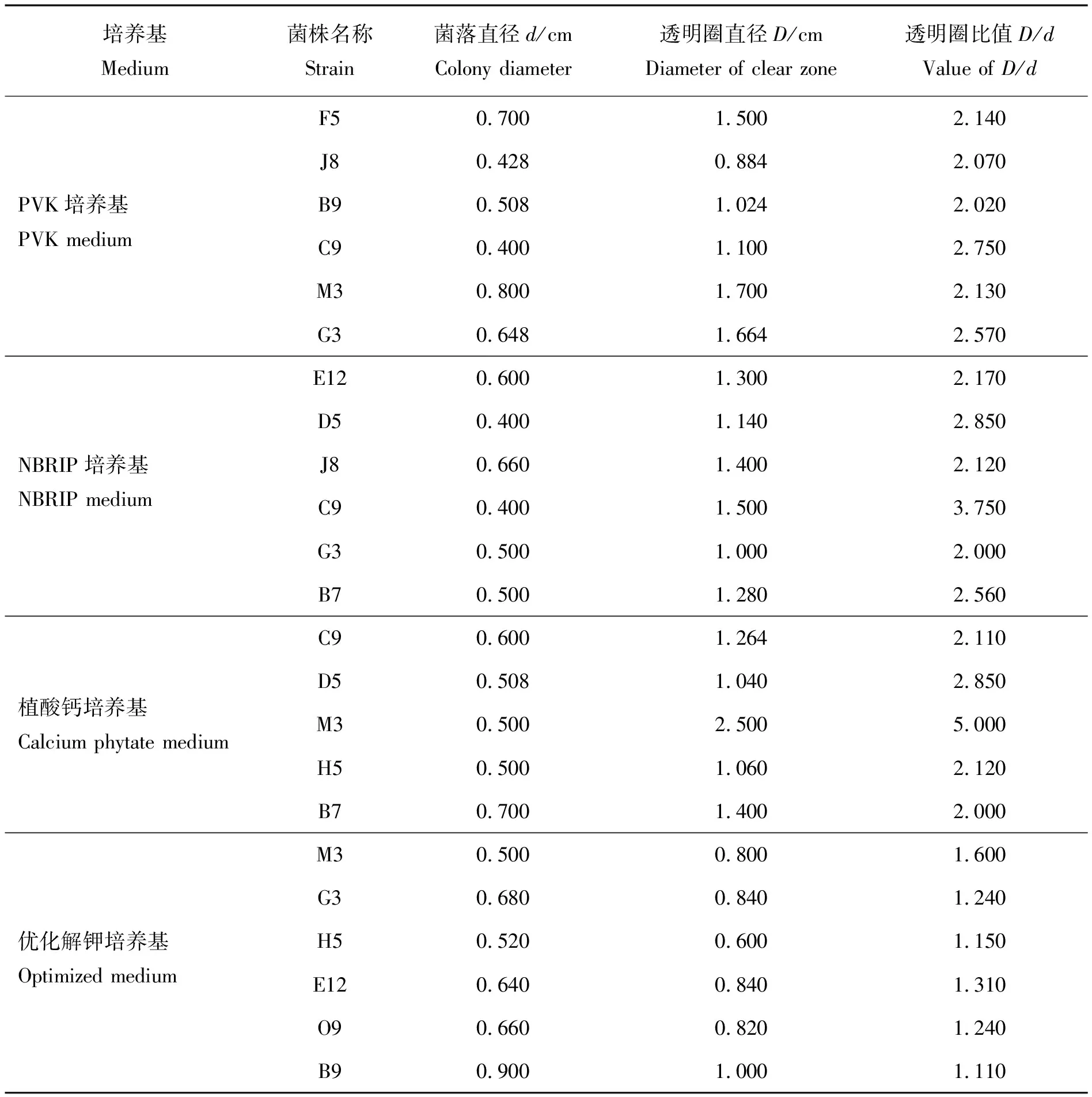
表2 菌株在不同磷源培养基中的生长情况及透明圈大小Table 2 Growth condition and clear zone size of strain in phosphorus solubilizing mediums
为进一步探究溶磷能力大小及透明圈之间关系,将在平板上溶磷能力较优的菌株放于以Ca3(PO4)2、植酸钙各代表无机磷源与有机磷源为底物的液体培养基中培养,以期通过钼蓝法定量测定菌株溶磷能力大小。各菌株在以有机磷与无机磷为底物的培养基中分别产生了不同大小的可溶性磷。并且发现在有机磷培养液(图1(a))中,可溶性磷随着时间的增加而增加,而在无机磷培养基(图1(b))中,可溶性磷含量先上升后下降。在测定培养基产生的可溶性磷含量发现:其中G3菌株溶解无机磷的能力最强,培养6 d后培养基中可溶性磷含量为(1 386.97±331.96) mg/L;产生可溶磷性含量最少的菌株为L9,培养10 d后产生可溶性含量为(90.68±26.94) mg/L。在检查过程中,我们发现可溶性含量在1 000 mg/L的菌株有3 株,分别为G3、H5与F5; 而产生可溶性磷含量低于500 mg/L的菌株有3 株,分别为L9、E12与B9。有趣的是,除3 株菌株外,其余菌株所产生溶磷量均显著高于无菌对照组。而在探究菌株对有机磷矿化过程中发现,C9矿化有机磷的能力较强,在培养基中培养10 d可溶性磷含量最大,其数值为(2 523±68.17) mg/L,而菌株F5相对较弱,培养10 d后培养基中可溶性磷含量为(785.02±45.72) mg/L。尽管如此,供试测定矿化有机磷的菌株所产生的可溶性磷含量均显著高于对照。菌株的解钾能力则采用原子吸收光度计对培养3 d后培养基中产生的可溶性钾含量进行测定。其中菌株M3解钾能力较强,可溶性钾量为(8.59±0.08) mg/L;O9解钾能力较弱,培养基中可溶性钾含量为(5.32±0.13) mg/L, 但均显著高于无菌对照组。

**表示组间具有极显著差异(P<0.01)。下同。** depicts significant difference between-group (P<0.01). The same below.图1 不同菌株在培养基底物分别为有机磷(a)和无机磷(b)时的溶磷情况Fig.1 Soluble phosphorus production in different strains on either the organic (a) or inorganic phosphorus medium (b)
2.2 菌株鉴定及分类
采用生理生化试验与分子片段测序2 种方法对功能菌株的分类结果,选择各菌株的gyrB序列进行上传用于获取NCBI登录号进行登记(表3),并通过MEGA6软件对构建12 株菌株的系统进化树(图2)。由图2可知:菌株G3、M3归为不动杆菌属Acinetobacter;菌株B9属芽孢杆菌属Bacillus;菌株O9为沙雷氏菌属Serratia;菌株J8、E12、C9、D5、F5分别是假单胞菌属Pseudomonas的成员;菌株B7、H5为肠杆菌属Enterobacter。
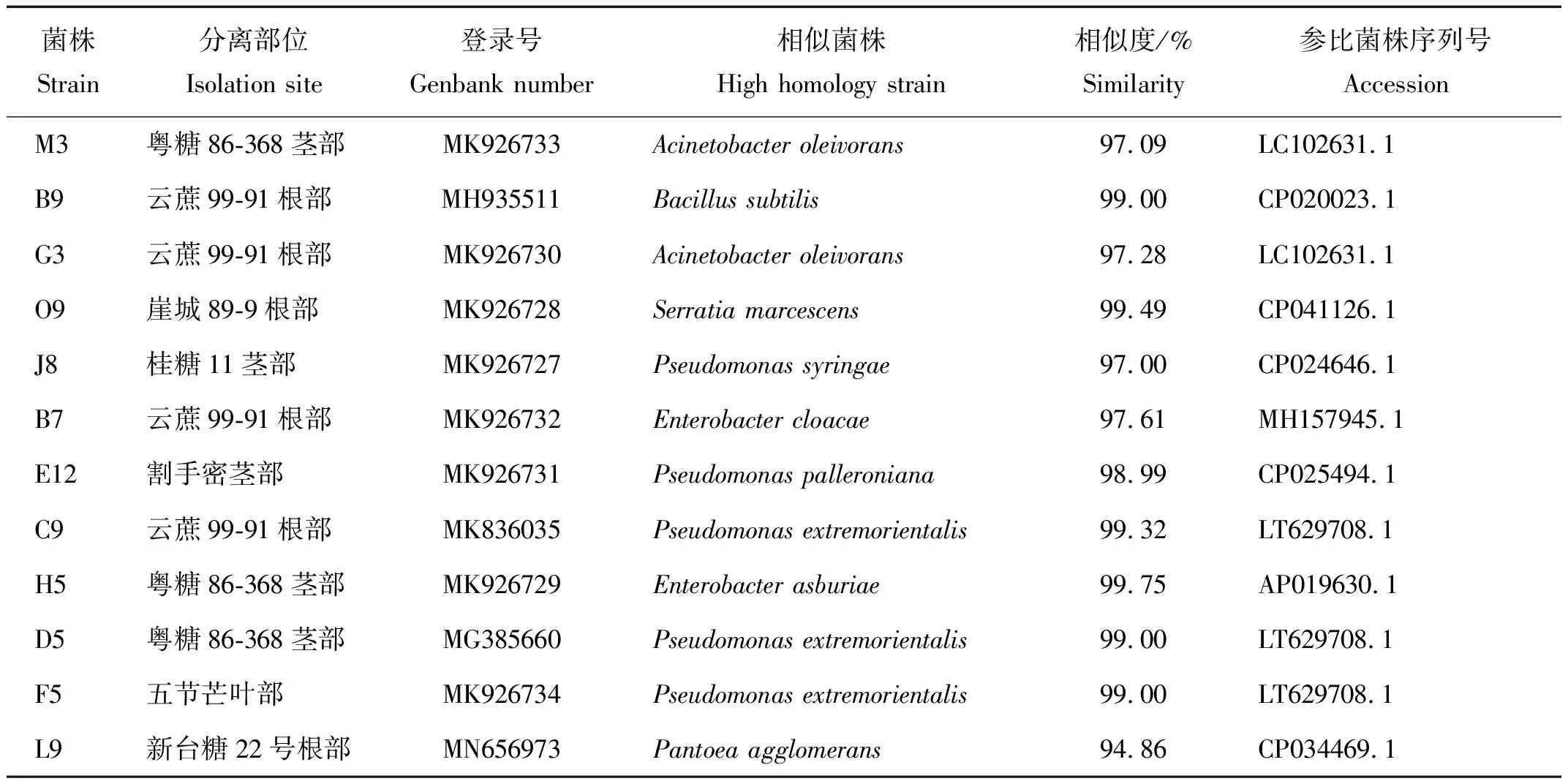
表3 菌株gyrB基因序列与NCBI数据库比对结果Table 3 Alignment of the gyrB gene sequence of the tested strain with the NCBI database
2.3 菌株分泌有机酸的能力及种类测定
对2.1获得的7 株溶磷菌产生有机酸种类及含量进行测定,结果见表4。菌株G3、F5、H5、B7、C9、O9、M3 这7株菌株产生的有机酸种类主要为酒石酸,其中:B7菌株酒石酸含量最高,O9酒石酸含量最低;G3能产生3 种有机酸,分别为酒石酸、苹果酸与乙酸;O9产生有机酸种类最多,包括酒石酸、苹果酸、乳酸、乙酸和柠檬酸。同时在对培养基中可溶性磷含量进行测定时也发现培养基中pH随培养时间增加而变低,有机酸的测定证实了培养基中pH的下降与菌株产生有机酸有关。
2.4 菌株IAA的定量测定
菌株IAA的定量测定结果见图3。结果显示培养基中有无色氨酸的存在,对菌株产生IAA的能力是有显著影响的:图3(a)中为培养基中含有色氨酸时,菌株产生IAA的情况,其中菌株L9在加入色氨酸的培养基中IAA含量最高,随后为菌株B9、E12、H5。其余菌株因变色反应不明显未放置于结果中;图3(b)为培养基中不含有色氨酸的情况下各菌株产生IAA的情况,其中B9菌株相对其余菌株产生IAA含量较高,其余菌株分泌量均在4 mg/L以下。由此可见,各菌株在以色氨酸为底物下会导致产生IAA的能力变强,IAA产生量得到增加的菌株有J8、L9、O9、D5、B9、H5、E12,增加明显的是L9菌株。
2.5 菌株产生嗜铁素能力
在CAS平板上,菌株E12、J8出现了明显的黄色晕圈,其余菌株黄色晕圈不明显。对嗜铁素类型分析结果显示菌株H5、B7、C9、D5、E12、F5和J8为异羟肟酸类铁载体,O9、H5、B7为儿茶酚铁载体;O9、L9、J8、H5、G3、C9和B9具有羧酸型嗜铁素。菌株B7、B9、C9、E12、J8、H5、L9、O9为混合嗜铁素;菌株D5、F5为单一型嗜铁素;菌株M3不产生嗜铁素。
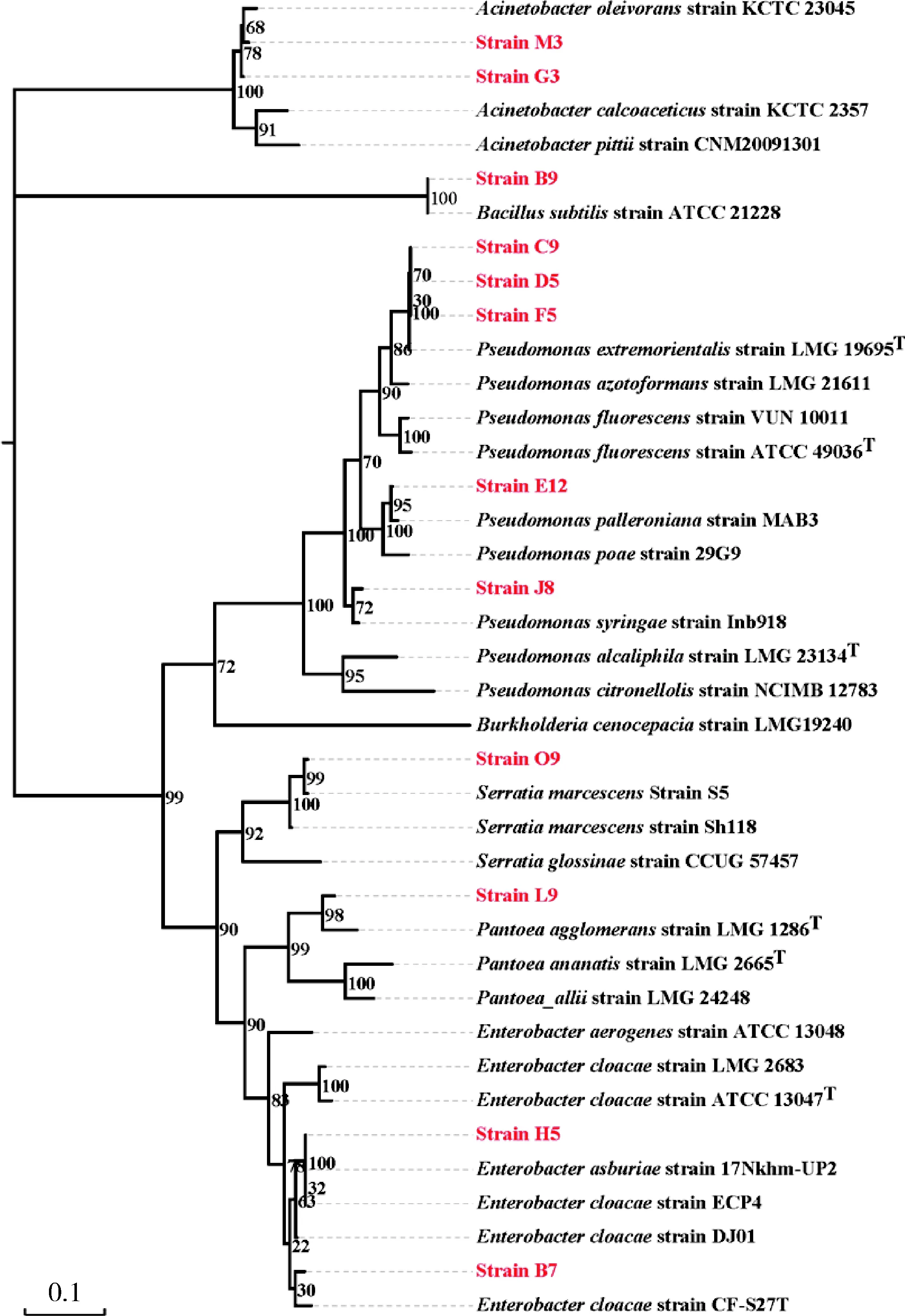
分支上的数字表示bootstrap值,bootstrap值越高,可信度越大。Numbers above branches represent bootstrap values. The higher bootstrap value and the greater the confidence.图2 采用最大似然法构建和基于细菌gyrB序列构建12株菌株的聚类树Fig.2 Phylogenetic analysis by the Maximum Likelihood method based on gyrB gene of 12 tested strains
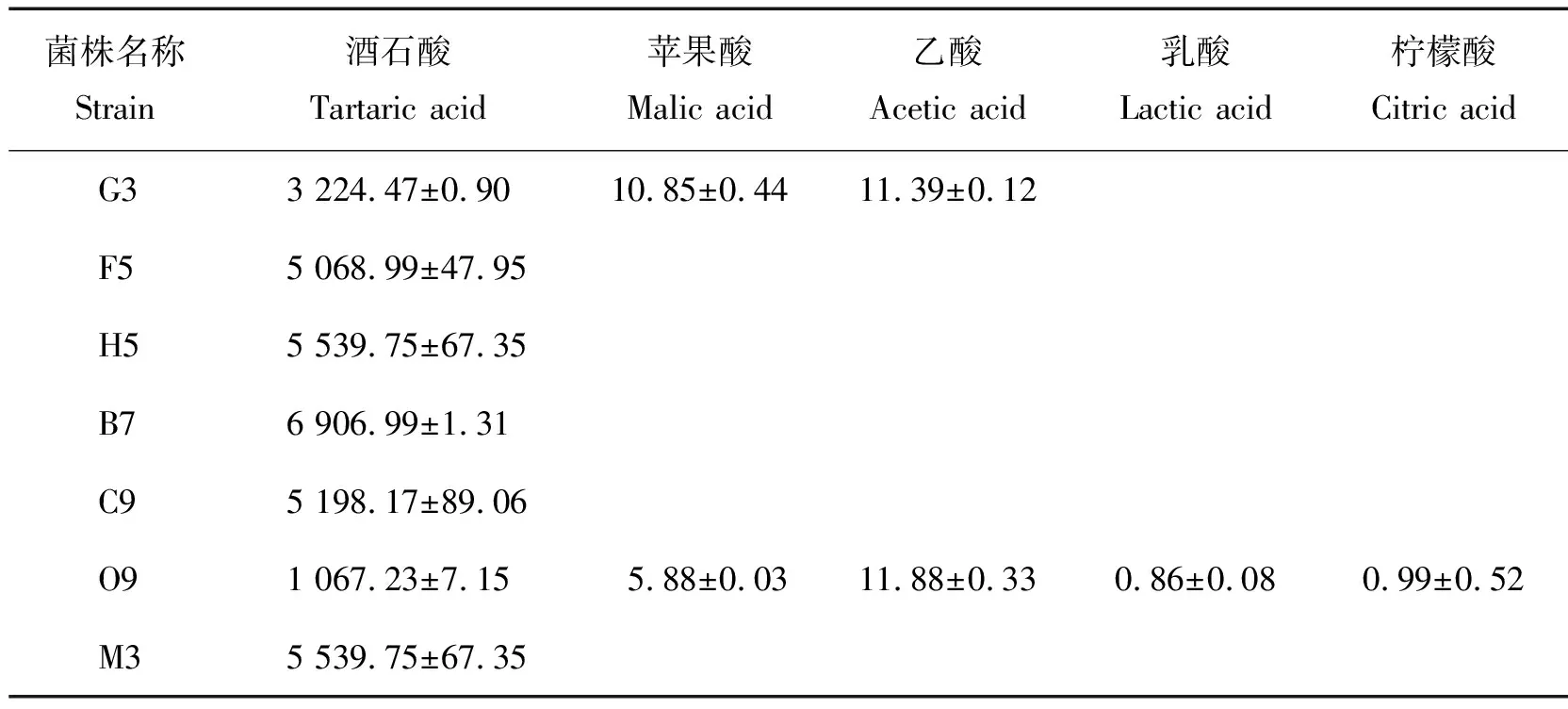
表4 菌株产生有机酸的种类及含量Table 4 The types and contents of organic acids production by strains ng/μL
2.6 菌株的促生长能力探究
菌株对甘蔗种苗的促生长能力受菌株的种类差异而不同,其中促生长能力最强的菌株为E12,在浸泡7 d过后,E12菌株处理组甘蔗幼苗长度最大,其后依次为C9、G3菌株处理组(图4)。各菌株处理组在株高指标中都极显著优于不接菌处理(图4 (a));根长指标表现最优的为菌株G3,其次为C9与B9,其中除了F5菌株处理组外,其余处理组均极显著优于CK对照,表明以上几株菌株可以促进甘蔗种苗生长发育(图4(b))。
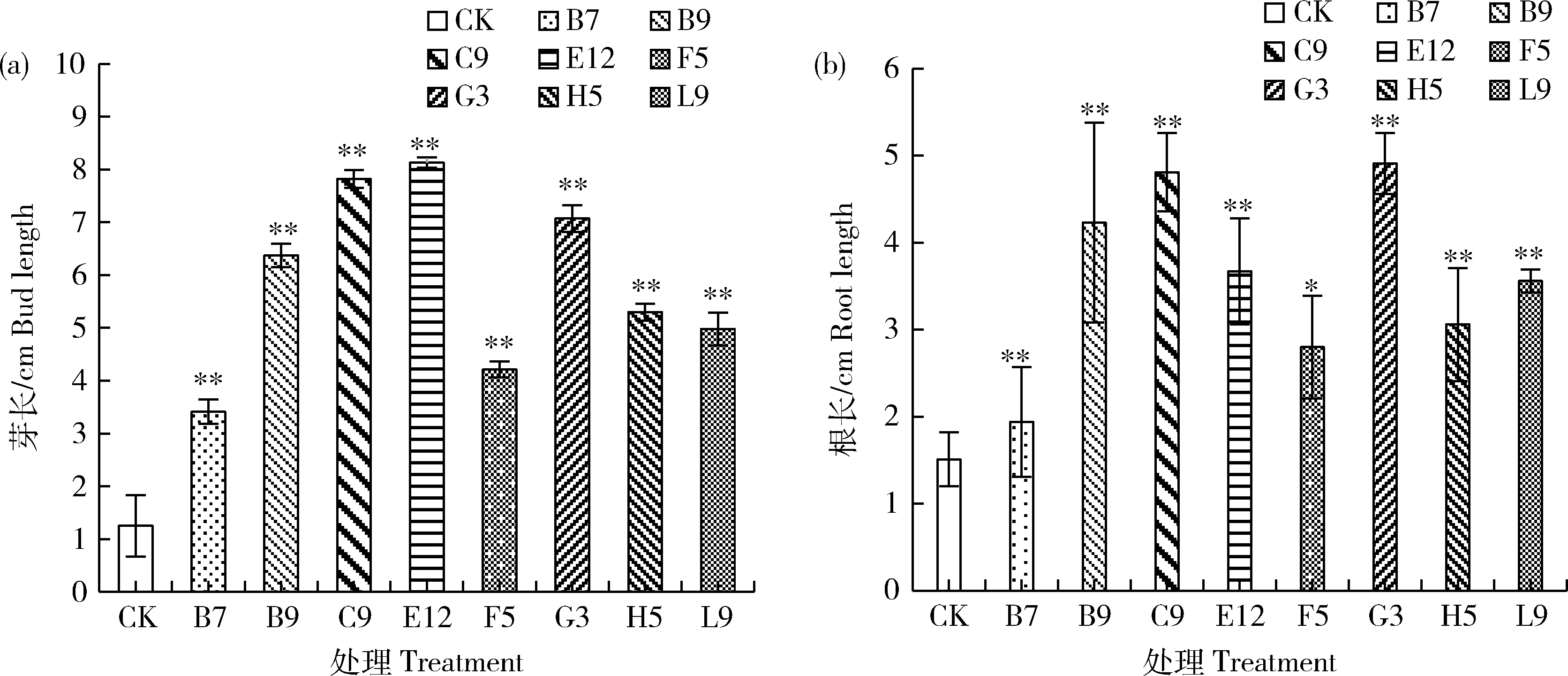
*表示组间具有显著差异(P<0.05)。* depicts significant difference between groups at P<0.05.图4 不同内生菌对甘蔗种苗的芽长(a)与根长(b)的促生长效应Fig.4 Growth promotion effects between bud length (a) and root length (b) of sugarcane gems by different endophytic bacteria
3 讨 论
3.1 溶磷菌株的筛选与溶磷机理的探究
筛选溶磷细菌的主要途径为固体平板培养的水解圈测定法,该方法通过比较水解透明圈与菌落直径比判断溶磷活性的强弱[56],再用液体培养法定量测定可溶性溶磷含量。本研究中,在筛选溶磷细菌时选用了3种常用筛选溶磷微生物的选择培养基,尽可能排除筛选过程中因培养基不适当而造成的筛选疏漏。发现具有较大溶磷圈的菌株并未在液体培养法定量测定中溶解更多的磷,如B7与M3菌株在植酸钙培养基与PVK培养基中水解圈较大,而在可溶性磷的定量测定中2株菌株在液体培养基中的溶磷含量并不高;反之,菌株G3在平板上溶磷圈与其他菌株相比不是效果最优的菌株,但在液体培养基中,所测定得到的可溶性磷含量最大。上述结果与刘文干等[57]研究结果一致。单一的透明圈比值不能真实地反映菌株在溶磷培养基的所释放的可溶性磷量[38],有些溶磷菌虽然在固体平板上无法形成水解圈,但液体培养时依然可以利用多种难溶性无机磷。本研究在平板筛选测定溶磷活性后,设计了液体培养法定量测定各菌株的溶磷能力。另外,在定量测定菌株溶磷能力试验中发现,本次分离出的菌株溶磷能力较强,有些菌株发酵液中可溶性磷含量大于1 000 mg/L,说明本研究所分离的菌株可能具有更大的研发价值,有待进一步研究确认。
目前探究内生菌株分泌有机酸的研究较少,原因是此类研究多半围绕探究土壤中溶磷细菌的溶磷机理展开,而非针对植物内生菌。陈丹阳等[58]在江西省九江市森林土样分离的30余株细菌中,有2株菌株溶磷能力优秀,分别为鞘氨醇单胞菌属(Sphingomonas)以及克雷白氏杆菌属(Klebsiella),在含磷酸钙的液体培养基中培养3 d后,其培养基可溶性磷含量为(219.69±3.38) mg/L与(216.96±11.25) mg/L,并且在探究菌株有机酸种类时采用薄板层析法,发现2种有机酸分别为有丙酸和琥珀酸,但由于试验为定性检测,并未检测出有机酸的数量大小。张英等[59]对分离于兰州、酒泉、定西等地植物根际的6 株溶磷细菌进行溶磷能力的测定,发现6 株菌株的溶磷能力106.53~373.44 mg/L。李海云等[60]分析红三叶根际溶磷菌株分泌有机酸与溶磷能力发现:菌株MHS7、MHS27、MHS30和MHS49均能分泌乳酸、草酸、苹果酸、富马酸和丁二酸,菌株MHS30还能够分泌酒石酸。在与根际溶磷菌比较中,内生菌产生的有机酸较少,但是种类相差不大。由于将功能内生菌开发成微生物菌剂,伴随根部浇施接种于植物的栽培方式应用增多,因此,内生菌在土壤中是否能活化土壤中的闭蓄态磷,将其转化成植物可用的磷源物质,值得进一步探究。当前溶磷菌株参与溶磷过程的主要机理有库理论(Sink theory)[61]、有机酸(Organic acid,OA)说[62]、胞外多糖学说以及H+外泌所引起的酸化理论[63]。其中,OA说是普遍公认的溶磷菌株发挥溶磷活性的主要机制:首先,菌株合成低分子量的有机酸;然后,有机酸分泌至胞外,因为螯合效应导致周围的金属离子浓度或引起基质的pH下降,造成自身细胞及其周围环境的酸化;最后,H+取代了各种金属元素或者Ca2+,从而导致磷被释放。在菌株解钾方面,菌株分泌的有机酸也同样扮演着重要的角色[64-65]。本研究中,检测到菌株产生的有机酸为酒石酸、丁二酸、苹果酸、乳酸和乙酸,酒石酸在所有分泌有机酸数量中所占比例最大,其原因尚未得知,将在后续试验中继续深入研究。现阶段可推测菌株具有的溶磷特性与其自身产生的大量有机酸有关。
3.2 菌株分泌的IAA
生长素IAA是一种植物激素,可促进根系发育、次生根产生、细胞分化、种子萌发[66]。将细菌产生IAA能力作为重要促生长机制是在研究农杆菌(Agrobacerium)对宿主植物结瘤诱导的分子机制中发现的。农杆菌分泌的IAA可以在没有植物生长调节剂的情况下促进植物生长,后对促生长菌株分离筛选的研究中,IAA的产生与数量成为主要筛选指标[67-69]。已有研究表明多种微生物可以通过多种途径合成IAA,研究发现色氨酸是细菌IAA生物合成的主要前体物质,以色氨酸为前体的IAA生物合成途径至少有5种,包括吲哚-3-丙酮酸途径(Indole-3-pyruvate pathway)、吲哚乙酰胺合成途径(Indole-3-acetamide pathway)、色胺途径(Tryptamine pathway)、吲哚-3-乙腈途径(Indole-3-acetonitrile pathway)、色氨酸侧链氧化酶途径(Tryptophan side-chain oxidase pathway)等。在本研究筛选得到的菌株在施加外源色氨酸之后,产生的IAA量大幅增加,少数菌株在不含外源色氨酸的前提下,也产生了少部分的IAA,可推测其可能有其他代谢通路合成IAA。Ahmed等[70]分离的Bacillusflexus芽孢杆菌 P4所产生的IAA含量达59 μg/mL,解淀粉芽孢杆菌SQR9产生IAA含量达32.3 ug/mL。相比而言,本研究中L9与B9这2 株细菌产生的IAA含量分别达(98.57±4.37)和(57.95±1.36) mg/L,推测该2株细菌可能有更高的促生长功能。
3.3 分离当地内生菌意义
植物内生菌具有与根际促生长微生物同样的促生机制,包括:1)通过改变土壤中一些无效元素的形态,从而可为作物吸收利用。如增加土壤中的可用养分、土壤有机质含量、分泌有机酸以溶解磷元素并使其有效化,因而为植物提供更多可用的磷和钾[26];2)通过自身固氮酶等物质的产生,把氮分子变为能被植物消化、吸收的氮原子。在土壤氮含量缺乏时可以帮助植株固氮,以保障作物的生长发育和产量[71];3)通过产生植物激素(生长素、细胞激动素和赤霉素等),促进植物生长发育,并且提高苗株抗逆性增强适应能力;4)通过增加植物代谢相关酶促进植物光物质产物的代谢和积累、提高植物光合效率;5)通过产生具有螯合作用的嗜铁素增加植物铁的供给,同时清除植物根围可供病原菌利用的铁元素,减少病原菌的存活数量等。
某些内生菌对宿主的促生长作用往往受制于环境因素及宿主基因型,对宿主具有选择且易受环境干扰[72],导致部分获得的促生内生菌无法在其他地区应用,难达到理想促生效果[73],因此有必要开发和挖掘当地内生菌资源并运用当地农业生产。云南省昆明市云南农业大学甘蔗研究所保存着与甘蔗有着亲缘关系的丰富的珍贵资源,这些资源可为甘蔗中内生菌筛选提供充足的材料,也为探究其促进甘蔗耐旱、耐瘠等特性提供了新资源。
4 结 论
本研究从589株细菌样本中筛选出具有固氮溶磷解钾活性的功能菌株共12 株,并通过对其看家基因片段的测序及NCBI数据库比对,确定了菌株的分类;在此基础上,对菌株促生长相关指标的活性及能力大小进行了定性及定量测定,主要测定了菌株的固氮、溶磷、解钾及分泌IAA、嗜铁素和有机酸等功能;同时筛选了甘蔗栽培种和甘蔗野生资源的内生菌资源中的有益功能菌;发现具有分泌有机酸的能力的菌株,可以用灌根的方式施用于土壤,发挥其溶磷解钾等功能,预示着菌株在田间应用的可能性。本研究可为今后甘蔗专用菌肥的菌种多样性制备及研究混合菌肥提供依据。
