温度与触觉感受器的发现与研究进展
——2021年诺贝尔生理学或医学奖解读
2021-12-23解恒昌付小雨沈伟
解恒昌,付小雨,沈伟
上海科技大学 生命科学与技术学院,上海 201210
北京时间2021年10月4日,2021年诺贝尔生理学或医学奖评选结果揭晓。诺贝尔奖委员会宣布将今年的诺贝尔生理学或医学奖授予戴维·朱利叶斯(David Jay Julius)和阿登·帕塔普蒂安(Ardem Patapoutian)以表彰他们在“发现温度和触觉感受器”方面作出的巨大贡献。本文对辣椒素受体TRPV1和机械力受体PIEZO的发现过程及最新进展作以综述。
1 TRPV1与PIEZO的发现
感知和适应环境的能力对于所有生物体的生存都是必不可少的,触觉、本体感觉、温度感觉使生物体能够感受外界环境和自身状态,在复杂的自然环境中存活。发现介导这些感觉的受体,是解码这些感觉的基础,并可促进人们对痛觉和本体感觉异常疾病的理解。
戴维·朱利叶斯出生于1955年,先后在麻省理工学院和加州大学伯克利分校获得本科和博士学位,随后在哥伦比亚大学诺贝尔生理学或医学奖获得者理查德·阿克塞尔(Richard Axel)实验室进行博士后训练。朱利叶斯在博士后期间利用表达克隆技术鉴定了5-羟色胺1C受体。他将体外克隆的候选cDNA导入非洲爪蟾的卵母细胞中进行异源表达,验证表达细胞对5-羟色胺的敏感性,最终发现了5-羟色胺1C受体[1]。
1989年,朱利叶斯在加州大学旧金山分校建立了自己的实验室。由于对“自然界中的天然物质如何与人类受体相互作用”这一科学问题的兴趣,朱利叶斯逐渐从对5-羟色胺受体研究转向克隆辣椒素受体。他认为对辣椒素受体作用的深入探究有助于科学家对痛觉更深入地了解。朱利叶斯与他的博士后研究员迈克尔·凯瑟琳(Michael J. Caterina)进行了候选文库的克隆表达和筛选。他们用啮齿动物的背根神经节制作了cDNA文库,使用这些cDNA分批次转入对辣椒素不敏感的细胞,最终分离出单个的cDNA克隆,将它转入细胞可以使原本对辣椒素没有反应的细胞对辣椒素产生反应,并将其命名为香草素受体1(VR1)[2](图1)。随后的功能实验中,朱利叶斯等发现该受体对温度敏感,高热量导致表达该受体的细胞钙离子内流,其激活阈值大于40°C,接近于热痛。至此,朱利叶斯鉴定出辣椒素受体TRPV1,并建立起该受体与温度感受和痛觉的联系。在小鼠中,TRPV1在伤害性神经元中表达,并被证实参与感受伤害性疼痛及炎症性痛觉过敏[3]。随后,朱利叶斯实验室通过类似的方法还鉴定了薄荷醇受体TRPM8,并发现其同时也是感应冷刺激(<15°C)的受体[4]。
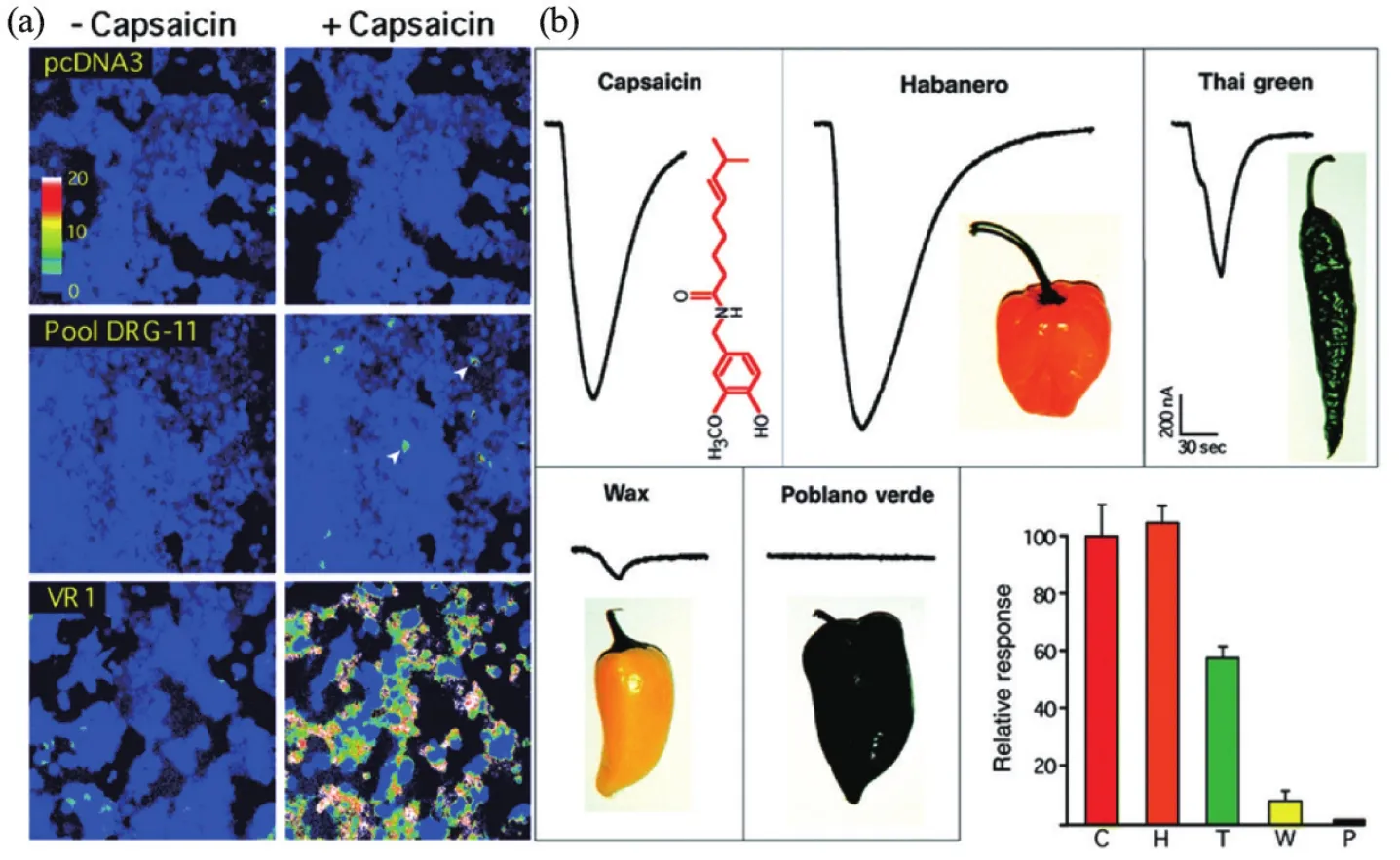
图1 辣椒素受体TRPV1的发现[2]。(a)用cDNA克隆库转染的HEK293细胞。在DRG-11池中,一些细胞对辣椒素有反应。经过反复实验,鉴定了一个对应于TRPV1(VR1)的克隆。(b)表达VR1的卵母细胞对辣椒素(10 μmol/L)和4种辣椒提取物的反应
阿登·帕塔普蒂安出生于1967年,曾在黎巴嫩的贝鲁特美国大学学习化学,而后在加州大学洛杉矶分校获得细胞和发育生物学学士学位,在加州理工学院获得发育生物学博士学位。他在加州大学旧金山分校完成了博士后阶段的工作后,于2000年加入斯克里普斯研究所(The Scripps Research Institute)。
帕塔普蒂安在事业发展的早期也加入温度受体的研究,曾与朱利叶斯实验室同时分别发现了冷觉受体TRPM8[5]。随后,帕塔普蒂安开始关注更为复杂的机械力感受机制。他和他的博士后伯特兰·科斯特(Bertrand Coste)首先筛选确定Neuron2A细胞系可以感受机械压力,并对其表达基因进行分析。他们确定了72个候选基因,并对候选基因进行RNA干扰以分别沉默这些基因的表达,对沉默后的细胞系进行压力测试并使用膜片钳记录其电流。最终,他们发现使用RNA沉默的办法敲除FAM38A基因可以消除机械力激活的电流,该基因表达的蛋白被命名为PIEZO1(希腊语为压力的意思)[6](图2)。将PIEZO1表达在人胚胎肾细胞细胞系(HEK-293)中,可以使原本对机械力不敏感的细胞产生机械力敏感电流。随后根据PIEZO1同源分析又发现了第二个机械力敏感通道PIEZO2[6]。PIEZO2在背根神经节感觉神经元中表达,随后在转基因小鼠中发现敲除PIEZO2的小鼠缺乏轻触感觉。此外,PIEZO2还参与小鼠本体感受,缺失会导致小鼠运动不协调和肢体位置异常。至此,帕塔普蒂安等鉴定出了一种全新的脊椎动物机械力敏感通道,并确认它们在机体触觉和本体感觉中的关键性作用。
自此,以朱利叶斯和帕塔普蒂安两位科学家为首的科研团队发现了温度感觉和触觉的关键受体,其中TRP通道是介导温度感觉和相关痛觉的核心,PIEZO通道是机体具有触觉和本体感觉的关键。两位科学家的工作拓展了感觉神经生物学的维度,揭示了机体感知世界的生物学基础,解开了躯体感觉如何让我们感受物理世界并与之互动的未解之谜。在朱利叶斯和帕塔普蒂安的工作基础上,科学家对机体温度感觉和触觉的了解不断加深,在这一领域涌现出大量的研究成果。现在已经发现,除了作为光、温度和疼痛的感受器外,拥有7个亚族的TRP通道家族也在呼吸系统和心血管系统疾病如哮喘、心衰等方面发挥关键作用,并在前列腺癌等多种癌症的迁移以及中风、皮肤病等多种疾病中被报道有所参与[7]。而PIEZO家族在终端触觉、本体感觉中发挥重要作用,并通过分布在血管和肺部的神经末梢感知压力,影响红细胞体积和血管生理功能,引发多种人类遗传疾病[8](详见第2部分)。此外,科学家还依据TRP和PIEZO的结构和功能开展了痛觉和本体感觉失调疾病的药物研发[8-9](详见第3部分)。
2 TRP蛋白与PIEZO蛋白的研究进展
TRP家族首次在果蝇光感受突变体中被鉴定,都由6个跨膜结构域组成,它们组成四聚体复合物发挥功能,可分为TRPC、TRPV、TRPM、TRPN、TRPA亚家族及进化距离更远的TRPP及TRPML亚家族[10-11]。TRP蛋白家族进化上保守,在果蝇、线虫、斑马鱼、啮齿类动物及灵长类动物中,对视觉、味觉、机械感觉、温度感觉都有重要的作用。TRPV1蛋白结构是使用冷冻电镜解析的第一个膜蛋白结构,由朱利叶斯和程亦凡实验室在2013年合作完成[12-13]。冷冻电镜解析蛋白结构表明,TRPV1有两个离子通过位点,在阳离子传导孔的两端形成两个突出的物理结构,辣椒素的结合位点位于靠近细胞质侧的膜深处的口袋。最近的一项结构研究表明,有害热量会在辣椒素结合的TRPV1通道中产生两种构象门控转变:第一个过渡态为通道打开做好准备,而第二个过渡态导致通道打开[14]。
除TRPV1外,其中至少7种TRP蛋白被证明在哺乳动物温度感应中发挥作用,展现出不同的温度阈值,被称为thermoTRP[15]。TRPV1表达在背根神经节和所发出的C类神经纤维中,还表达于支配膀胱和气道的感觉纤维和下丘脑中[10,16-20]。敲除TRPV1的小鼠可以完全抑制辣椒素引起的伤害性痛觉,但是对低度热的响应基本完整,只有伤害性高热才存在差异。因此TRPV1并不能完全解释热感受现象,必然还存在着其他的热感应机制。Vriens等人[21]报道了TRPM3作为有害热量的感受器之一,然而在敲除TRPV1和TRPM3的小鼠中,有害热的反射并没有完全消除。最终,Vandewauw等人[22]发现TRPM3/TRPV1/TRPA1的三敲除小鼠基本失去了对伤害性热刺激的响应。与TRPV1形成鲜明对比的是,TRPM8敲除小鼠完全失去了辨别中等低温(10~26°C)的能力,说明此单一通道足以介导此温度范围的感受现象[23]。此外,另外的几个thermoTRP被认为也可以感受热:TRPV2在高热环境下被激活(52°C),TRPV3和TRPV4在温暖环境中激活(33°C和27~42°C)[24-27](图3)。thermoTRP在外周及中枢神经中如何参与温度感应和反馈性调节体温也是当前神经生物学和生理学关注的重要焦点问题。

图3 温度瞬时受体电位(TRP)通道[27]。从结构上讲,thermoTRP是四聚体,每个亚基包含6个跨膜结构域(S1~S6)、1个连接跨膜S5和S6的疏水孔环,以及细胞质侧的N-和C-末端。除了TRPM8,所有thermoTRP在N端都具有可变数量的锚蛋白重复结构域。thermoTRP显示出从有害的寒冷(TRPA1)到有害高温(TRPV2)的不同热阈值。每个thermoTRP也被特定的天然或合成化合物激活,会诱导人类产生相关的热感和疼痛感
PIEZO1是迄今为止鉴定出的最大的跨膜离子通道亚基。帕塔普蒂安、杨茂君、肖百龙、李雪明、罗德里克·麦金农(Roderick MacKinnon)等实验室的工作揭示了PIEZO1和PIEZO2的高分辨率结构,并表明这些通道形成具有中心离子传导孔和三个外围大型机械传感螺旋桨形叶片的同三聚体结构[28-29]。当对膜施加机械力时,弯曲的叶片变平并导致中心孔的开口,带有弯曲叶片的螺旋桨状结构产生较大的平面内膜面积膨胀,从而感知到精细机械力[30-31]。
帕塔普蒂安的实验室在发现PIEZO1与PIEZO2之后的10年里,在小鼠与人中对这两个机械力敏感的离子通道蛋白的功能进行了多方面的研究。PIEZO1在血管发育与重塑以及血压调节中有重要作用,参与淋巴瓣形成,调节角质形成、细胞迁移和伤口愈合。PIEZO1将机械力与红细胞体积联系起来,非洲人群中常见的piezo1等位基因E275del可导致红细胞脱水并减轻疟原虫感染。PIEZO1的功能获得性突变会导致脱水遗传性口型红细胞增多症,并且个体可能会随着年龄增长出现铁过载症状。PIEZO1的功能丧失性突变与常染色体隐性遗传淋巴管发育不良有关。PIEZO2在膀胱尿路上皮和支配感觉神经元中都充当传感器。PIEZO2是一种气道拉伸传感器,它所介导的气道支配感觉神经元内的机械转导对于在出生时建立有效的呼吸和维持成人的正常呼吸至关重要。若PIEZO2发生功能获得性突变,会导致一种远端关节弯曲疾病亚型。PIEZO蛋白的详细功能介绍及突变可能导致的疾病见表1。如何以PIEZO分子为突破口理解人类本体等多种复杂机械力的感受机制,以及如何利用结构生物学理解PIEZO相关突变的致病机制是当前研究的重要热点。
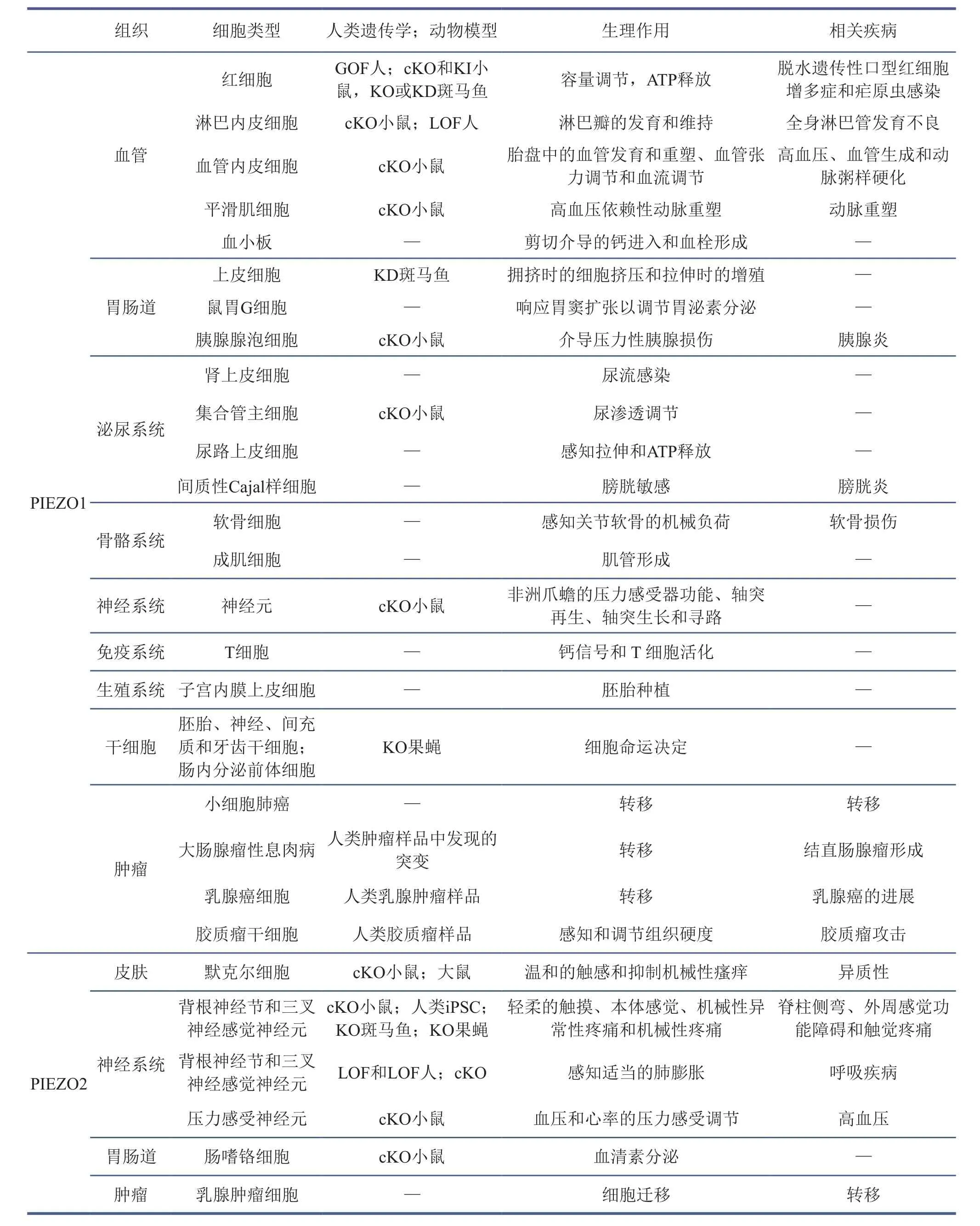
表1 PIEZO蛋白的表达与功能[8]
3 TRPV1和PIEZO的药物研发
当前治疗疼痛的药物市场仍然由已经存在了几十年的药物主导,慢性疼痛的治疗常常不能令人满意。如阿片类药物虽然是有效的止痛药,但作用于中枢神经系统,也会使人上瘾。避免阿片类药物副作用的合理策略是针对疼痛通路的起点——产生疼痛的伤害感受器研发新药[32]。因此,制药公司对响应有害刺激的TRP通道表现出极大的兴趣。高剂量的辣椒素和位点特异性注射被临床证明在骨关节炎患者、带状疱疹后神经痛和糖尿病多发性疼痛患者中有缓解疼痛的作用。但由于辣椒素会引发强烈的初始疼痛反应,并会引起体温改变[33],限制了患者的耐受剂量[34]。为了减少这种不利影响,已经开发了“非刺激性”TRPV1激动剂,如olvanil (NE19550)和MRD-652,它们在受体的激活动力学方面与辣椒素不同[35-36]。这些化合物显示在疼痛的动物模型中是有效果的,但其临床价值仍有待证明。此外,TRPV1、TRPA1及TRPV4在呼吸系统中广泛表达,被认为参与哮喘、慢性阻塞性肺病(COPD)的病理过程[37-38]。一种口服的、生物可利用的小分子TRPA1选择性拮抗剂GDC-0334在呼吸系统疾病的临床前模型中可以抑制几种物种的咳嗽反应、气道平滑肌高反应性和水肿形成,但其临床效果有待试验验证[39]。此外,TRPV1拮抗剂PAC-14028(现处于III期临床试验阶段)可改善皮肤屏障功能并缓解特应性皮炎患者的瘙痒[40]。遗传失活(Trpv1-/-小鼠)或小分子拮抗剂BCTC291对TRPV1的药理阻断,均可使口服葡萄糖耐量和葡萄糖刺激的胰岛素分泌得到改善。TRPV1拮抗剂XEN-D0501目前正在2型糖尿病(T2DM)患者中进行II期临床试验,具有良好的耐受性和安全性[41]。
PIEZO1和PIEZO2的非特异性阻滞剂包括RR、钆(Gd3+)以及肽毒素 GsMTx-4。2015年,帕塔普蒂安实验室筛选到了PIEZO1的第一个激动剂Yoda1[42]。3年后,肖百龙实验室筛选到了PIEZO1的另外两种激动剂Jedi1和Jedi2[43]。而PIEZO2因为其快速失活的动力学特性仍未找到特异性激动剂。总的来说,当前机械力敏感受体的药理学研究仍处于起步阶段,缺乏高特异性的激动剂和拮抗剂,然而这对于机械力敏感受体相关的药物开发是至关重要的。鉴于PIEZO1在各种组织和细胞类型中广泛的生物学作用,一个明显的挑战是如何在实现理想治疗效果的同时限制副作用。至于PIEZO2,虽然目前的研究表明它在外周感觉系统中的作用相对有限,但它参与多种基本的体感功能,这也可能对实现机械性异常性疼痛的特异性抑制提出挑战。识别PIEZO2介导其特定功能的感觉神经元类型可能会提高细胞靶向的特异性,而外用PIEZO2拮抗剂可能是专门治疗机械性异常性疼痛的一种选择。
4 结语
2021年度诺贝尔生理学或医学奖的工作是继1914年“前庭器官的生理和病理方面工作”、1967年“视黄醛参与视觉形成机制的诠释”、2004年“人体气味受体和嗅觉系统组织方式的研究”后,又一次获得诺贝尔奖的感觉神经生物学领域的研究。两位科学家的出色工作发现了温度感觉与触觉这两种极为重要但又“非经典的”(不依赖于某一特定器官)感觉受体。其鉴定出的分子如TRPV1、TRPM8、PIEZO1、PIEZO2等蛋白作为分子开关,打开了解码人类温度、痛觉和机械力感觉等相关生理过程的大门。它们所介导的生理和病理功能正在被一一阐释。其他相关的重要科学问题,如人体的体温如何稳定在37°C、冬眠的生物学机制、本体感觉的产生及神经环路等也将有望解决。
