大孔树脂法纯化核桃壳棕色素的研究
2021-12-23耿树香宁德鲁余旭亚韩本勇
李 涛,耿树香,马 婷,宁德鲁,赵 鹏,余旭亚,韩本勇*
(1.昆明理工大学生命科学与技术学院,云南 昆明 650500;2.云南省林业与草原科学院,云南 昆明 650201)
核桃(Walnut)又称胡桃、羌桃,属世界著名的四大干果之一[1]。我国核桃资源十分丰富,全国大多数省份都有栽种,栽种面积以及产量均居世界第一位[2]。核桃加工后的主要副产物-核桃壳,目前大多被抛弃或焚烧处理。研究表明,核桃壳中含有一定量的棕色素,是一种较为理想的天然色素资源,因此从核桃壳中提取棕色素既有利于废弃物的回收利用又有益于环境保护。
目前对核桃壳棕色素的提取[3-6]有相关文献报道,但对色素的纯化及化学性质等方面的研究报道较少。李维莉等[7]采用大孔树脂对核桃壳棕色素进行纯化,结果表明AB-8大孔树脂对其有较高的吸附量,纯化效果较优。但由于粗提色素中含有大量的杂质,化学稳定性较差,限制了其应用,因而需进行精制。本研究采用AB-8大孔树脂对核桃壳棕色素进行纯化,主要优化了核桃壳棕色素动态纯化的最佳工艺条件,并对纯化后的核桃壳棕色素进行一系列的稳定性研究。
1 材料与方法
1.1 材料与仪器
核桃壳棕色素粗品(自制);AB-8大孔树脂(安徽三星树脂科技有限公司);芦丁标准品(贵州迪大科技有限责任公司);福林酚试剂(北京鼎国昌盛生物技术有限责任公司);亚硝酸钠、硝酸铝、没食子酸、无水乙醇、95%乙醇、CuSO4、FeCl3、AlCl3、ZnSO4、MgSO4、H2O2、Na2SO3等试剂为分析纯。
DHL-A电脑恒流泵、SBS-100自动部分收集器(上海沪西分析仪器厂);分光光度计(日本岛津);旋转蒸发仪(日本EYELA);电热恒温鼓风干燥箱(上海恒科仪器有限公司);冷冻干燥机(美国SIM);pH计(瑞士梅特勒-托利多);数字照度计(台湾泰仕)。
1.2 试验方法
1.2.1 核桃壳棕色素的提取方法
将核桃壳粉碎,烘干后用石油醚进行脱脂处理,然后用1%氢氧化钠溶液作为提取剂,超声辅助提取60 min,提取结束后离心、过滤分离,将上清液用柠檬酸中和至pH 7.0,冷冻干燥即得核桃壳棕色素粗品。
1.2.2 核桃壳棕色素的光谱测定
取少量色素粗制品,用去离子水配制成色素溶液,用紫外可见分光光度计,在200~800 nm波长范围内进行扫描,得到其吸收光谱图(见图1),以确定最大吸收峰值时波长。
1.2.3 动态吸附与解吸实验
吸附流速对树脂吸附的影响:先对AB-8大孔树脂,用95%乙醇进行浸泡24 h,湿法装柱,用水洗至无醇味后,再用5%HCl溶液继续浸泡4 h,水洗至中性后用5%NaOH溶液再浸泡4 h,水洗至中性后抽滤去水分,置于110℃烘箱中干燥6 h,自然冷却后备用。将预处理过的AB-8大孔树脂装柱,取一定量的稀释色素液上柱,分别设置流速为0.5 mL/min、1.5 mL/min和2.5 mL/min,分步收集流出液并在波长277 nm下测定吸光度。当流出液吸光度值为上柱前样液吸光度值的1/10时,认为到达泄露点,分别以流出液体积和流出液吸光值/色素原液吸光值(A/A0)为横、纵坐标,绘制泄露曲线[8-9]。
上样液浓度对树脂吸附的影响:将预处理过的AB-8大孔树脂装柱,分别配制浓度为1 mg/mL、2 mg/mL和3 mg/mL的色素溶液,将上样流速设为1.5 mL/min,分步收集流出液,在波长277 nm下测定吸光度并绘制泄露曲线[10]。
洗脱流速对树脂解吸的影响:取经预处理的AB-8大孔树脂装柱,向柱内流加浓度为2 mg/ml的色素溶液,待吸附饱和后,用50%的乙醇溶液作为解吸液,设置解吸液流速分别为1.0 mL/min、1.5 mL/min和2.0 mL/min,分步收集流出液并测定吸光度。
1.2.4 色价、黄酮、多酚的测定
色价的测定:准确称取纯化前后的核桃壳棕色素样品各0.1 g,用100 mL去离子水溶解,在其最大吸收波长277 nm处测定吸光度,然后以公式E1%1cm=AR计算色价[7],式中,A为样品溶液吸光度,R为100 mL浸提液上机测试时的稀释倍数。
黄酮含量测定:以芦丁作为标准品,采用硝酸铝-亚硝酸钠比色法分别测定纯化前后色素样品中的黄酮含量[11]。
多酚含量测定:总酚含量的测定采用Folin酚法,以没食子酸为标准品,制作标准曲线,然后分别测定纯化前后色素样品中的多酚含量[12]。
1.2.5 核桃壳棕色素的稳定性研究
(1)温度对核桃壳棕色素稳定性的影响
取适量纯化后的核桃壳色素制品,配制成0.01%的溶液,分别置于不同温度(25、40、60、80、100℃)保温4.0 h,每隔1.0 h取1次样,冷却后在277 nm处测定其吸光度[13]。
(2)光照对核桃壳棕色素稳定性的影响
取适量纯化后的核桃壳色素配制成0.01%的溶液,分别置于模拟的室内暗室(0 lux)、室内自然光(350 lux)和室外自然光(7500 lux)8.0 h,每隔1.0 h取1次样,在277 nm处测其吸光度[14]。
(3)pH值对核桃壳棕色素稳定性的影响
取适量纯化后的核桃壳色素配制成0.01%的溶液,用磷酸二氢钠-柠檬酸和甘氨酸-氢氧化钠缓冲液 配 置pH 3.0,pH 4.0,pH 5.0,pH 6.0,pH 7.0,pH 8.0,pH 9.0,pH 10.0的缓冲液,备用。分别量取2.0 mL色素溶液与8.0 mL不同pH值缓冲液混合均匀后,于277 nm处测定其吸光度,并观察颜色变化[15]。
(4)金属离子对核桃壳棕色素稳定性的影响
分别配制浓度为0.05 mol/L的NaCl、KCl、CaCl2、CuSO4、MgSO4、AlCl3、FeCl3、ZnCl2溶液,各取2 mL溶液,向其中加入8 mL 0.01%的色素溶液,以2.0 mL去离子水加8.0 mL色素溶液作为对照品。室温放置24 h后观察颜色变化并在277 nm处测定其吸光度[16]。
(5)氧化还原剂对核桃壳棕色素稳定性的影响
配制浓度为0.1%、1%、2%和5%的H2O2、Na2SO3溶液,分别吸取不同浓度的H2O2、Na2SO3溶液2.0 mL,各加入8.0 mL 0.01%的色素溶液,以2.0 mL去离子水加8.0 mL色素溶液作为对照品。室温放置1 h后观察颜色变化并在277 nm处测定其吸光度[8]。
2 结果与分析
2.1 试验方法
由图1可见,核桃壳棕色素溶液最大吸光度在277 nm处。
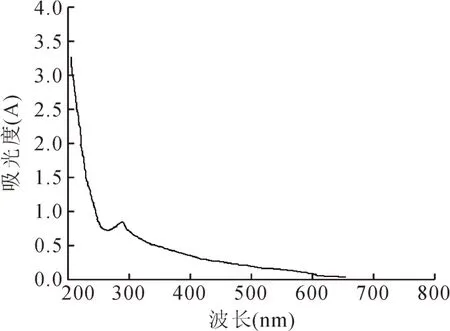
图1 核桃壳棕色素的全波长扫描图Fig.1 Full wavelength scan of walnut shell brown
2.2 动态吸附与解吸试验结果
2.2.1 吸附流速对大孔树脂吸附的影响
由图2可以看出,当上样液流速增加,泄露点提前。可能的原因在于流速过快,色素溶液还未能够与大孔树脂内表面充分接触就流出;而当吸附流速降低时,树脂的吸附效率有较大提升,但这过于耗费时间。因此,本实验中选取上样液吸附流速为1.5 mL/min。
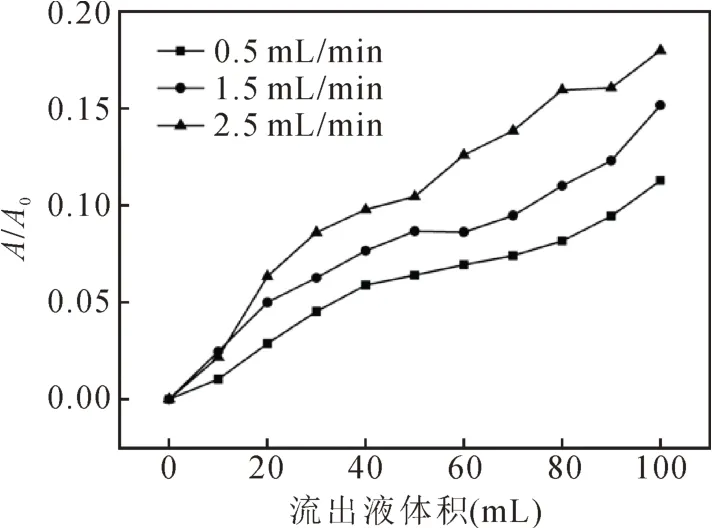
图2 吸附流速对树脂吸附的影响Fig.2 The influence of flow rate on ability of adsorption by macroporous resin
2.2.2 上样液浓度对大孔树脂吸附的影响
由图3可以看出,随着色素溶液浓度的增大,泄漏点出现的越早。此时,色素溶液浓度过低,色素不易被树脂吸附;而溶液浓度过高,则又会导致其中的杂质也被树脂吸附,因而不利于对色素的吸附,且对后续的洗脱等操作也不利。因此核桃壳棕色素上样液的浓度选取2 mg/mL较为合适。
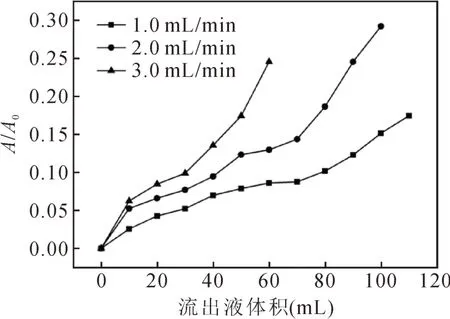
图3 上样液浓度对树脂吸附的影响Fig.3 The influenceof concentration on ability of adsorption by macroporous resin
2.2.3 洗脱流速对解吸效果的影响
从图4可以看出,当提升洗脱流速后,峰形变宽,洗脱不完全,而当流速为1 mL/min时,不但峰值最高,且没有拖尾现象,因此为了确保解吸效果,选取洗脱流速为1 mL/min进行解吸。

图4 洗脱流速对解吸的影响Fig.4 The influence of eluent rate on desorption property
2.3 色价、黄酮、多酚的测定结果
色价是评定天然色素的重要指标之一,它能够在一定程度上反映色素含量的高低及其着色能力的强弱。核桃壳中含有一定量的黄酮和多酚类物质,而这些也是天然色素的组成成分[17]。由表1可以看出,纯化后色素的色价是纯化前的3.58倍,黄酮和多酚含量分别是纯化前的1.34倍和1.59倍,表明纯化取得较好效果。
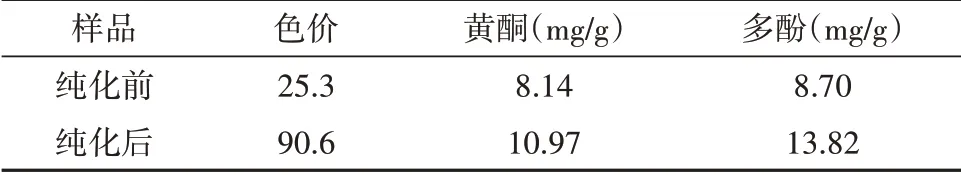
表1 纯化前后色价及黄酮、多酚含量变化Table 1 The color value,flavonoids and polyphenols content changes before and after the purification
2.4 核桃壳棕色素稳定性
2.4.1 温度对核桃壳棕色素稳定性的影响
由图5可知,在时间相同的条件下,当温度小于80℃时,色素溶液的吸光度随着温度的上升变化不大;当温度大于80℃时,色素溶液的吸光度随着温度的升高而增加。有文献曾报道高温或长时间加热会对色素造成较强的破坏[7],由于色素遭到破坏,导致在原特征峰下其吸光度值有所上升。综上说明核桃壳棕色素具有一定的耐热性。
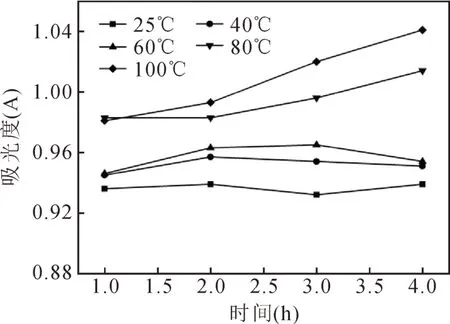
图5 温度对色素稳定性的影响Fig.5 Effect of temperature on the stability of pigment
2.4.2 光照对核桃壳棕色素稳定性的影响
由图6可知,核桃壳色素溶液在室内自然光、室外自然光和暗室环境中放置一段时间后吸光度都有所减小,经室外自然光处理后的吸光度值变化较室外自然光和暗室处理的变化明显。这说明日光照射促进了色素的降解,这可能是由于光线诱使组成天然色素的活性有机物分解或氧化而褪色[18],因此使用中应尽量避免在强光下长时间照射。
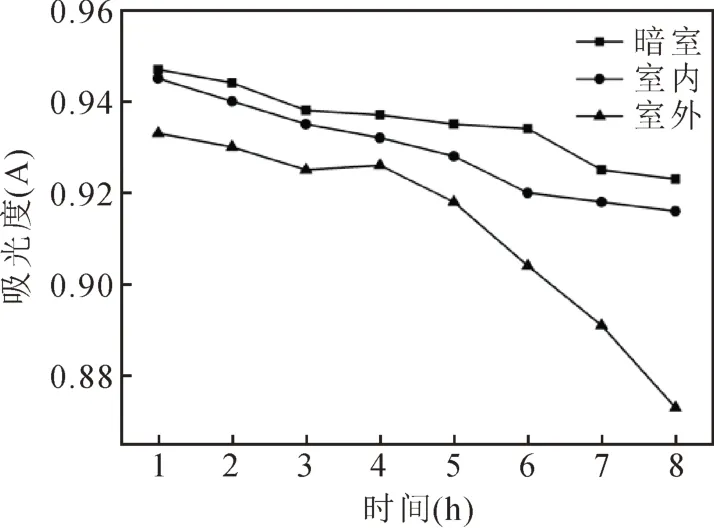
图6 光照对色素稳定性的影响Fig.6 Effect of light on the stability of pigment
2.4.3 pH值对核桃壳棕色素稳定性的影响
由图7可知,在酸性(pH<7)条件下,溶液的吸光度没有显著变化,而在pH超过8以后,随着碱性的增强,溶液的吸光度逐渐上升,而且溶液颜色略有加深。这可能是由于棕色素内含有黄酮类物质[19],而黄酮类化合物在酸性条件下稳定,而在碱性环境下其环状结构打开,产生查尔酮类物质,使溶液颜色加深[20]。由于色素成分遭到破坏,导致在原特征峰下其吸光度值有所上升。
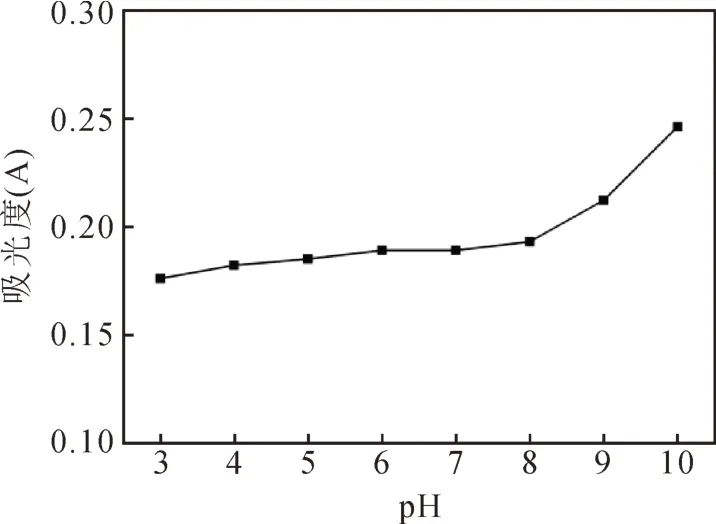
图7 不同pH值对色素稳定性的影响Fig.7 Effect of pH value on the stability of pigment
2.4.4 金属离子对桃壳棕色素稳定性的影响
由表2以看出,多数金属离子对色素无太大影响,但Cu2+、Al3+、Fe3+、Zn2+等离子能使色素颜色发生改变,同时有沉淀析出,可能这些离子与核桃壳棕色素形成络合物所致。对照品的吸光度值为0.765,从对应的吸光度也可以看出Cu2+、Al3+、Fe3+、Zn2+等离子对色素有破坏作用,因此在使用过程中应尽量避免与这些金属离子接触。

表2 金属离子对色素稳定性的影响Table 2 Effect of metal ions on the stability of pigment
2.4.5 氧化还原剂对核桃壳棕色素稳定性的影响
由图8可知,色素溶液的吸光度随着H2O2浓度的增大而显著上升,表明氧化剂对色素的破坏作用很大,在实际的应用中应避开与氧化剂直接接触,以免影响产品的质量;而随着Na2SO3浓度的增大只有略微增加,表明还原剂对色素的影响较小。
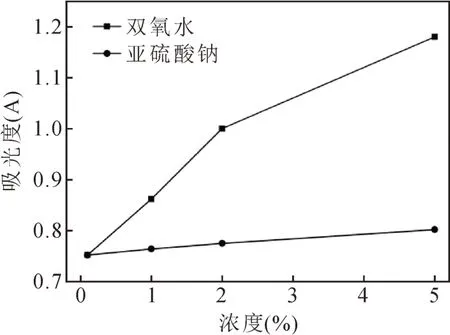
图8 氧化剂和还原剂对色素稳定性的影响Fig.8 Effect of oxidant and reducer on the stability of pigment
3 结论
(1)AB-8大孔树脂对核桃壳棕色素动态纯化的最佳工艺条件为:色素上样流速1.5 mL/min,上样液浓度为2.0 mg/mL,洗脱剂洗脱流速1.0 mL/min。
(2)纯化后色素的色价是纯化前的3.58倍,黄酮和多酚含量分别是纯化前的1.34倍和1.59倍,表明大孔树脂对核桃壳棕色素的纯化有较好效果。
(3)据稳定性试验分析,纯化后的核桃壳棕色素耐热性较好,在酸性以及中性条件下均比较稳定,室外光照、氧化剂和Cu2+、Al3+、Fe3+、Zn2+对其有一定影响。
