改变中心碳代谢途径对发酵生产L-亮氨酸的影响
2021-12-22孙鹏杰李澜潇张玉富徐庆阳
陈 宁 ,孙鹏杰,李澜潇,张玉富,徐庆阳
(1. 天津科技大学生物工程学院,天津 300457;2. 代谢控制发酵技术国家地方联合工程实验室,天津 300457)
随着L–亮氨酸市场需求的增加,微生物发酵法因其经济性和环境友好性成为生产L–亮氨酸的主要方法.最常见的用于生产L–亮氨酸的细菌是谷氨酸棒杆菌(Corynebacterium glutamicum)和大肠杆菌(Escherichia coli)[1-2].C. glutamicum是一种从土壤分离的需氧非致病性革兰氏阳性细菌,由于一般公认的安全状态(generally recognized as safe,GRAS)和代谢能力,广泛应用于氨基酸生产行业,特别是用于L–谷氨酸、L–赖氨酸和支链氨基酸(BCAAs)的生产[3]. 在早期,大多数L–亮氨酸生产菌株是通过随机诱变和选择分离出来的.然而,这种方法既费时又费力,而且常常会引起基因组中不必要的改变[4].目前,代谢工程基因改造已逐渐取代传统的随机诱变筛选的方法成为主流.已有研究者报道了基于代谢工程成功获得L–亮氨酸生产菌的案例[5-12].
L–亮氨酸的生物合成途径在C. glutamicum中是复杂且受到严格调控的.谷氨酸棒杆菌中支链氨基酸合成途径如图1所示.由于3个BCAAs的生物合成途径部分地共享相同的基因和酶[13],糖酵解途径(EMP)的最终产物丙酮酸是BCAAs的中心前体物.ilvBN编码的乙酰羟基酸合成酶(AHAS),也称为乙酰乳酸合成酶,能催化丙酮酸与另一分子丙酮酸反应生成2–乙酰乳酸或催化丙酮酸与2–酮丁酸生成2–乙酰–2–羟基丁酸,分别对应L–缬氨酸合成途径、L–异亮氨酸合成途径[14].此外,α–异丙基苹果酸合成酶(IPMS)作为L–亮氨酸生物合成途径的限速酶,受到L–亮氨酸反馈抑制和转录弱化,能催化α–酮异戊酸和乙酰辅酶A(AcCoA)转化为α–异丙基苹果酸[4]. 分析L–亮氨酸合成途径可知,产生1分子L–亮氨酸需要1.5分子葡萄糖,其中1分子葡萄糖可以产生2分子丙酮酸、另外0.5分子用于生产1分子AcCoA[4].
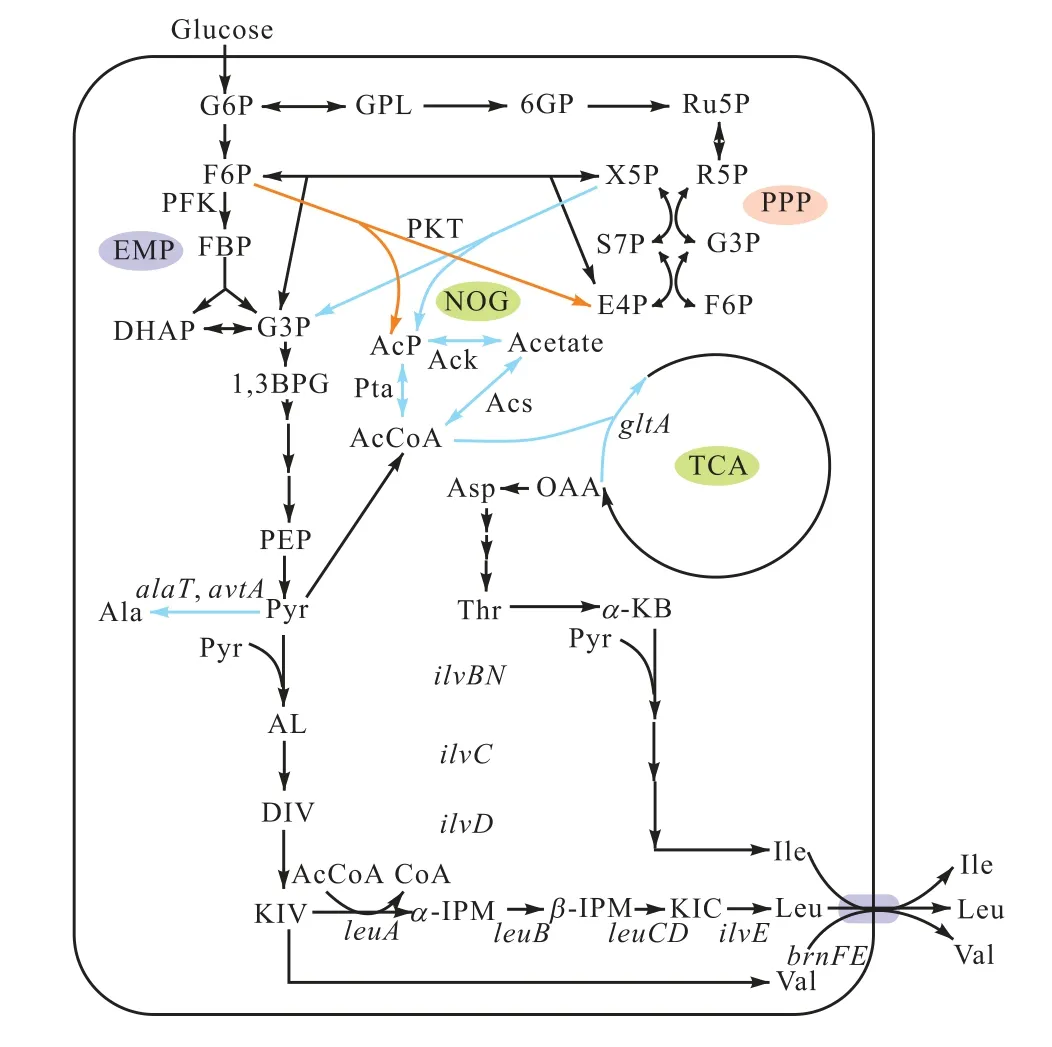
图1 谷氨酸棒杆菌中支链氨基酸合成途径 Fig. 1 BCAAs biosynthesis pathway of C. glutamicum
AcCoA是许多工业发酵产品的关键前体物,研究者往往通过增加其供应量促进其生物转化为不同产品[15].C. glutamicum细胞质中合成AcCoA的天然途径是丙酮酸脱氢酶(PDH)旁路[16].近年来,利用磷酸转酮酶(phosphoketolases,PKTs)和碳重排循环而设计的合成途径,每分子果糖–6–磷酸能生成3分子AcCoA,成功地实现了糖代谢中的碳守恒,而通过EMP途径每分子葡萄糖生成2分子AcCoA[17]. 目前,这个循环称为非氧化糖酵解(non-oxidative glycolysis,NOG),用于提高AcCoA相关产物的产量,如乙酸酯、丙酮、聚羟基丁酸酯、甲戊酸酯和L–谷氨 酸[18-25].PKTs可催化木酮糖–5–磷酸/果糖–6–磷酸不可逆裂解为乙酰–磷酸(Ac-P)和甘油醛–3–磷酸或赤藓糖–4–磷酸[21].Ac-P转化为AcCoA可能有两种途径,一是通过磷酸转乙酰酶(Pta)或乙酸激酶(Ack),二是通过乙酰辅酶A合成酶(Acs)[26].除了增加前体物AcCoA的供应,L–亮氨酸生产菌亦需要减少其不必要的消耗.AcCoA进入TCA途径被氧化生成CO2和能量[27]是AcCoA被消耗的主要方式.将编码柠檬酸合酶(CS)的gltA基因前面的两个天然启动子替换为较弱的启动子dapA-L1[5],CS的活性降低16%,以提高AcCoA生产L–亮氨酸的代谢流.
生产效率的提高是经济性的工业发酵生产过程的关键限制因素[28].本研究在L–亮氨酸生产菌C. glutamicumCP中引入了一种来源于Bifidobacterium adolescentis的高活性突变体PKT[29],旨在提高L–亮氨酸生产效率.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
L–亮氨酸生产菌C. glutamicumCP(CGMCC 11425),克隆宿主Escherichia coliDH5α,质粒pK18mobsacB、pXMJ19、pXT01(pXMJ19ΔlacI)均由天津科技大学代谢工程研究室保藏.本文构建的质粒与菌株见表1.

表1 质粒与菌株 Tab. 1 Plasmids and strains
1.1.2 培养基
Luria-Bertani培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10.
Brain Heart Infusion培养基:3.85%脑心浸液肉汤培养基.
发酵培养基(g/L):玉米浆10,葡萄糖25,酵母粉5,豆饼水解液20,硫酸铵10,磷酸二氢钾1.5,硫酸镁1,硫酸亚铁1,硫酸锰1,L-甲硫氨酸0.6,L-异亮氨酸0.2.
1.2 方法
1.2.1 质粒与工程菌构建方法
PCR扩增引物通过诺唯赞CE Design引物软件设计,由金唯智公司合成,引物序列见表2.常规的分子克隆方法如PCR、DNA限制性内切按照标准程序进行[30].C. glutamicum的基因改造方法参考文献[5].来源于青春双歧杆菌(Bifidobacterium adolescentis)的高活性突变体PKT,其编码基因为fxpk,GenBank:MN081868.1,由金唯智公司合成.敲除及基因整合质粒通过重叠PCR获得基因片段,以pK18-ΔltbR∷Ptuf-fxpk为例,分别扩增基因ltbR上下游同源臂、tuf启动子、fxpk和rrnB终止子,与线性化载体pK18mobsacB连接,验证正确后,电转至C. glutamicumCP,经过两次同源重组,获得工程菌.

表2 引物 Tab. 2 Primers
1.2.2 工程菌的培养方法
摇瓶发酵与补料分批发酵方法参考文献[7].摇瓶发酵:将活化的菌种,以10%接种量接种至30mL发酵培养基中,200r/min、32℃振荡培养.通过指示剂苯酚红确定补加氨水和葡萄糖的时机和体积.补料分批发酵:培养种子液至菌体浓度A600为20~25,以20%接种量接种至3L发酵培养基中,温度为32℃,通过调整转速和通风比使得溶解氧(DO)为20%~30%,pH为7.0,使用泡敌消除泡沫.当培养基中葡萄糖质量浓度低于5g/L时,补充葡萄糖,维持葡萄糖质量浓度为5~10g/L.
1.2.3 分析方法
通过分光光度计测定600nm下的吸光度,以确定C. glutamicum的菌体浓度.采用SBA-40C型生物传感仪测定发酵液中的葡萄糖含量.产物L–亮氨酸及副产物杂酸经过衍生化处理后,通过高效液相色谱(HPLC)进行测定[31].L–亮氨酸与L–丙氨酸标准曲线如图2所示,在一定浓度范围,二者浓度与峰面积线性关系良好.
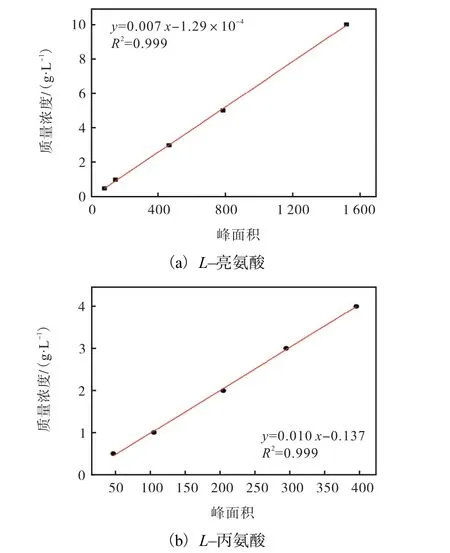
图2 L–亮氨酸与L–丙氨酸标准曲线 Fig. 2 Standard curve of L-leucine and L-alanine
1.2.4 统计方法
使用SPSS 18.0(IBM公司)对获得的数据进行统计分析.所有数据均为3个重复的平均值.使用Student’s t-test比较不同处理的发酵性能差异,P<0.05的差异被认为具有统计学意义.
2 结果与讨论
2.1 PKT的过表达对生产L–亮氨酸的影响
基因过表达的方式有组成型表达和诱导型表达两种.分别以质粒pXMJ19、pXT01为PKT的诱导型和组成型表达载体,构建重组质粒pXMJ-fxpk、pXTfxpk,转化E. coliDH5α.阳性转化子通过菌落PCR验证,结果如图3(a)所示,并进一步通过测序验证. 将测序结果正确的pXMJ-fxpk、pXT-fxpk分别电转至C. glutamicumCP,阳性转化子菌落PCR验证结果如图3(b)所示.将验证正确的转化子培养,抽提质粒,测序验证.经比对测序结果与已知目的基因序列一致,结果表明成功构建PKT过表达的菌株CP01、CP02.

图3 质粒pXMJ-fxpk、pXT-fxpk及菌株CP01、CP02的构建 Fig. 3 Construction of plasmids pXMJ-fxpk and pXTfxpk and strains CP01 and CP02
对出发菌CP、工程菌CP01和CP02进行摇瓶发酵实验,以确定过表达PKT对L–亮氨酸生产菌的影响.3株菌的摇瓶发酵条件相同,其中CP01、CP02使用的培养基添加了相应的抗生素,以避免菌株生长过程质粒丢失.三者摇瓶发酵结果如图4所示(*P<0.05,**P<0.01),发酵48h,菌株CP、CP01、CP02的L–亮氨酸产量分别为21.3、16.9、18.4g/L.与野生型菌株CP相比,过表达PKT,L–亮氨酸的产量略有下降.导入诱导型表达质粒的工程菌CP01生长状态与菌株CP基本无差异,导入组成型表达质粒的工程菌CP02则生长显著下降.工程菌在发酵结束时,副产物L–丙氨酸显著降低,菌株CP、CP01、CP02的L–丙氨酸产量分别为5.6、5.4、4.1g/L.基于PKT的NOG系统能使菌株摄入的葡萄糖不必经过EMP途径生成AcCoA,而由葡萄糖–6-p生成Ac-P进而生成AcCoA,提高了AcCoA的产量,间接减少了前体物丙酮酸的生产,减少了丙酮酸生成副产物的L–丙氨酸的代谢流.

图4 菌株CP、CP01、CP02的摇瓶发酵结果 Fig. 4 Results of flask fermentation of strains CP,CP01 and CP02
2.2 基因组整合PKT对生产L–亮氨酸的影响
当胞内L–亮氨酸浓度高时,转录调节因子LtbR可以抑制leuCD和leuB的表达[32].事实上,研究者在开发L–亮氨酸生产菌时均选择缺失ltbR基因[5,9]. PKT的整合位点选取ltbR.此外,为了减少AcCoA的消耗,将CS的自然启动子替换为弱启动子dapA. 重组质粒pK18-ΔltbR、pK18-ΔltbR∷Ptuf-fxpk、pK18-ΔPgltA∷PdapA的菌落PCR鉴定结果如图5(a—c)所示.经过测序,进一步确定质粒是否构建成功.将重组质粒pK18-ΔltbR电转化至C. glutamicumCP,经过两次同源重组,得到工程菌CP03.将重组质粒pK18-ΔltbR∷Ptuf-fxpk电转化至CP03,经过两次同源重组,得到工程菌CP04.将重组质粒pK18-ΔPgltA∷PdapA电转化至CP04,经过两次同源重组,得到工程菌CP05,菌落PCR鉴定结果如图5(d—f)所示.经过测序比对,分别与已知序列一致,即得到的工程菌CP03、CP04、CP05构建成功.

图5 重组质粒与菌株CP03、CP04、CP05构建 Fig. 5 Construction of plasmid and strains CP03,CP04 and CP05
对工程菌CP03、CP04、CP05进行摇瓶发酵,结果如图6所示.
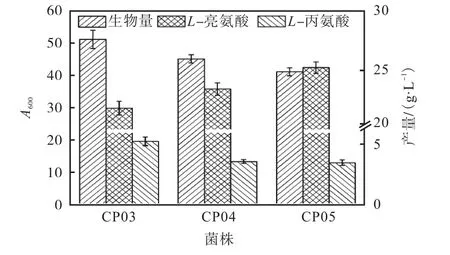
图6 菌株CP03、CP04、CP05的摇瓶发酵结果 Fig. 6 Results of flask fermentation of strains CP03,CP04 and CP05
与工程菌CP03、CP04相比,CS启动子替换为弱启动子后,菌体生物量有一定程度下降,分别为51.1、44.7、41.0.由于PKT的导入C. glutamicumCP基因组,使得工程菌生成AcCoA的能力提升,进而提高了以AcCoA为前体物的L–亮氨酸的生成,菌株CP03、CP04、CP05的L–亮氨酸产量分别为21.8、23.4、25.2g/L.此外,NOG系统的引入,分流了一些碳代谢通量,AcCoA的生成减少了对EMP途径的依赖,EMP的终产物丙氨酸相应减少,使得副产物L–丙氨酸的生成减少.菌株CP03、CP04、CP05的L–丙氨酸产量分别为5.3、3.6、3.5g/L.
2.3 补料分批发酵
在5L发酵罐水平培养出发菌C. glutamicumCP和工程菌C. glutamicumCP05生产L–亮氨酸,发酵周期为44h,结果如图7所示(*P<0.05,**P<0.01).

图7 发酵过程曲线 Fig. 7 Fermentation process curve
整个发酵过程,工程菌CP05的生物量低于出发菌CP,培养至稳定期,二者的吸光度分别为165.3、176.1.在发酵前期,工程菌CP05的L–亮氨酸积累低于出发菌,是因为生物量低于出发菌,随着发酵持续进行,由于碳代谢流的分布不同,工程菌生产L–亮氨酸的量逐渐高于出发菌,L–亮氨酸的产量分别为53.0、48.2g/L,二者存在显著性差异(P<0.05).工程菌代谢过程中节省了碳骨架,使L–亮氨酸糖酸转化率获得提升,为23.5%,副产物L–丙氨酸的质量浓度为6.4g/L,较出发菌下降33.3%(图8).

图8 发酵液产物HPLC分析 Fig. 8 HPLC analysis of fermentation broth
3 结 论
通过在L–亮氨酸生产菌内,以游离表达和基因整合两种方式表达高活性的突变体PKT,同时采用“进、通、截、堵、出”的策略[33]对相关基因进行代谢工程改造,获得工程菌株C. glutamicumCP05,经过补料分批发酵验证,能达到提高L–亮氨酸产量和糖酸转化率,降低副产物生成量的目的.基于PKT的NOG系统引入对以AcCoA为前提物的发酵产品具有重要作用.
