多效生长因子介导神经元修复作用的研究进展
2021-12-22席文华刘文勋海克蓉叶青山
席文华,刘文勋,,海克蓉,叶青山
(1.宁夏医科大学,银川 750004; 2.宁夏回族自治区人民医院麻醉科,银川 750002)
神经元是神经系统的基本结构和功能单位,其形态和功能完整是保证神经元正常生理活动的重要条件,当神经元损伤或死亡时,其调节、支配的器官和躯体会出现相应功能障碍,继而引发各类疾病。神经元损伤给患者家庭和社会均造成沉重经济负担,因此神经元保护具有重要的临床及现实意义。研究发现,神经元损伤后,机体可通过某些途径激活神经胶质细胞内的效应蛋白并产生多种物质(细胞因子、神经营养因子等),这些物质可刺激未受损神经元细胞出芽或形成新的突触联系[1],从而修复神经功能。多效生长因子(pleiotrophin,PTN)是一种重要的促神经功能修复细胞因子,作为一种小分子阳离子蛋白,PTN具有很强的促有丝分裂和血管生成活性,且与一系列重要的生物学事件有关,包括神经再生、骨发育、炎症、肿瘤转移以及组织修复等[2]。因此,明确神经元修复过程中PTN相关作用机制,可以为脑损伤后功能恢复提供理论依据,为神经系统疾病的治疗提供科学指导。现就PTN介导神经元修复作用的研究进展予以综述。
1 PTN概述
PTN是一种强大的促有丝分裂因子,也称为肝素结合生长相关分子,最初是由Rauvala[3]利用肝素凝胶从围生期大鼠脑中分离出来。PTN基因位于7q33~7q34,长度约为100 kb,包含5个翻译的外显子和1个不翻译的外显子,PTN基因编码168个氨基酸,其中前32个氨基酸均是与分泌有关的信号识别序列[4]。PTN主要表达于胚胎以及出生后早期的中枢和外周神经系统中,在子宫、睾丸中也有少量表达[5]。PTN分子结构的核心区有两个β折叠结构域,这两个β折叠结构域之间由一个可变的结构区相连,而每个β折叠结构域均由3个反向平行的β片层组成,PTN分子位于核心区两侧的N端和C端均含有丰富、成簇的赖氨酸并呈袖口样[6]。PTN分子对下丘脑神经元的作用由β折叠结构域介导,但单个β折叠片段与受体结合的能力较弱,不能产生显著的神经生长生物学效应,必须两个β折叠片段共同作用才能发挥效应[7]。因此,PTN可通过调节细胞增殖、迁移和内皮细胞的血管生成等,促进神经系统发育[6]。
作为一种肝素结合的可溶性蛋白,PTN主要存在于发育的大脑中[3],其与中期因子组成了肝素结合细胞因子家族,中期因子/PTN家族在神经发育、血管生成和组织再生中起重要作用[8]。目前关于中期因子/PTN的研究较多,但关于PTN在神经元修复中的作用研究较少,而神经元修复对保证正常神经功能至关重要。神经元由胞体、轴突和树突组成,通常情况下胞体的损伤是不可逆的,而轴突和树突的损伤可以修复。Paveliev等[2]研究表明,PTN可促进轴突和树突的生长。此外,当神经元细胞缺血损伤后,其自身的PTN表达减少,而周围的血管内皮细胞、巨噬细胞和星状细胞被激活,导致PTN表达水平升高,从而促进神经元细胞的损伤后修复;当损伤后神经元细胞不能恢复正常功能、不能正常表达PTN时,该神经元细胞将发生变性、死亡[9]。因此,PTN的修复作用对神经元变性疾病至关重要。
2 PTN在神经元修复中的作用
2.1PTN对海马神经元的保护作用 海马是参与学习记忆的关键脑区,也是介导应激反应的主要脑区[10]。长期慢性应激可诱发海马神经元受损,从而导致中枢神经系统紊乱[11]。PTN是一种分泌型生长因子,在中枢神经系统中作为神经调节肽发挥作用[4]。其与神经退行性疾病、神经功能紊乱以及学习和记忆有关。既往研究表明,PTN参与调节体外培养海马神经元树突和突触的发生[12]。Tanga等[13]利用小干扰RNA沉默PTN在原代培养海马神经元中的表达发现,PTN缺失可影响蛋白激酶B(protein kinase B,PKB/Akt)信号转导通路。此外,无论是在体内还是在体外,PTN缺失导致的胱天蛋白酶6过表达引起的神经元损害均可通过同时诱导雌激素受体1和MGST3等神经保护基因的表达而部分代偿[14]。胱天蛋白酶6具有抑制突触连接的作用,其在轴突变性中表达水平升高,因此胱天蛋白酶6可能介导了海马PTN缺失导致的神经元退化和记忆障碍[15];而MGST3则与海马的大小有关[14]。雌激素受体1在啮齿动物海马部分区域神经元中的表达水平显著升高,且与神经元的存活、可塑性以及发育有关[16]。以上研究均表明,PTN在海马神经元保护中发挥重要的调节作用。
2.2PTN对多巴胺能神经元变性的保护作用 帕金森病是一种神经退行性疾病,其特征为黑质多巴胺能神经元逐渐丧失,导致纹状体多巴胺水平逐渐降低;帕金森病主要影响运动功能,可导致运动迟缓、震颤、僵直和姿势失衡,这些症状在大量多巴胺能神经元死亡后出现[17]。神经营养因子基因治疗为帕金森病患者提供了更多选择,因为PTN可通过提高产生多巴胺的神经元的存活率减缓疾病的进展,同时还可通过升高纹状体内的多巴胺水平缓解运动症状[18-19]。
PTN参与黑质纹状体多巴胺系统的发育,无论在体外或体内其对中脑多巴胺能神经元均具有神经保护作用,可促进多巴胺能神经元的存活和分化[20]。既往研究表明,在6-羟多巴胺诱导变性的多巴胺能神经元中,PTN过表达不仅可保护黑质神经元,还可恢复其功能[21]。此外,动物实验也证明,PTN过表达对帕金森病模型小鼠具有神经保护作用[22]。但PTN保护多巴胺能神经元的具体机制目前尚不明确,未来还需进一步研究探索。
2.3PTN对苯丙胺神经毒性的神经保护作用 苯丙胺是一种中枢兴奋药,也是一种抗抑郁症药,具有较高的成瘾性,可导致中枢神经系统严重的神经毒性效应[23];此外,苯丙胺还是多巴胺转运体的底物,其可通过对该转运体的作用提高大脑神经突触间的多巴胺水平[24]。既往研究表明,与野生型小鼠相比,PTN基因缺失小鼠的苯丙胺诱导的多巴胺能神经元损伤更严重[25],表明PTN对多巴胺能神经元具有保护作用;Bertram等[26]的观点与此一致,他们认为PTN可促进体外培养的多巴胺能神经元存活及可介导环腺苷酸对多巴胺能神经元的神经营养作用[26]。基于PTN对多巴胺能神经元的保护作用,推测PTN对苯丙胺药物成瘾的神经毒性也可能具有保护作用。Gramage等[27]研究表明,PTN对苯丙胺神经毒性有潜在神经保护作用,且其保护作用由胞外信号调节激酶1/2信号通路介导。苯丙胺的滥用给人类健康及社会均造成沉重负担,而PTN有可能作为新的治疗靶点,以保护苯丙胺对神经元的损伤。
2.4周细胞源性PTN对神经的保护作用 周细胞分布于体内多种微血管系统的内皮细胞与基膜之间,其不仅是微血管的构成成分,还在微血管的发生、发展、成熟以及再塑形过程中起重要作用[28]。在中枢神经系统中,周细胞位于形成血脑屏障的脑毛细血管内皮细胞、星形胶质细胞与神经元之间,周细胞在脑毛细血管水平的神经血管单位内的信号传递中起关键作用,并调节多种神经血管功能,在许多神经系统疾病中均可发现周细胞丢失[29]。
Kisler等[30]利用白喉毒素去除小鼠脑毛细血管中的周细胞,结果发现小鼠出现急性血脑屏障破坏、血流量严重丧失以及快速的神经元死亡。PTN是一种轴突生长促进蛋白,可以保护小鼠皮质和海马神经元免受神经元生长介质消失后所致的细胞死亡、糖氧剥夺以及谷氨酸毒性诱导的细胞死亡;与其他分泌PTN的细胞相比,周细胞中的PTN表达更丰富,去除周细胞则可导致PTN水平显著降低,同时皮质和海马中的神经元减少20%~25%,原因可能为周细胞的快速丢失导致PTN的神经营养支持作用减弱甚至消失;双重荧光原位杂交实验证实,脑周细胞PTN信使RNA高表达;免疫印迹实验显示,脑周细胞中的PTN蛋白水平显著升高,去除周细胞则导致周细胞来源的PTN丢失65%,同时脑毛细血管PTN蛋白丢失>60%;此外,与生理性脑脊液PTN相比,周细胞源性PTN的神经元保护作用更显著[31]。通常情况下,PTN可与多种受体结合,并通过不同的信号通路介导神经胶质祖细胞的分化、轴突生长、突触可塑性及血管生成等。神经元损伤后,PTN在星形胶质细胞中合成并分泌至细胞外基质中,然后与神经细胞表面的多配体蛋白聚糖3(syndecan 3,SDC3)结合,介导神经突触生长和神经保护作用[32]。而周细胞源性的PTN是否通过此机制发挥神经元保护作用目前尚不清楚。此外,连续脑室内注射重组PTN可恢复周细胞去除小鼠的PTN丢失,阻止神经元死亡和行为缺陷[31]。以上研究表明,周细胞源性PTN对神经元具有保护作用,为PTN在分子水平上介导神经元保护提供了新思路。
2.5PTN依赖途径的促神经元轴突生长作用 有研究对原代培养小鼠皮质神经元行糖氧剥夺处理,于糖氧剥夺复氧后再用可卡因-苯丙胺调节转录肽(cocaine- and amphetamine-regulated transcript,CART)处理则可抑制培养小鼠皮质神经元凋亡,促进轴突生长[33]。CART是一种分泌型神经肽,参与摄食、能量代谢、药物成瘾及戒断、内分泌调节、应激反应、神经营养等重要的生理功能[34-35]。在动物脑缺血再灌注或神经元糖氧剥夺中,CRAT均以胞外信号调节激酶磷酸化的方式发挥神经保护作用[36]。CART对糖氧剥夺损伤神经元的修复作用依赖于PTN,并通过蛋白激酶A/胞外信号调节激酶途径实现;转染PTN小干扰RNA可抑制PTN蛋白表达,且无论有无CART,转染PTN小干扰RNA的神经元均会出现轴突数量减少[37],表明PTN对轴突生长非常重要,敲除PTN可直接影响轴突的发育。因此,CART可能通过PTN依赖的途径促进轴突生长,从而修复糖氧剥夺后的神经元损伤。轴突的生长对于脑卒中导致的损伤神经元的恢复至关重要[38]。在脑卒中的病理生理过程中,受损的神经元细胞在形态学上发生了一系列改变(主要包括胞体肿胀、胞核偏向一侧、尼氏体分散、损伤远端的轴突),从而导致轴突数量减少、形态缩小以及微丝微管缩短[39]。因此,恢复脑卒中后的轴突生长显得尤为重要。此外,小干扰RNA介导的PTN基因敲除可完全抑制CART刺激的生长相关蛋白-43(growth associated protein-43,GAP-43)的表达增加[40],表明CART可通过上调GAP-43的表达修复受损的皮质神经元,因此GAP-43可以促进轴突的生长。以上研究表明,促进神经元轴突和树突的恢复对脑卒中及其他神经退行性疾病至关重要。因此,未来深入研究PTN和CART,可能为脑卒中及其他神经退行性疾病的治疗提供新靶点。
2.6PTN对新生神经元的调节作用 在哺乳动物大脑发育过程中,神经元和胶质细胞均是由神经干细胞产生,出生后,多数区域的神经发生会逐渐停止,只有侧脑室下区和海马颗粒下区仍持续产生神经元和胶质细胞,这是大脑动态平衡所必需。作为一种分泌型神经营养因子,PTN高表达于发育中的神经系统,尤其在侧脑室下区和海马颗粒下区的神经干细胞群体中高度富集[41]。Tang等[42]发现,在侧脑室下区和海马颗粒下区,神经干细胞持续向新生神经元供应PTN,而敲除PTN基因后,成年海马区新生神经元树突发育和树突形成均出现缺陷。由此可见,神经干细胞来源的PTN是海马神经元树突发育所必需。
同时,PTN还是一种神经发育调节生长因子,在脑发育中发挥不同作用,包括细胞增殖、神经元迁移和轴突生长[4]。已有研究表明,成年海马神经干细胞通过分泌PTN激活成年海马新生神经元的间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)-Akt信号通路,从而调节新生神经元的发育,且随着年龄的增长,海马组织中PTN的表达和PTN介导的ALK-Akt信号活性均降低,而补充PTN或激活Akt信号通路则可恢复年龄诱导的新生海马神经元发育缺陷[42]。另有研究发现,PTN缺乏可损害成年海马新生颗粒细胞的成熟和整合[41],进一步证明了PTN在神经元发育中起重要作用。综上可知,PTN在成年海马区新生神经元发育中起重要作用,同时还可促进树突生长,这为其在神经元病变中的应用提供了理论基础。
3 PTN介导的神经元修复信号转导通路
PTN是一种可溶性、分泌性神经营养因子,需要与不同的受体结合才能发挥生理作用,即可溶形式的PTN不能发挥其促进神经元轴突生长和神经元保护的功能。此外,PTN在成人体内表达较少,但在许多损伤或创伤后的再生组织中均有表达[43]。PTN的不同功能由细胞膜上的受体和PTN介导的细胞内信号通路决定(图1)[4]。
3.1PTN-SDC3信号通路 SDC3是PTN的细胞表面受体,可以介导PTN促进轴突生长的作用[44],且主要通过SDC3的硫酸乙酰肝素侧链发挥作用[45]。在发育中,SDC3作为PTN的受体或与其他分子共同构成受体,参与介导PTN在中枢神经元中的促轴突生长和轴突导向作用[46]。PTN-SDC3通路可能通过激活c-Src-Cortactin-tubulin途径发挥调节轴突生长的作用(图2)[44]。表明PTN-SDC3信号通路在神经元轴突生长过程中发挥重要作用,这为治疗神经元损伤相关疾病提供了新思路。
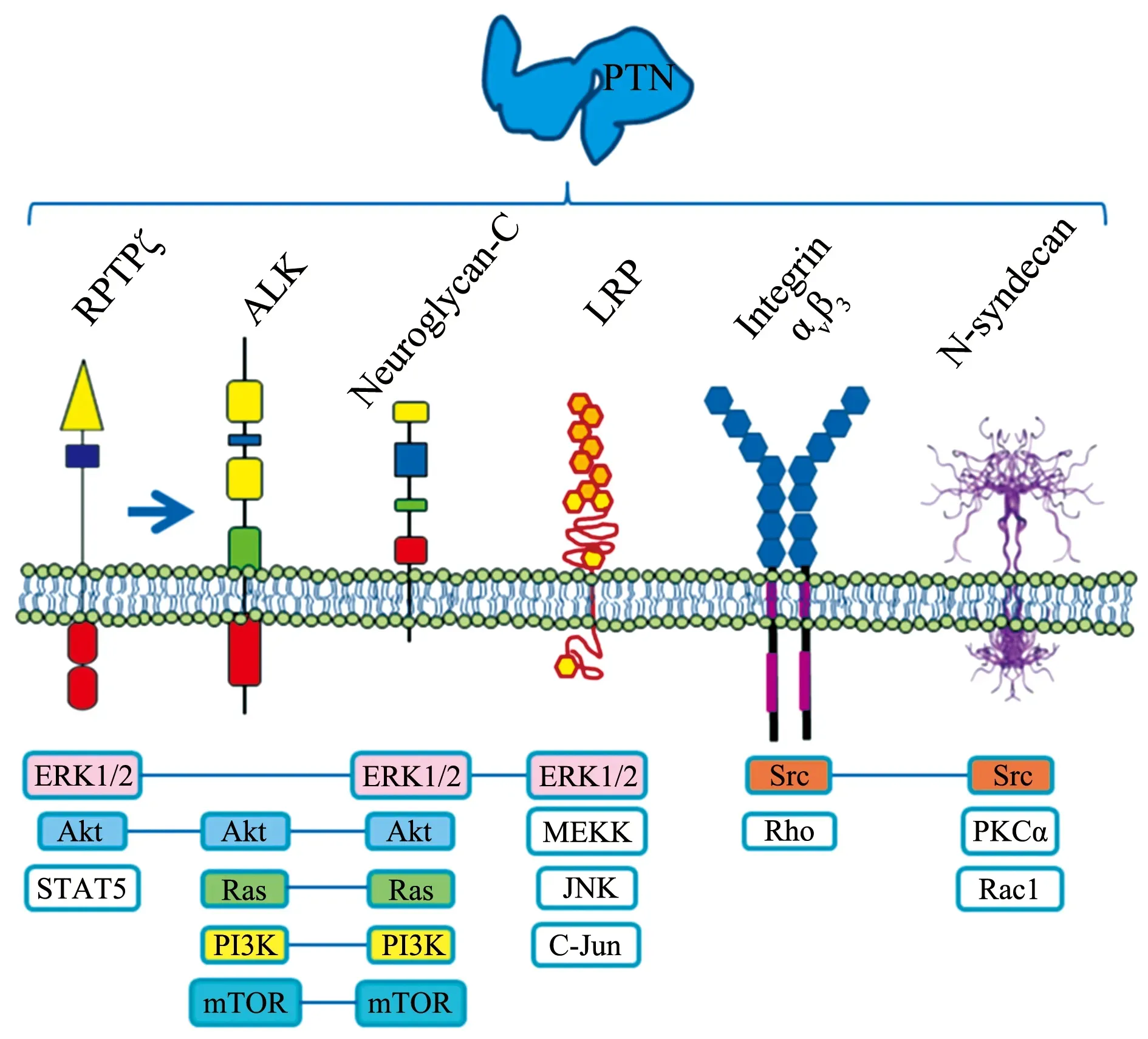
PTN:多效生长因子;RPTPζ:受体蛋白酪氨酸磷酸酶ζ;ALK:间变性淋巴瘤激酶;Neuroglycan-C:神经多糖-C;LRP:低密度脂蛋白受体相关蛋白;Integrin:整合素;N-syndecan/syndecan 3:多配体蛋白聚糖3;ERK:胞外信号调节激酶;Akt:蛋白激酶B;STAT5:信号转导及转录激活因子5;PI3K:磷脂酰肌醇-3-激酶;mTOR:哺乳动物雷帕霉素靶蛋白;MEKK:促分裂原活化的蛋白激酶激酶激酶;JNK:c-Jun氨基端激酶;Src:肉瘤基因;Rho:Ras同源物;PKCα:蛋白激酶Cα;Rac1:Ras相关的C3肉毒素底物1
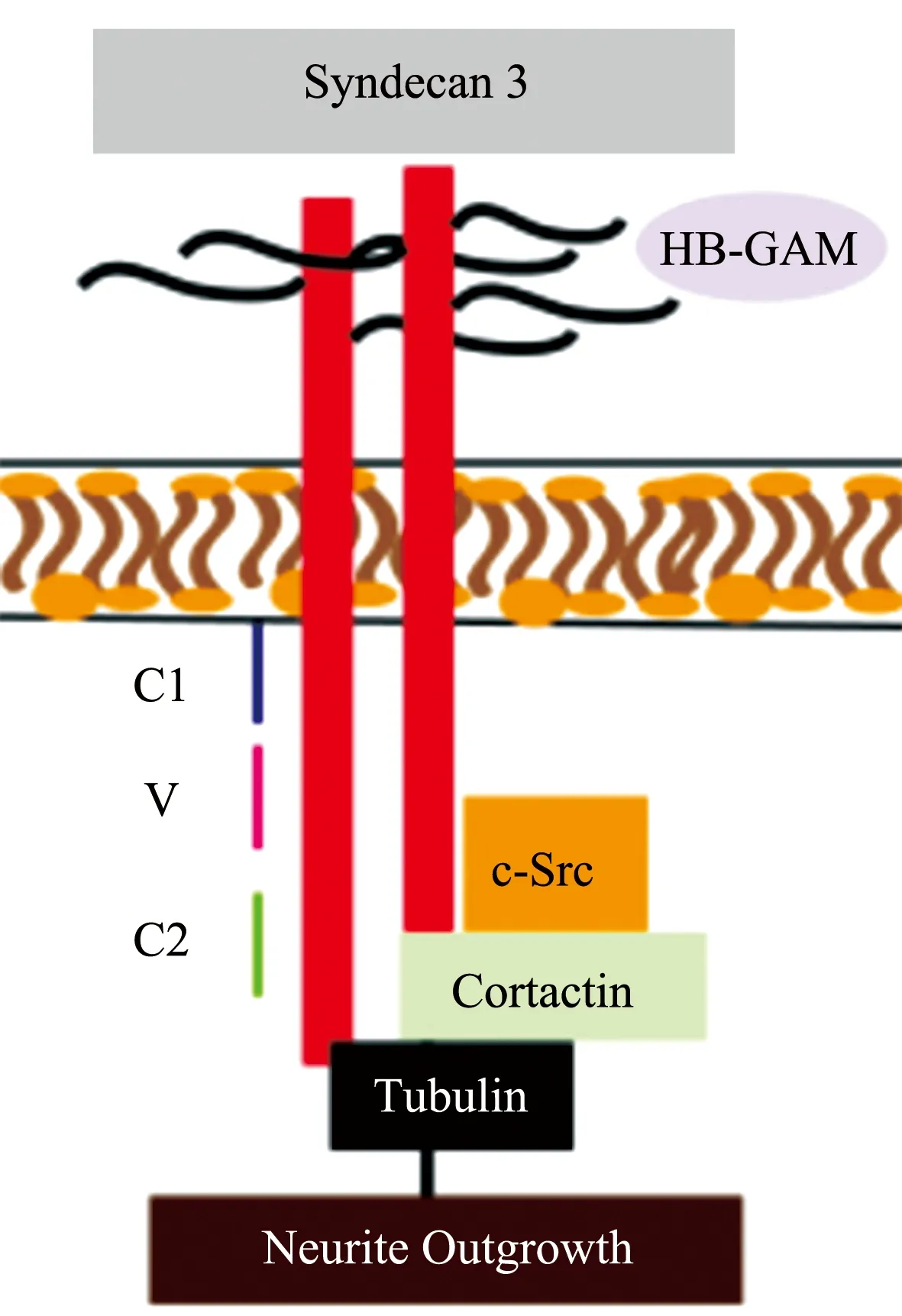
PTN:多效生长因子;SDC3/Syndecan 3:多配体蛋白聚糖3;HB-GAM:肝素结合生长相关分子;c-Src:非受体酪氨酸激酶;Cortactin:皮质肌动蛋白结合蛋白;Tubulin:微管蛋白;Neurite Outgrowth:轴突生长
3.2PTN-受体蛋白酪氨酸磷酸酶ζ(receptor protein tyrosine phosphatase ζ,RPTPζ)信号通路 作为PTN的主要受体,RPTPζ在中枢神经系统中以硫酸软骨素蛋白多糖的形式存在,在控制轴突生长和神经元迁移方面具有重要作用[12]。Mencio等[47]研究表明,RPTPζ可调节小脑发育过程中浦肯野细胞树突的形态发生。此外,PTN和RPTPζ还在人脑白质中高表达,PTN-RPTPζ信号通路在发育中的髓鞘生成以及损伤后的髓鞘再生过程中均可促进少突胶质前体细胞分化,其部分机制是通过增强肌动蛋白丝相关蛋白1相似蛋白2的酪氨酸磷酸化进而激活磷脂酰肌醇-3-激酶/Akt通路实现[13]。RPTPζ与PTN的相互作用导致RPTPζ固有的酪氨酸磷酸酶失活,并通过改变RPTPζ构象,使底物无法进入其特定结构域的活性位点发挥作用[48]。此外,PTN-RPTPζ信号通路还表达于海马神经元,参与学习记忆的调节[49]。PTN-RPTPζ通路在免疫细胞和炎症性疾病中表达则提示该通路可能在炎症中起重要作用[48]。综上可知,PTN-RPTPζ信号通路通过调节轴突和树突的发育以及神经元的迁移,诱导胶质细胞分化,同时还参与了免疫调节。
3.3PTN-ALK信号通路 在某种情况下,PTN也能通过ALK受体发挥作用。ALK是一种表达于成年哺乳动物海马的受体酪氨酸激酶,高表达于发育的神经系统[4];且PTN诱导的胚胎神经元轴突生长少部分也归因于ALK和糖原合成酶激酶-3β/β联蛋白/GAP-43通路的激活[50]。此外,PTN-ALK信号通路还可介导神经元损伤后的修复。有研究表明,PTN-ALK轴与成年大鼠神经元修复密切相关[51]。Wang[52]研究发现,PTN通过ALK信号通路介导运动神经元的神经营养作用。还有研究表明,PTN通过ALK激活Akt信号通路,促进新生神经元的形态成熟和突触整合[42]。以上研究均表明,PTN-ALK信号通路在神经系统中发挥重要作用。此外,ALK还参与基础海马前体细胞的增殖,其缺乏可导致小鼠行为测试改变[53]。在PTN-ALK信号通路中,PTN既可直接激活ALK,也可通过抑制PTPRζ的磷酸酶活性调节ALK的磷酸化水平,进而触发PTN-ALK信号通路[48]。
3.4其他信号通路 神经多糖C是一种脑特异性硫酸软骨素蛋白多糖,可促进皮质神经元轴突生长。神经多糖C参与发育中的中枢神经系统的神经发生和(或)突触发生[54]。此外,少突胶质细胞前体的突起延长也是由神经多糖C介导[55]。Aletsee等[56]研究发现,应用αvβ3整合素有效抑制剂后,细胞外基质中培养的耳蜗螺旋神经节神经元的平均轴突长度显著缩短,表明PTN可通过αvβ3整合素通路影响螺旋神经节神经元的轴突生长[26]。此外,低密度脂蛋白受体相关蛋白1也可与PTN结合发挥多种功能,是感觉神经元的重要神经营养因子[57]。近年,另一种硫酸乙酰肝素蛋白多糖——磷脂酰肌醇蛋白聚糖2被鉴定为PTN诱导轴突生长的介质[58],但其具体作用机制目前尚不明确。
4 小 结
作为一种神经调节肽,PTN作用广泛。但PTN的不同作用取决于其激活的信号通路。截至目前,参与PTN信号通路的许多分子仍然未知,因此有必要进行更深入的研究(包括蛋白质组学和基因组学方法的使用、体内和体外的研究),以阐明PTN所涉及的完整的分子机制、明确PTN在不同疾病中的特异性受体和细胞内信号通路,从而为相关新药的研发奠定基础。由于PTN在神经元修复和发育过程中发挥重要作用,其可能成为神经系统性疾病治疗的靶点。未来,在神经元修复的不同阶段调控PTN的表达,或许可达到治疗目的,并为临床治疗神经系统难治性疾病提供理论依据。
