载脱钙骨基质的3D打印多孔生物陶瓷的制备及其成骨性能研究*
2021-12-22张铁胡丽蔡志祥杜小青闫飞飞王志勇张旗蔡林
张铁 胡丽 蔡志祥 杜小青 闫飞飞 王志勇 张旗* 蔡林
3D 打印作为新兴的材料制造技术,由于其独特的成型优势,在医疗行业有着不可替代的地位[1-2]。其中,选择性激光烧结(selective laser sintering,SLS)技术已经运用在金属医疗器械的制造成型上,显示出较传统工艺更为满意的结果[1-2]。常用的3D打印技术还有熔融沉积成型(fused deposition modeling,FDM)和立体光刻(stereolithography,SLA)技术,其中SLA 具有更高的精度,能够完成更为复杂的模型打印[3-6]。
传统的生物陶瓷材料的主要成分为磷酸钙和羟基磷灰石,该类陶瓷具有较好的生物相容性和力学性能,但是降解性能差,植入体内后难以降解,阻碍新骨的形成[7-11]。但是通过3D 打印技术可以实现材料复杂的多孔结构,有利于骨组织的长入,同时多孔结构会增加材料的比表面积,能够加速其降解,进而可以解决其降解能力差的缺点[1-2,4]。
硫酸钙具有良好的降解能力和生物相容性,在临床上具有广泛的应用[11-13]。但是在烧结过程中由于有机成分的存在,会降低其分解温度,导致成型困难,故而难以应用到SLA 技术中制备多孔生物陶瓷。同种异体骨,如脱钙骨基质(decalcified bone matrix,DBM),其天然微孔结构有利于传导成骨,同时富含骨形态发生蛋白等生长因子而具有诱导成骨能力,在临床上显示了良好的成骨能力[11,14-17]。为了保持其诱导能力,DBM 在加工过程中不能进行高温处理。
1 材料与方法
1.1 3D 打印多孔生物陶瓷的制备
将二水磷酸氢钙(医药级,洛阳龙门药业有限公司)、碳酸钙(医药级,上海碳酸钙厂)按照摩尔比2∶1 添加到球磨罐中,添加无水乙醇(医药级,新乡市先丰医药新材料有限公司)和磨球,球磨2~5 h,在干燥箱中干燥至恒重后转移到马弗炉中高温煅烧,冷却后球磨,得到-磷酸三钙粉料。
选用200~300 g 雄性SD 大鼠50 只[湖北省实验动物研究中心提供,动物使用许可证号:SCXK(鄂)2008-0004],麻醉处死后取长管骨段压碎后用手工磨粉器将其制作成骨粉,用分析筛筛选100~900m 的骨粉备用。10℃~12℃条件下,用乙醇复合溶剂进行脱脂,磁力搅拌24 h,用纯化水进行反复震荡冲洗40 min。用0.6 mol/L 的盐酸对骨粉进行脱钙,磁力搅拌器持续搅拌24 h,更换盐酸溶液后又脱钙24 h。用纯化水反复冲洗骨粉1 h。将所有骨粉同时进行冷冻干燥24 h。
将DBM 添加到2%的羟丙甲纤维素(医药级,浙江中维药业股份有限公司)溶液中,搅拌混合均匀,然后注射到3D 打印多孔生物陶瓷的孔道中,冷冻干燥,得到载DBM的多孔生物陶瓷。
1.2 3D 打印多孔生物陶瓷理化性能研究
1.2.1 -磷酸三钙理化性能表征
使用德国布鲁克AXS 公司D8 Advance 型X 射线衍射分析仪对合成的-磷酸三钙粉料的物相结构进行分析表征。XRD 分析条件:靶:Cu-Ka 射线(=0.154 06 nm),管压:40 kV,管流:40 mA,2扫描范围:10°~80°。
采用英国马尔文仪器公司MS2000 型激光粒度分布仪进行粒径分析。
1.2.2 3D 打印多孔生物陶瓷理化性能表征
利用美国Instron 公司万能材料试验机Instron 5967 测量抗压强度,探头加载速度为0.5 mm/min。
使用德国蔡司Zeiss Ultra Plus 型场发射扫描电子显微镜(FE-SEM,放大倍数:12~1 000 000)对粉体和陶瓷微观形貌进行观察,同时自带配套能谱仪(EDS),用于分析测试样品的元素组成。
按《中华人民共和国药典》(第四部)中0821 重金属检查法进行检测样品的重金属总量。
1.3 细胞毒性
将细胞浓度为1.0×105个/mL 的细胞(L929)悬液按100L/孔接种于96 孔板,置于37℃、5%CO2、饱和湿度的细胞培养箱中培养24h。去除原培养液,用PBS 清洗3 遍,按照100L/孔分别加不同浓度的材料浸提液(浸提条件为:按照0.2 g/mL,在37℃下浸提24 h)与对照溶液,空白对照为MEM 培养液,阴性对照为含10%生理盐水的MEM 培养液,阳性对照为含10%DMSO 的MEM 的培养液,每组设置6 个复孔,继续培养,分别于24 h、72 h 时观察细胞生长状态。
1.4 动物试验
1.4.1 动物模型的制作与分组
3D 打印多孔生物陶瓷和载DBM 的3D 打印多孔生物陶瓷经钴60 灭菌(16~25 kGy)后备用。
健康8 周雄性SD 大鼠12 只(湖北省实验动物研究中心提供),体量160~200 g。采用异氟烷进行呼吸麻醉,大鼠头部剃毛后常规消毒铺巾,在无菌条件下切开皮肤,切口长约1.5 cm,使用磨骨钻造孔(6 mm),植入样本材料,缝合筋膜皮肤,放回笼内分开养殖,动物苏醒后自由活动,正常喂食。手术后8 周处死动物,取植入物及其周围的骨组织。3D-TCP 组:植入3D 打印多孔生物陶瓷,每组4 只;3D-TCP/DBM 组:植入载DBM 的3D 打印多孔生物陶瓷,每组4 只;空白组:不植入任何材料,每组4 只。
1.4.2 组织形态学观察
标本经10%福尔马林固定后,常规脱钙、脱水、透明、石蜡包埋、切片,常规行HE 和Masson 染色,观察组织学变化。
1.5 统计学方法
采用SPSS 16.0 统计学软件处理数据,数据以均数±标准差表示,采用检验,<0.05 为差异有统计学意义。
2 结果
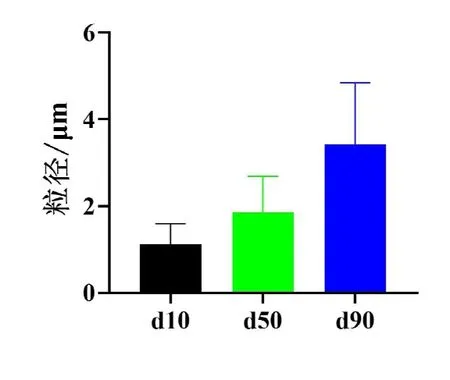
图1 -磷酸三钙的粒径分布

图2 -磷酸三钙的XRD 图谱
2.2 3D 打印多孔生物陶瓷理化性能
在1 050℃、1 150℃、1 250℃和1 350℃条件下烧结的样品的重金属总量均<50 ppm。
3D 打印多孔生物陶瓷在1 050℃、1 150℃、1 250℃和1 350℃条件下烧结的样品的抗压强度分别为(8.57±2.10)MPa,(17.02±5.16)MPa,(19.35±2.94)MPa,(15.9±3.45)MPa,其中在1 250℃条件下烧结的样品抗压强度最高,在1 150℃、1 250℃和1 350℃条件下烧结的样品与在1 050℃条件下烧结的样品的抗压强度比较,差异具有统计学意义(见图3,<0.05)。

图3 3D 打印多孔生物陶瓷在不同烧结温度下的抗压强度(*<0.05,**<0.01,***<0.001;n=6)
图4 为3D打印多孔生物陶瓷在不同烧结温度下的SEM图和EDS 图,从图4 中可以看出,在1 050℃条件下烧结,微观结构为明显的颗粒状;在1 150℃条件下烧结,-磷酸三钙颗粒连接为整体,存在一定的孔隙;在1 250℃条件下烧结,-磷酸三钙连接为致密的整体,存在少量的空隙;在1 350℃条件下烧结,材料烧结为整体,但是可以看到颗粒之间存在明显的界限,且孔隙较1 250℃条件下增多。所有条件下烧结的样品表面均可观察到分布均匀的Ca 和P,表观Ca/P 为1.52±0.06。

图4 3D 打印多孔生物陶瓷在不同烧结温度下的SEM 图(×5000)和EDS 图
2.3 细胞毒性
培养24 h,空白组、3D-TCP 组和3D-TCP/DBM 组的OD 值分别为0.79、0.69 和0.70,得到3D-TCP 组和3D-TCP/DBM 组的存活率分别为87.3%和88.6%,大于GB/T 16886.5要求的70%,无细胞毒性;培养72 h,空白组、3D-TCP 组和3D-TCP/DBM 组的OD 值分别为1.48、1.11 和1.19,得到3D-TCP 组和3D-TCP/DBM 组的存活率分别为75.0%和80.4%,无细胞毒性。

图5 3D 打印多孔生物陶瓷体的外细胞毒性评价
2.4 植入试验
2.4.1 大体观察
SD 大鼠均无死亡,活动、进食情况正常,精神状态无明显变化。未见瘫痪、惊厥、呼吸抑制等不良反应。伤口均愈合良好。空白组骨缺损区域未见明显减小,无明显成骨(见图6A1 和6A2)。3D-TCP 组:取材后,3D 打印多孔生物陶瓷与周围骨组织融合,可见组织长入孔隙,未见材料明显降解,形态未发生明显改变(见图6B1 和6B2)。3D-TCP/DBM 组:取材后,可诱导3D 打印多孔生物陶瓷与周围骨组织融合,可见组织长入孔隙,中间孔隙DBM 形态发生改变,转化为较硬的骨组织,并与-磷酸三钙支架融合,未见支架明显降解(见图6C1 和6C2)。

图6 3D 打印多孔生物陶瓷外观形态:A1、A2.空白组0 周和8 周时形态;B1、B2.3D-TCP 组0 周和8 周时形态;C1、C2.3D-TCP/DBM 组0 周和8 周时形态
2.4.2 组织形态学观察
图7 为大鼠颅骨植入试验8 周后取材HE 和Masson 染色结果。空白组骨缺损界限清晰,无明显骨组织生长,在骨缺损处可见少量新生血管(见图7A 和图7D)。3D-TCP 组可见大量-磷酸三钙材料残留,同时也能观察到材料少量降解,在降解空隙中可见少量组织长入;同时可以观察到,在材料孔隙中有大量的新生血管和骨组织生成,新生骨组织与3D打印多孔生物陶瓷紧密结合,沿着孔隙向内生长(见图7B和图7E)。3D-TCP/DBM 组中同样可见大量-磷酸三钙材料残留和少量材料降解,其中DBM 基本转化为新生骨组织,可见大量骨细胞和骨髓生成,且融合为整体;DBM 转化生成的新生骨组织占据整个中间孔隙,且向周围孔隙生长,同时在周围孔隙可见大量新生血管,骨组织生长于多孔生物陶瓷的孔隙中,且与多孔生物陶瓷紧密接触(见图7C和图7F)。

图7 SD 大鼠颅骨植入试验的HE 和Masson 染色切片(术后8 周):A-C.空白组、3D-TCP 组和3D-TCP/DBM 组HE 染色;D-F.空白组、3D-TCP组和3D-TCP/DBM 组Masson 染色
3 讨论
采用SLA 技术进行3D 打印的优点主要在于可实现规模化生产,产品精度高,能够设计复杂的内部孔隙和外部结构,可进行个性化定制,从而可以减轻患者痛苦,同时增加产品成骨能力[1-2]。而这些优点都是建立在打印的粉料具有良好的生物相容性、足够小的粒径(<10m)和良好的热稳定性的基础上[2,4,6]。相比较羟基磷灰石,采用-磷酸三钙作为打印粉料,主要是因为其具有良好的降解性能[9-11]。同时本文合成的-磷酸三钙具有较高的纯度,XRD 图谱未观察到任何杂质峰,确保其良好的生物安全性,且粒径小于10m,分布范围窄,确保其打印精度,为个性化定制奠定基础。从制备的植入材料外形可以看出,样品具有均匀的孔隙结构,孔径为0.5mm,外观规整。
孔径和孔连通率是影响骨传导性能的关键因素,支架孔径为300~500m 时,且具备高孔连通率时,有助于骨和血管的长入,具备良好的骨传导作用,促进成骨[18-19]。3D 打印多孔生物陶瓷为孔隙完全连通的多孔结构,多孔结构会增加材料比表面积,同时材料由外到内整体与体液接触,在一定程度上会加快材料的降解速度;磷酸钙降解过程中会释放钙离子和磷酸根离子,有助于类骨质的钙化,形成新骨[10]。负载DBM 时,由于其特殊的结构,使得DBM 充分暴露在体液环境中,有助于DBM 的分解,同时DBM 具备骨诱导能力,降解过程中会释放BMP 等生长因子,自身逐渐被新骨替代,加之支架的骨传导作用,内外同时传导,加速骨愈合[13-15]。术后8 周,可以看到空白组无明显骨组织生长,而3D-TCP 组有大量新骨和血管长入,血管的长入为新骨的生长提供了营养基础,且骨组织与材料结合紧密,体现了良好的骨传导作用;3D-TCP/DBM 组中DBM 在没有与骨组织接触的情况下转化为新骨,且新骨内可见骨髓,体现DBM 具备骨诱导能力,并可见新骨向孔隙结构中传导的趋势,实现了内外共同传导的目的;大部分-磷酸三钙支架没有降解,在前期支架可以起到骨传导和提供钙离子和磷酸根离子的作用,最后会被完全吸收,转化为新骨。通过3D 打印多孔生物陶瓷和DBM的协同作用,达到前期快速成骨的目的,进一步加快了骨愈合。
本研究制备的3D打印多孔生物陶瓷具有良好的生物相容性和骨传导性,在1 250℃条件下烧结力学性能更优,结构更为致密,该多孔结构有助于骨和血管的长入,实现材料的骨传导作用;通过负载DBM,可实现骨的双向传导,加速骨愈合。有待通过研究更多动物模型来进一步研究3D 打印多孔生物陶瓷的骨传导和骨诱导性能。
