雷公藤多苷通过PI3K/Akt通路对糖尿病肾病大鼠热休克蛋白90及PGC-1α表达的影响*
2021-12-21于向慧何艳玲杨雨菲张庚良冯晓辞
于向慧,何艳玲,杨雨菲,张庚良,冯晓辞
(1.河北省中医院内分泌科,河北石家庄 050032;2.河北中医学院,河北石家庄 050091)
糖尿病肾病(diabetic nephropathy, DN)是由高糖微环境引起的多种病理机制协同作用导致的肾组织细胞凋亡和纤维化,表现为肾功能逐渐下降[1]。目前关于DN 的发病机制仍不明确,有研究认为高糖微环境激活PI3K/Akt 通路,促进炎症细胞因子等基因转录,导致细胞凋亡和纤维化[2]。热休克蛋白(heat shock protein, HPS)是分子伴侣蛋白的一个家族,参与蛋白质折叠和稳定化,其中HSP90 是最丰富的一种,各种压力条件(如高糖、高温、缺氧等)均可诱导HSP90 的活化[3]。最新研究发现,DN 患者HPS90 明显上调,但是其在DN 中的作用机制和调控方式仍不明确[4]。过氧化物酶体增殖物激活受体- γ 共激活因子-1α(peroxisome proliferatoractivated receptor-γ coactivator-1α, PGC-1α)可通过调控线粒体功能调节活性氧自由基,进而参与DN 的发生、发展[5]。雷公藤多甙(tripterygium glycosides, TG)是从传统中药雷公藤中提取的一种化合物,有缓解肾组织损伤的作用[6]。近年来研究显示,TG 对DN 也具有治疗作用[7]。也有研究显示,TG 可通过抑制PI3K/Akt 通路,缓解甲状腺氧化应激状态[8],但是TG 是否通过PI3K/Akt缓解DN,以及是否对HSP90 和PGC-1α 产生影响仍不清楚。本文主要分析TG 通过PI3K/Akt 通路对DN 大鼠HSO90、PGC-1α 水平的影响。
1 材料与方法
1.1 动物模型复制及分组
65 只SD 大鼠SPF 级,雄性,12 周,体重220~250 g,购自华北制药股份有限公司。实验动物生产许可证号:SCXK(冀)2019-004,实验动物使用许可证号:SYXK(冀)2019-011。取50 只SD 大鼠腹腔注射链脲佐菌素(60 mg/kg,pH=4.5)复制DN模型[9]。注射后第3 天抽取大鼠检测尾静脉血检测空腹血糖,空腹血糖>16.67 mmol/L 证明糖尿病模型复制成功。继续饲养4 周后,收集大鼠尿液检测尿微量白蛋白,以尿微量白蛋白>15 μg/ml 确定DN 模型复制成功。本研究模型复制成功率为92.00%(46/50)。随机选择45 只模型复制成功的大鼠分为DN 组、DN+TG组和DN+TG+SC79组,每组15只;选择15只健康大鼠作为对照组。DN+TG 组和DN+TG+SC79 组大鼠TG 灌胃,根据人体和大鼠体质量换算出剂量为20 mg/kg,1 次/d[10]。DN+TG+SC79 组大鼠腹膜内注射SC79 以激活PI3K/Akt 通路[11],剂量为0.04 mg/g,2 次/周。连续干预4 周后进行实验。
1.2 主要试剂及仪器
链脲佐菌素(上海如吉生物科技发展有限公司),PI3K/Akt通路激动剂SC79(S7863)(上海碧云天生物技术有限公司),酶联免疫吸附试验试剂盒(enzyme linked immunosorbent assay,ELISA)(南京森贝伽生物科技有限公司),苏木精-伊红(hematoxylin-eosin,HE)和Masson染色试剂盒、RNAspin Mini 和miRNeasy Mini 试剂盒、Bestar qRT-PCR 和Bestar qRT-PCR 试剂盒、TaqMan miRNA试剂盒、一抗和山羊抗免疫球蛋白G(IgG)二抗(1∶1 000 稀释,#ab6721)、硝酸纤维素膜、电化学发光(electrochemiluminescence,ECL)显色试剂盒购自广州易锦生物技术有限公司。SMT100V小动物自动生化分析仪、显微镜购自上海易毕恩生物技术有限公司。
1.3 方法
1.3.1 肾功能指标和炎症因子通过SMT100V 小动物自动生化分析仪检测大鼠24 h 尿蛋白和肌酐,评估肾功能。收集大鼠尾静脉血,2 000 r/min 离心20 min,收集上层血清,用ELISA 试剂盒检测白细胞介素1β(Interleukin-1β, IL-1β)和IL-6,用酶标仪检测450 nm 处的吸光度值,然后根据标准曲线计算IL-1β 和IL-6 水平。
1.3.2 HE 染色大鼠安乐死后取出肾组织并在室温条件下用4%多聚甲醛固定6 h。乙醇脱水(从低浓度到高浓度)后,将组织包埋在石蜡中,制作5 μm 厚的切片,固定在载玻片上。载玻片在室温条件下用苏木精染色10 min,自来水洗涤1~2 min后将载玻片置于10%冰醋酸中10 s,然后置于1%氨水中,直到切片变蓝。随后用自来水清洗1~2 min后将载玻片放入曙红中10 s。用乙醇(浓度分别为70%、90%、95%和100%)脱水后,将载玻片置于二甲苯中2 min;重复此步骤1 次。最后用中性胶密封玻片,在倒置显微镜下观察大鼠肾组织损伤情况。
1.3.3 Masson 染色将肾组织固定在10%中性甲醛缓冲液,石蜡包埋、切片(厚约4 μm),用Masson三色染色剂染色,以检测肾间质纤维化的面积。2位研究人员使用IDA-2000 高分辨率数字显微镜和图像分析系统,在400 倍放大镜下评估每个视野的纤维化面积百分比。
1.3.4 Western blotting 检测HPS90 和PGC-1α 蛋白表达将肾组织置于RIPA 裂解缓冲液中,冰上裂解。通过8% SDS-PAGE 分离每个样品中等量(50 μg)蛋白,并将其转移到硝酸纤维素膜上。室温条件下将膜浸入5%脱脂牛奶中2 h,封闭非特异性抗原。膜与一抗体在4℃条件下孵育过夜,然后将膜与相应的辣根过氧化物酶偶联的二抗在室温下孵育1 h。使用ECL 显色试剂盒显色,Quantum One 软件分析灰度,计算蛋白相对表达量。
1.3.5 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测HPS90 和PGC-1α mRNA 表达采用RNeasy Mini试剂盒提取肾组织总RNA,Bestar qRT-PCR 试剂盒逆转录为cDNA,条件如下:37℃15 min,98℃5 min。采用Bestar™qRT-PCR 预混液进行qRT-PCR实验,反应条件:95℃预变性2 min,94℃变性20 s,58℃退火20 s,72℃延伸20 s,共计40 个循环,72℃继续延伸4 min。使用Agilent Stratagene Mx3000P序列检测系统进行qRT-PCR 分析。通过比较循环阈值并以GAPDH 作为内参,计算mRNA 相对表达量。qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析或t检验,多组间进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血糖水平比较
各组大鼠干预前的血糖水平比较,经方差分析,差异有统计学意义(P<0.05);各模型组大鼠干预前血糖均高于对照组,且>16.67 mmol/L。各组大鼠干预后的血糖水平比较,经方差分析,差异有统计学意义义(P<0.05);DN+TG 组、DN+TG+SC79 组低于DN 组(P<0.05)。对照组、DN 组大鼠干预前后的血糖水平比较,经t检验,差异无统计学意义(t=0.842 和0.126,P=0.412 和0.106)。DN+TG 组、DN+TG+SC79 组大鼠干预前后的血糖水平比较,经t检验,差异有统计学意义(t=35.058 和36.821,均P=0.000),干预后血糖降低。见表2。
表2 各组大鼠空腹血糖水平比较(n=15,mmol/L,±s)
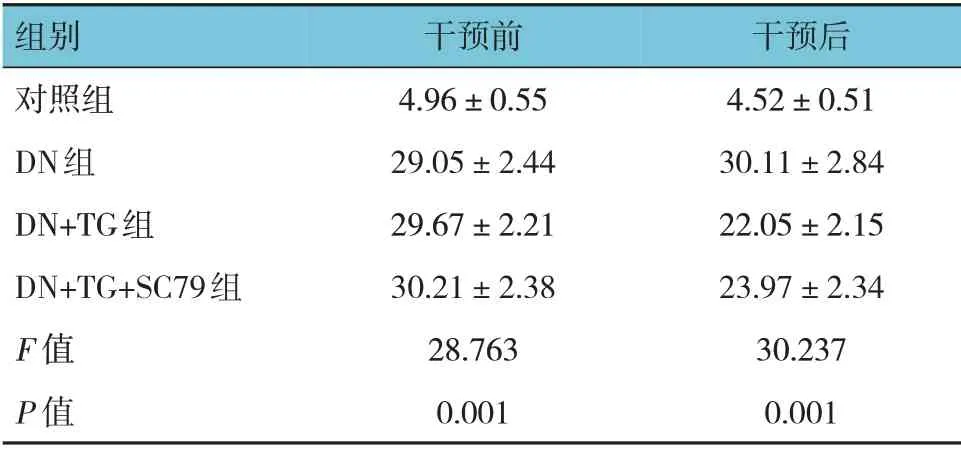
表2 各组大鼠空腹血糖水平比较(n=15,mmol/L,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值干预前4.96±0.55 29.05±2.44 29.67±2.21 30.21±2.38 28.763 0.001干预后4.52±0.51 30.11±2.84 22.05±2.15 23.97±2.34 30.237 0.001
2.2 TG对大鼠肾组织损伤的影响
对照组肾小球和肾小管正常;DN组肾小球出现水肿和炎症浸润,结构出现异常,肾小球膨大;DN+TG组肾小球结构基本完整,水肿和炎症浸润有所缓解;DN+TG+SC79组肾小球损伤情况与DN组类似。见图1。

图1 各组大鼠肾组织损伤情况 (HE染色×400)
2.3 TG对大鼠肾功能的影响
各组大鼠肾功能指标比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组24 h 尿蛋白和肌酐高于对照组和DN+TG 组(P<0.05);DN+TG+SC79 组的24 h 尿蛋白和肌酐高于DN+TG 组(P<0.05)。见表3。
表3 各组大鼠肾功能指标比较 (n=15,±s)

表3 各组大鼠肾功能指标比较 (n=15,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值24 h尿蛋白/mg 24.57±3.85 248.16±30.28 126.92±19.74 238.24±31.06 25.179 0.001肌酐/(μmol/L)28.35±3.96 55.42±7.47 39.38±5.58 52.51±7.43 23.731 0.001
2.4 TG对大鼠肾纤维化的影响
对照组、DN 组、DN+TG 组、DN+TG+SC79 组的肾组织纤维化面积百分比分别为(3.74±0.45)%、(21.77±2.06)%、(7.94±0.91)%和(19.32±1.89)%,经方差分析,差异有统计学意义(F= 27.356,P=0.001)。进一步两两比较结果:DN 组高于对照组和DN+TG 组(P<0.05);DN+TG+SC79 组高于DN+TG 组(P<0.05)。见图2。

图2 各组大鼠肾纤维化情况 (Masson染色×400)
2.5 各组大鼠PI3K/Akt通路激活情况
各组大鼠肾组织中PI3K/Akt 通路激活情况比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组p-PI3K/PI3K 和p-Akt/Akt 高于对照组和DN+TG 组(P<0.05);DN+TG+SC79 组p-PI3K/PI3K 和p-Akt/Akt 高于DN+TG 组(P<0.05)。见表4和图3。

图3 各组大鼠肾组织中PI3K/Akt通路的表达
表4 各组大鼠PI3K和Akt磷酸化水平比较(n=15,±s)
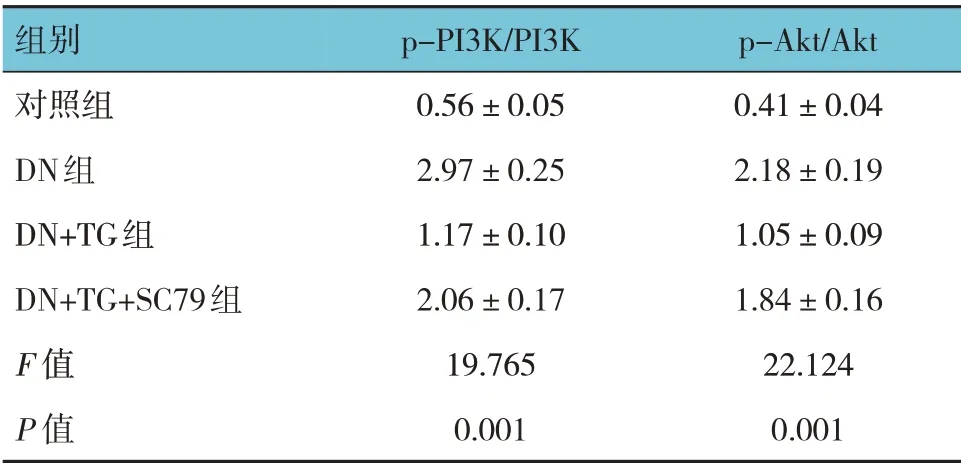
表4 各组大鼠PI3K和Akt磷酸化水平比较(n=15,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值p-PI3K/PI3K 0.56±0.05 2.97±0.25 1.17±0.10 2.06±0.17 19.765 0.001 p-Akt/Akt 0.41±0.04 2.18±0.19 1.05±0.09 1.84±0.16 22.124 0.001
2.6 TG对大鼠肾组织HSP90、PGC-1α转录水平的影响
各组大鼠肾组织HSP90、PGC-1α mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组HSP90 mRNA相对表达量高于对照组和DN+TG 组(P<0.05),而PGC-1α mRNA 相对表达量低于对照组和DN+TG 组(P<0.05);DN+TG+SC79 组HSP90 mRNA 相对表达量高于DN+TG 组(P<0.05),而PGC-1α mRNA 相对表达量低于DN+TG 组(P<0.05)。见表5。
表5 各组大鼠HSP90和PGC-1α mRNA相对表达量比较 (n=15,±s)

表5 各组大鼠HSP90和PGC-1α mRNA相对表达量比较 (n=15,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值HSP90 mRNA 0.94±0.09 4.89±0.45 3.01±0.28 4.74±0.45 15.764 0.001 PGC-1α mRNA 4.72±0.43 0.91±0.09 3.54±0.41 1.45±0.22 14.987 0.001
2.7 TG对大鼠肾组织HSP90、PGC-1α蛋白表达的影响
各组大鼠肾组织HSP90 和PGC-1α 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组HSP90 蛋白相对表达量高于对照组和DN+TG 组(P<0.05),而PGC-1α 蛋白相对表达量低于对照组和DN+TG 组(P<0.05);DN+TG+SC79 组HSP90 蛋白相对表达量高于DN+TG 组,而PGC-1α 蛋白相对表达量低于DN+TG 组(P<0.05)。见表6和图4。
表6 各组大鼠HSP90和PGC-1α蛋白相对表达量比较(n=15,±s)
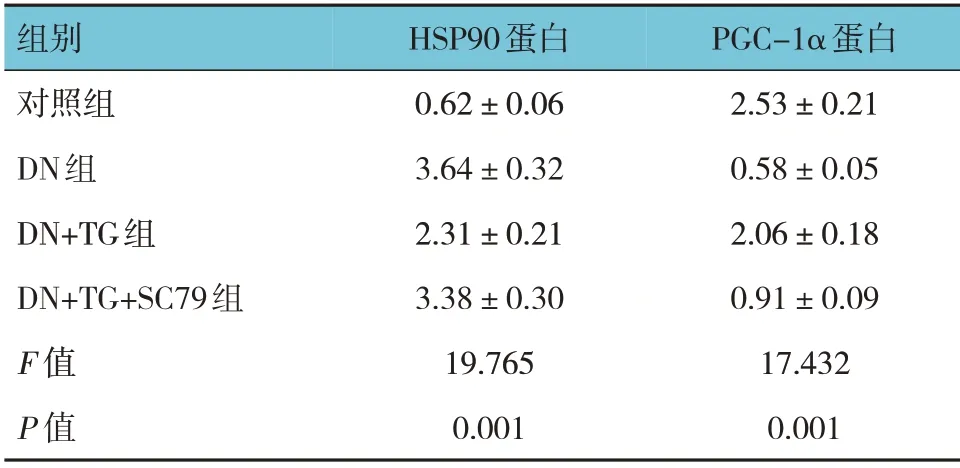
表6 各组大鼠HSP90和PGC-1α蛋白相对表达量比较(n=15,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值HSP90蛋白0.62±0.06 3.64±0.32 2.31±0.21 3.38±0.30 19.765 0.001 PGC-1α蛋白2.53±0.21 0.58±0.05 2.06±0.18 0.91±0.09 17.432 0.001

图4 各组大鼠肾组织HSP90和PGC-1α蛋白的表达
2.8 TG对大鼠IL-1β、IL-6水平的影响
各组大鼠炎症因子水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组IL-1β、IL-6 水平高于对照组和DN+TG组(P<0.05);DN+TG+SC79 组IL-1β、IL-6 水平高于DN+TG 组(P<0.05)。见表7。
表7 各组大鼠IL-1β、IL-6水平比较(n=15,pg/mL,±s)

表7 各组大鼠IL-1β、IL-6水平比较(n=15,pg/mL,±s)
组别对照组DN组DN+TG组DN+TG+SC79组F 值P 值IL-1β 14.67±2.01 86.32±9.65 38.76±4.63 80.77±9.44 23.087 0.001 IL-6 24.21±2.86 96.75±9.39 49.02±5.67 91.34±10.43c 22.456 0.001
3 讨论
全世界超过4亿人患有糖尿病,每年死亡370万人[12]。长期高血糖会损害器官的小血管,主要包括眼睛、肾脏和神经。在许多国家,DN 是导致终末肾脏疾病最常见的原因,表现为肾小球肥大、蛋白尿和肾小球膜细胞分泌的细胞外基质(extracellular matrix, ECM)成分积累。在DN 中,促炎症细胞因子(如IL-1β 和IL-6 等)水平升高,影响肾单位的转运蛋白和离子通道的功能,并导致肾脏纤维化和肾小球硬化。肾小球功能性细胞丧失与ECM 蛋白(尤其是间质胶原蛋白,包括Ⅰ、Ⅲ和Ⅳ型胶原蛋白)过度积累密切相关,肾纤维化是DN进展的关键机制,也是导致肾功能丧失的主要原因[13]。但是目前尚无治疗DN 的有效方法。
有研究显示,PI3K/Akt 在DN 中发挥重要作用,PI3K 和Akt 被磷酸化激活后,进入细胞核调节转录,从而促进炎症因子和ECM 等的表达,损伤肾功能[14-15]。中药在治疗DN 中取得了长足的发展,有研究表明中药可通过抑制PI3K/Akt 通路,缓解DN,保护肾功能[16]。TG 是从雷公藤根木质部提取和纯化的活性物质,已被广泛用于治疗自身免疫和炎症疾病,包括类风湿性关节炎、系统性红斑狼疮及肾病综合征等[17]。并且近年来也有生物信息学研究结果显示,TG 具有缓解糖尿病引起的器官纤维化的作用,从而缓解包括DN 在内的糖尿病并发症[18],但是TG 是否通过PI3K/Akt 通路对DN 肾功能和纤维化具有缓解作用仍未明确。本研究通过TG 灌胃干预DN 小鼠,并通过SC79 激活PI3K/Akt通路,SC79 可作为促进动物模型中PI3K 和Akt 磷酸化的试剂[19]。结果显示TG 能够明显缓解DN 大鼠的肾组织损伤和纤维化,保护肾功能。通过Western blotting 结果检测证实DN 大鼠模型肾组织中PI3K 和Akt 蛋白磷酸化水平明显升高,而TG 可显著抑制PI3K/Akt 通路的激活,SC79 可使PI3K 和Akt磷酸化水平恢复。并且本研究结果还表明,使用SC79 激活PI3K/Akt 通路后,TG 对肾组织的保护作用被阻断。有研究发现,TG 可通过抑制PI3K/Akt通路,提高卵巢癌细胞对顺铂的敏感性[20]。陈婷等[21]研究发现TG 可通过减少PI3K 和Akt 磷酸化水平,抑制青光眼手术后的纤维化。有研究显示TG也具有降低血糖的作用,但是其对血糖的影响有限,干预后血糖浓度依旧>16.67 mmol/L,这对保护肾脏组织作用轻微。这提示在DN 中,TG 可能通过抑制PI3K/Akt 通路的激活,保护肾组织并减少ECM的累积,从而保护肾功能。但是关于TG 抑制PI3K/Akt 后,通过何种分子机制缓解DN 仍不清楚。
PI3K-Akt 信号通路的活性可以被类脂磷酸酶PTEN 和SHIP 负调节,但迄今为止尚未发现下调Akt 活性的特异磷酸酶,而用磷酸酶抑制剂处理细胞后,Akt 的磷酸化和活性均有所增加。最近发现HSP90 能结合Akt,阻止Akt 被PP2A 磷酸酶的去磷酸化而失活,因此具有保护Akt 的作用。另外激活PI3K/Akt 可磷酸化Sirt1,随后Sirt1 乙酰化激活PGC-1α 从而发挥其作用。为进一步分析TG 通过PI3K/Akt 缓解DN 的作用机制,本文检测了HSP90和PGC-1α 表达。HSP90 的表达可被PI3K/Akt 通路上调[22],体外研究也显示高糖环境下肾小管细胞中HSP90 升高,其过表达加速细胞损伤[23]。而抑制HSP90 可使DN 大鼠IL-6 等炎症因子水平降低,保护肾脏功能[24]。PGC-1α 具有保护线粒体、缓解氧化应激和抗纤维化作用[25],并且与PI3K/Akt 之间存在串扰,两者互相调控[26]。有研究结果显示,中药在缓解DN 的同时还会促进PGC-1α 的表达[27]。本研究结果显示,DN 组大鼠肾组织中HSP90 表达及炎症细胞因子水平均显著升高,而PGC-1α 表达降低,TG 能够抑制HSP90 表达和降低炎症因子,并促进PGC-1α 的表达,而使用SC79 激活PI3K/Akt后,TG 抑制HSP90 表达和降低炎症因子水平,以及促进PGC-1α 表达的作用被阻断。有研究发现,TG 可通过抑制HSP90 的表达改善肾病综合征患者肾功能[9]。最新研究表明,雷公藤的活性提取物可通过促进PGC-1α 的转录和翻译缓解炎症反应,进而调控细胞代谢,保护细胞[28]。提示DN 的发生可能与PI3K/Akt 促进HSP90 表达,抑制PGC-1α 表达有关,而TG 可能通过激活PI3K/Akt 通路,调节p-Akt 的转录调节功能,进而抑制HSP90 的转录和翻译,促进PGC-1α 的表达,起到缓解DN 的作用。
综上所述,TG 可以通过抑制PI3K/Akt 通路,抑制HSP90 的转录和翻译,促进PGC-1α 的表达,并发挥抗炎和抗纤维化作用,从而缓解DN。
