CFH基因多态性对年龄相关性黄斑变性及雷珠单抗疗效的影响
2021-12-21李梦旸辛向阳
李梦旸,辛向阳
(1.内蒙古医科大学,内蒙古 呼和浩特 010050;2.内蒙古包钢医院)
年龄相关性黄斑变性(AMD)是一种进行性致盲疾病,是老年人群,特别是55岁以上人群视力受损的主要原因,目前尚无治愈方法[1]。AMD的病理生理学是复杂的,除了遗传易感性外,至少有四个过程会导致该病,即脂褐素生成(与氧化应激有关)、Drusen生成、局部炎症和新生血管(在nAMD的情况下)[2]。
AMD病理发生在黄斑区的功能性解剖复合体内,包括:光感受器、视网膜色素上皮(RPE)细胞、Bruch膜和脉络膜,其中RPE细胞,是AMD发病的第一个功能损害的细胞,导致依赖于RPE细胞功能的光感受器也发生不可逆变性损害[3-4]。RPE细胞具有类视黄醇的转化和储存、胞外段膜的吞噬、散射光的吸收、离子和液体的转运以及维持与其覆合的光感受器细胞的功能等[5]。功能受损的RPE细胞,溶酶体降解功能、细胞蛋白酶体、自噬蛋白清除系统受损,导致自动氧化剂脂褐素的积累,增加了RPE细胞的氧化应激和蛋白质损伤,蛋白质显然是通过胞吐作用移动到RPE细胞外部的,这种物质可能与慢性炎症和炎症细胞一起参与Drusen的形成[6-7]。Drusen的数量、所测累计视网膜的大小和体积、以及是否接近黄斑处,都是进展为晚期AMD的危险因素[8]。在AMD晚期(进展期),Bruch膜内及其周围的Drusen过度积聚,破坏RPE和脉络膜之间的代谢运输,从而进一步损害RPE的功能,接着是局限性炎症,加重黄斑的神经退行性变[9-10]。临床上晚期(进展期)AMD分为两种,湿性及干性。在湿性AMD中,RPE产生过多的血管内皮生长因子(VEGF),这有助于破坏血液视网膜屏障(外屏障),异常的血管从脉络膜穿过Bruch 's膜进入视网膜下或者RPE下,这一过程称为脉络膜新血管形成[11]。干性AMD,其病理改变有视网膜色素上皮细胞萎缩、脱离,是视网膜色素细胞和视细胞逐渐凋亡的结果[12]。目前年龄相关性黄斑变性(AMD)的发病机制尚不明确,发病风险可能是年龄、环境和遗传因素复杂交互作用的影响。多个基因和/或单核苷酸多态性(SNPs)被发现与AMD有关,包括补体途径、脂质代谢和细胞外基质(ECM)重构等。全基因组关联研究(GWS)已经确定了与AMD相关的几种常见遗传变异,它们共同作用占AMD遗传力的15 %~65 %,在已知的导致疾病风险的遗传因素中,CFH Y402H和HTRA1/ARMS多态性占AMD遗传风险的50 %以上[13-14]。现在人们普遍认为,补体级联调节不足导致的过度炎症反应是引发老年性黄斑变性发病的主要原因[15],且补体途径在AMD发病机制中的作用已经被一些具有AMD风险的补体因子中的遗传变异所证实[16]。其中补体因子H(CFH)的基因多态性,对晚期AMD进展的影响较大[17-19]。本文就CFH基因多态性与AMD的发病机制进行综述。
1 补体系统在AMD发病机制中扮演重要角色
补体系统作为先天免疫系统的主要部分,是防御外来病原体和矫正自身组织的系统。到目前为止,补体激活是通过经典的、旁路的和凝集素途径发生的。这些相互关联的分子级联途径都具有诱导C3转化酶合成的能力,C3转化酶是一种将C3分解为其活性副产物C3a和C3b的酶[20]。因C3处于经典途径和凝集素途径的汇合点,在补体激活途径中处于枢纽的位置,也是旁路途径激活的关键因子,所以C3是补体系统中最重要、含量最多的成分[21]。经典的途径是由IgM、IgG补体固定异构体、C反应蛋白和血清淀粉样P蛋白等其他蛋白激活的。这些识别蛋白的结合使C1q直接结合,启动了一个以多个蛋白水解步骤为特征的级联反应[22]。开始于C1r自动激活、C1s(C1的两个亚组分)的裂解。C1先后裂解C4和C2,新产生的C4b和C2a片段结合后,形成经典途径的C3转化酶(C4b2a)。和旁路途径产生的 C3转化酶(C3bBb)相似,这种双分子酶复合物也能将C3转化为C3a和C3b[15]。凝集素途径通常通过甘露糖结合凝集素激活。它们类似于C1q,并与C1r和C1s的同源物结合,称为甘露聚糖结合凝集素相关丝氨酸蛋白酶(MASP)。MASP-1、MASP-2和MASP-3先后被发现。MASP-2与C1s相似,专一催化裂解C2和C4[23],并在C4和C2裂解时与经典途径会聚。相反,旁路途径是通过C3中硫酯键的自发水解来形成C3b[又叫C3(H2O)]。C3(H2O)能够与因子B(FB)结合,导致FB的构象变化。这种构象变化允许因子D(一种组成性活性血清蛋白酶)将FB裂解为Bb因子。因子Bb保留在C3(H20)Bb复合物中,作为C3的血清蛋白酶,将其裂解为C3b,而C3b又可与FB结合生成更多的C3转化酶(C3bBb)[19](图1)。因此可以把旁路途径中,C3自发的水解看作是免疫级联反映的放大环。C3转化酶启动下一步免疫级联反映,产生活化的C3a和C5a,并在终末途径中,C5a与C6、C7、C8和多个跨膜C9分子的组装,最终形成MAC(membrane attack complex),也称为C5b-9复合物或末端补体复合物[24]。MAC可以直接导致、介导细胞溶解,释放趋化因子以吸引炎症细胞到损伤部位,并增强毛细血管通透性[25]。
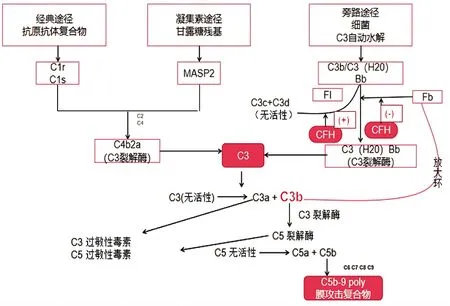
图1 补体三种激活途径在AMD发生中的作用机制图
CFH是补体替代途径的主要抑制剂。它干扰C3转化酶(C3bBb)的形成和活性,减少C5b9膜攻击复合物(MAC)的形成和两种过敏性毒素C3a和C5a的产生[26]。
2 CFH的SNP与AMD发病的关系
补体因子H(CFH)是第一个被发现在补体途径中与AMD风险相关联的基因,因此研究最多[18, 27-28]。CFH位于染色体1q31.3上,是一种含量丰富的155 kDa的血浆补体调节蛋白,血清中浓度为218~654 mg/mL。FH是由视网膜色素细胞合成,且少量的沉积在Bruch’s膜的内表面(与RPE交界处)和脉络膜毛细血管周围[29]。Armento等[30]在一篇报道中总结了FH的丢失与RPE代谢的关系,FH的减少导致细胞外C3/C3b的积累。FH的丢失增加了RPE细胞对氧化应激的脆弱性,会损害RPE细胞的糖酵解,会损害RPE细胞的线粒体呼吸,改变了线粒体自噬和线粒体动力学基因的表达。人类基因组序列将为测量人类群体DNA序列变异提供参考。序列变异是个体的遗传组成部分,包括疾病易感性和药物反应等复杂特征。大多数序列变异是单核苷酸多态性(single nucleotide polymorphisms,SNP)。
CFH基因其遗传变异与炎症性疾病的风险增加有关。CFH基因T1277C多态性(rs1061170),包括T碱基突变为C碱基在第9外显子的1277位置上[31],导致CFH蛋白402位酪氨酸变为组氨酸(Y402H)。该突变影响CFH蛋白与肝素、C反应蛋白结合,减弱了补体系统激活的抑制效应,结果使MAC(membrane attack complex)增多,并大量沉积于视网膜色素上皮基底层,引起黄斑区视网膜色素上皮层萎缩、脉络膜血管内皮损伤、新生血管生成,这一系列病变促使 AMD的发生[32]。Wu等[33]Meta分析中提示CFH基因中rs1061170(Y402H)和rs1410996多态性与AMD风险相关,这两个基因多态性对AMD,尤其是nAMD有较高的易感性。有研究对96个AMD的病例和50个对照组,通过全基因扫描的方法,证实携带CFH基因SNPrs380390纯合子个体发展成AMD的风险增加了7倍[34]。Wu等[35]在165例AMD(88位男性和77位女性)中,发现CFH的两个SNP,分别为rs800292(等位基因G/A,G>A)和rs1410966(等位基因 T/C,T>C)与AMD易感性有很大的关系,且在一项关于中心性浆液性脉络膜病变的研究中提示,CFH rs800292与脉络膜厚度有关,与中浆的发病有相关性,出现与AMD表型重叠[36]。CFH中一个罕见的风险单倍型进行重测序后,发现了与AMD相关的重要罕见变异CFH Arg1210Cys,且独立于常见变异Tyr402His,当AMD首次出现症状时,这种变异的携带者明显更年轻。Arg1210Cys变异使AMD发病风险增加47倍[37-38]。在此之前,CFH中无义变异Gln408Ter和Arg1078Ser已经在一种被称为表皮型drusen的AMD亚型家族中被鉴定出来[39]。目前,尚无文献报道,CFH基因SNP与AMD病程发展的相关性。
3 CFH的SNP导致的AMD在雷珠单抗注射临床治疗中的效果
药物遗传学研究表明,新生血管型AMD(nAMD)患者对抗血管内皮生长因子(VEGF)治疗的不同反应可能与补体因子H基因(CFH)的多态性有关。Hong等[40]在14项相关研究包括2963名无治疗史的AMD患者中,指出携带rs1061170/Y402H TT基因型的患者比携带CC基因型的患者更有可能获得较好的治疗效果(OR=1.932, 95 %CI=1.125-3.317,P=0.017)。
同样Mohamad等[41]的一项研究中,给每一位确诊nAMD诊断的患者玻璃体内注射0.5 mg/0.05 mL雷珠单抗,分为反应组(49人)和无反应组(84人)。随访6个月后,CC基因型的最佳矫正视力(BCVA)平均值明显低于TT + CT基因型的BCVA平均值(P=0.018)。但是在后来回归分析显示,在隐性模型下,nAMD患者的Y402H基因型与治疗反应之间无显著相关性(P>0.05)。结论是除了Y402H多态性外,其他因素可能参与了抗VEGF药物治疗后的nAMD进展。
Veloso等[42]对95位携带CFH rs1061170(Y402H)基因型的患者进行3个月的雷珠单抗注射治疗。结论是对于具有TT和TC基因型的患者,中心视力的配对比较在与基线数据比较时显示了有统计学意义的改善。风险基因型(CC)纯合子的患者在第1、3、6和12个月访视中获得的中心视力与基线相比,并没有显示出有统计学意义的改善。
Cobos等[43]在一篇文章中总结出高血压是影响AMD患者接受雷珠单抗注射后,解剖结构恢复的重要因素,并且还发现一个具有rs800292(CFH)保护基因型(AA)的nAMD患者比具有其他基因型(AG/GG)的患者,在接受预治疗时,有更好的中心视力。但在第一次注射和加载注射阶段后,它们对雷珠单抗的中心视力反应明显较差。与AG/GG基因型患者相比,它们的改善更为缓慢,AG/GG基因型患者在治疗的最初3个月有强烈的反应,最终趋于稳定。尽管如此,AG/GG基因型的nAMD患者在12个月时的最后中心视力还是比AA基因型患者差。
然而,有研究对100位确诊AMD的西班牙并携带补体因子H(CFH)(rs1410996)的患者进行连续3个月的雷珠单抗注射后随访发现,表达A等位基因的患者进行分组,并与GG纯合的患者进行比较,发现表达基因A的患者主观视力(OR: 4.254)和OCT改善的概率增加(OR: 2.134),但整体,CFH(rs1410996)的基因型与雷珠单抗药物反应却无统计学意义[44]。
4 小结与展望
距离第一次发现人类补体因子H(CFH)基因变异与老年性黄斑变性(AMD)风险之间的关系已有很多年了,但这一认识尚未转化为老年人群的预防措施或老年性黄斑变性患者的治疗。多篇研究报道证实CFH Y402H TT及TC基因型患者对雷珠单抗的反应要比CC基因型好,但也有报道否认这一观点,认为基因型之间对雷珠单抗反应无差别,这可能与实验设计、样本对象、人种选择、统计方式不同有关。因此,仍需进一步对CFH影响老年性黄斑变性(AMD)尤其是湿性分型和治疗方面进行研究,希望将来可以根据基因分型不同而制订出个体化基因靶向治疗。
