氯离子活化过氧乙酸对罗丹明B的降解性能及机理研究
2021-12-21王静晓朱柯安
王静晓, 朱柯安, 陈 飞
重庆大学环境与生态学院, 三峡库区生态环境教育部重点实验室, 重庆 400045
染料废水污染通常具有色度大、含盐量高、可生化性差、致畸致癌变等特点[1],对水生态环境和人体健康均有潜在威胁. 因此,探索绿色高效的染料废水处理技术成为环境领域研究的热点. 在各种处理技术中,AOPs(高级氧化技术)能够具有强氧化能力的活性物质,可去除水中难以生物降解的有机污染物,具有反应速率快、条件温和、脱色效能显著等特点,已在染料废水处理中得到普遍应用[2].
PAA(过氧乙酸)活化技术是近年来新兴的一种AOPs[3],是有机合成化学中常用的一种强氧化剂,一般由乙酸和过氧化氢(H2O2)制备获得,可应用于多种行业的灭菌消毒[4-5]. 与传统含氯消毒剂相比,其氧化能力更强、消毒效率高、毒性低,且在后续处理中可省去脱氯环节,近年来其使用领域也被拓宽至有机废水的治理[6]. 此外,PAA具备高氧化还原电位(1.06~1.96 V)以及独特的化学结构特性,其O—O键比H2O2长,裂解所需键能更低,理论上更在温和的条件下即可被活化,活化过程中可能有CH3C(O)O·(乙酰氧基)、CH3C(O)OO·(乙酰过氧基)和 ·OH(羟基自由基)等活性物质的生成[7],可解决传统H2O2体系对高盐特性染料废水去除率低的问题. 目前,PAA的活化途径主要有UV(紫外)[8]、过渡金属离子及其氧化物[9-12]、ACFs(碳质材料)[13]和加热[14]等. 不同PAA活化途径中产生的主要活性物质也可能不尽相同,如采用过渡金属离子活化方式容易使O—O键断裂,去除有机污染物时有机自由基CH3C(O)O·和CH3C(O)OO·占主导地位. 而在UV/PAA 降解药物过程中,·OH和CH3C(O)O·是起主要作用的活性物质. 有机自由基(E0=2.24 V)的氧化性能虽较传统活性物质〔如SO4·-(E0=2.60 V)和·OH(E0=2.80 V)〕弱,但其半衰期比·OH更长,在选择性和持久性降解水体中有机污染物方面备受关注[15-16]. 开发高效、环保的新型PAA活化途径对染料废水处理具有重大意义.
Cl-(氯离子)是大量存在于高盐有机染料废水中的一类基质,其对氧化剂的活化性能及作用机制近期受到众多研究者的关注. Wang等[17]使用Cl-活化PMS(过一硫酸盐)产生1O2(单线态氧)、HClO(次氯酸)和Cl·(氯自由基)可实现对焦化废水的治理. 谈超群等[18]利用Cl-活化PMS生成ClO-可氧化降解水中药物扑热息痛. 但目前对于Cl-/PAA体系的构建仍鲜见报道,综合对高盐染料废水的认识,设想通过“以废治废”概念来实现对染料废水的快速脱色脱毒,即利用染料废水中高浓度Cl-特性实现PAA的活化并加速有机染料的降解. 与传统高级氧化工艺相比,采用Cl-作为活化剂无需消耗额外能量且不产生二次污染,具有良好的应用前景. 该研究以典型人工合成阳离子型染料RhB(罗丹明B)模拟染料废水,考察Cl-/PAA催化体系中多种因素对RhB降解效果的影响,并对其反应机理进行探究,以期为染料废水的高级氧化方法处理提供新思路.
1 材料与方法
1.1 试剂与仪器
主要试剂:RhB(罗丹明B)、NaCl(氯化钠)、FeCl3·6H2O(六水三氯化铁)、KCl(氯化钾)、MnCl2·4H2O(四水氯化锰)、Na2SO4(硫酸钠)、Na2CO3(碳酸钠)、NaHCO3(碳酸氢钠)、NaNO2(亚硝酸钠)、H2SO4(硫酸)、NaOH(氢氧化钠)、Na2S2O3·5H2O(五水硫代硫酸钠)、TBA(叔丁醇)、MeOH(甲醇)、2,4-HD(2,4-己二烯)、PBQ(对苯醌)、FFA(糠醇)、TEMP(2,2,6,6-四甲基哌啶)、TEMPOL(2,2,6,6-四甲基哌啶-1-氧自由基)、D2O(氧化氘)均为分析纯,均购自于国药集团;PAA、H2O2储备液分别采用复合过氧乙酸消毒液(≥15.0%)和30%过氧化氢(≥30.0%)制备.
主要仪器:双数显恒温磁力搅拌器(HJ-2B,金坛区西城新瑞仪器厂);紫外可见分光光度计(UV2365,上海尤尼柯仪器有限公司);电子天平〔ME20E/02,梅特勒-托利多仪器(上海)有限公司〕;数控超声波清洗器(KQ3200DE,昆山市超声仪器有限公司);移液枪(BIO-DL,上海宝予德科学仪器有限公司);便携式pH计(PHS-3C,上海仪电科学仪器股份有限公司);电子自旋共振波谱仪(ER200-SRC,德国布鲁克公司).
1.2 试验方法
除特殊说明外,试验中所有用到的试剂储备液均由电阻率为18.25 MΩ·cm的超纯水配制而成. 配制浓度为80 mmol/L的过氧乙酸(PAA)溶液,需要在4 ℃ 的温度条件下避光保存;配制RhB目标染料溶液,储备浓度为20 mg/L;配制浓度为100 mmol/L的硫代硫酸钠溶液作为反应终止剂.
所有催化试验除特殊说明外,其余均在烧杯体系中进行. 试验步骤:①配制40 mL特定浓度的目标染料溶液;称取特定浓度对应的NaCl加入到反应容器中,并放置于磁力搅拌器连续搅拌,设置转速为600 r/min左右. ②量取特定浓度对应的氧化剂PAA加入到上述溶液中启动反应,开始计时;在预定的时间点(0、2、4、6、8、10 min)用移液枪将2 mL样品从反应溶液提取至含有过量的硫代硫酸钠(0.2 mL)终止剂的5 mL离心管并快速摇匀,从而达到迅速淬灭反应的目的. ③随后用紫外分光光度计在λ=554 nm处测定反应后溶液的吸光度,由于该反应体系为均相催化体系,可通过吸光度值进行污染物浓度换算,并对数据进行归一化处理,进而得出反应体系中对RhB的降解率,数据采集一般采用2次或多次平行的平均值(所有反应均在室温条件下进行,无特殊说明,溶液初始pH均未作调整).
2 结果与讨论
2.1 不同均相反应体系的氧化能力比较
为验证Cl-对PAA的活化作用,图1比较了单独PAA、单独Cl-、单独H2O2、Cl-/H2O2和Cl-/PAA不同体系降解RhB的效能. 有研究[19-20]表明单独使用PAA可直接选择性氧化氯酚和抗生素等有机污染物,但由于其选择性过高,无法有效去除大部分难降解有机物. 固定初始试验条件:RhB浓度为10 mg/L,PAA、H2O2投加量均为2.0 mmol/L,Cl-浓度为400 mmol/L. 如图1所示,单独的PAA或H2O2体系对RhB脱色几乎没有影响,该结果表明未经活化的氧化剂不具备对染料废水高效降解的效果. 此外,在Cl-/H2O2体系中,RhB在10 min内仅降解8.7%,说明Cl-不能作为H2O2有效的活化剂应用于RhB的降解. 而Cl-/PAA 体系中RhB在10 min内降解了96.2%,降解率远高于单独Cl-及单独PAA体系降解率之和,说明该体系并非两种体系的简单叠加态,而是该体系构建中的多角色耦合效应发挥作用,同时也排除了PAA溶液中共存的少量H2O2对Cl-/PAA体系的影响. 由此可初步验证,Cl-/PAA体系在降解RhB染料废水过程中的可行性和高效性.

注: C0为初始RhB浓度,mg/L; Ct为t时刻 RhB浓度,mg/L.下同.图1 不同反应体系对RhB的降解效果Fig.1 RhB removal in different reaction systems
2.2 均相Cl-/PAA体系降解RhB的影响因素研究
2.2.1PAA投加量的影响

PAA投加量/(mmol/L): 1—0.4; 2—0.8; 3—1.2; 4—1.6; 5—2.0.图2 Cl-/PAA体系中PAA投加量 对体系降解RhB的影响Fig.2 Effect of initial PAA dosages on the degradation of RhB in the Cl-/PAA system
固定初始RhB浓度为10 mg/L,Cl-浓度为400 mmol/L,PAA投加量为0.4、0.8、1.2、1.6和2.0 mmol/L时,RhB的降解曲线如图2所示. 由图2可知,反应10 min内,提高PAA的投加量可加快目标染料RhB的降解. 当PAA投加量从0.4 mmol/L增至0.8 mmol/L时,RhB的脱色率由65.9%提至95.8%,脱色效果显著提升. 继续增加PAA的投加量,在10 min 时脱色率基本保持不变,均在95%以上,当PAA投量为2.0 mmol/L时,RhB去除率为96.2%,降解速率达到最大. 为深入探究Cl-/PAA体系对染料的降解过程及反应特性,建立拟一级反应动力学模型〔见式(1)〕对Cl-活化PAA降解RhB的动力学过程进行模拟.
kobs=-ln(Ct/C0)/t
(1)
式中:C0为初始RhB浓度,mg/L;Ct为t时刻RhB浓度,mg/L;kobs为拟一级反应动力学模型速率常数,min-1.
由图3可知,RhB降解过程符合拟一级反应动力学规律. 当PAA投加量从0.4 mmol/L增至2.0 mmol/L,对应的kobs从0.090 min-1增至0.786 min-1(见表1). 高浓度的PAA有利于在单位时间内产生更多的活性物质作用于RhB,从而使降解率显著提高.
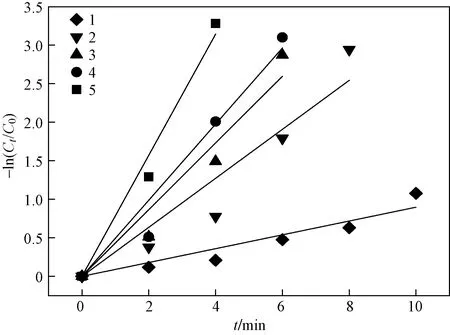
PAA投加量/(mmol/L): 1—0.4; 2—0.8; 3—1.2; 4—1.6; 5—2.0.图3 Cl-/PAA体系降解RhB的拟一级反应动力学Fig.3 Pseudo-first-order kinetics of RhB degradation process in the Cl-/PAA system
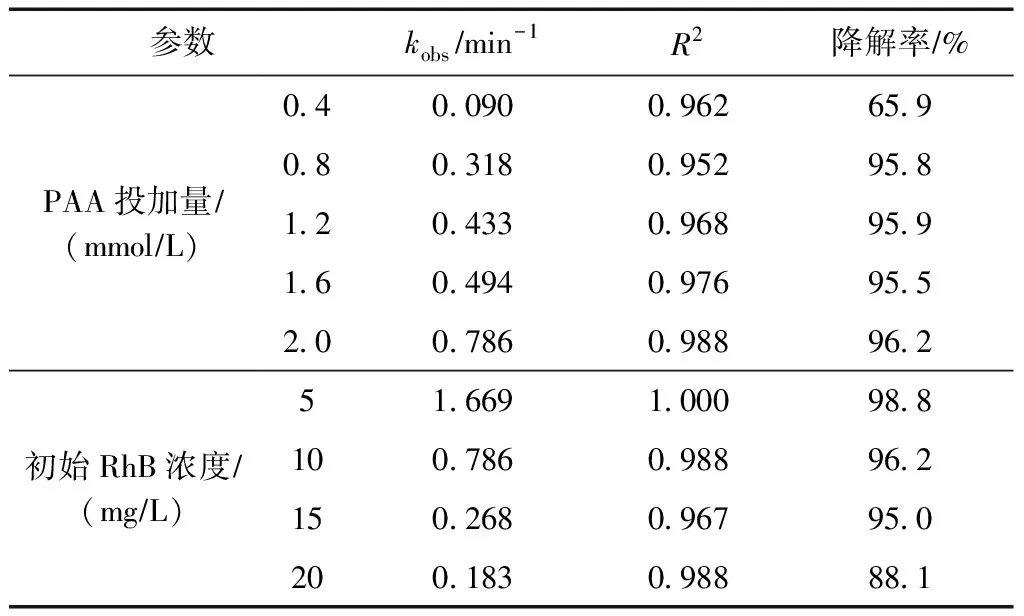
表1 RhB降解的拟一级反应动力学常数
2.2.2Cl-浓度的影响
固定初始RhB浓度为10 mg/L,PAA投加量为2.0 mmol/L,探究Cl-浓度对体系降解RhB的影响,试验结果如图4所示. 由图4可见,当Cl-浓度从12.5 mmol/L增至400 mmol/L时,体系中RhB的降解率明显提升,由14.8%增至96.2%,说明随着催化剂含量增加,染料的去除效果也逐渐增加. 而kobs也从0.018 min-1提至0.786 min-1,有力证明了Cl-可以作为激活PAA的一种有效的活化剂参与到相关高级氧化体系中. 值得注意的是,Cl-浓度为200 mmol/L和400 mmol/L时,RhB在10 min处降解率相差无几,分别为96.3%和96.2%,说明持续增加Cl-的量并不能对RhB的降解率发生显著变化,此时高浓度Cl-对RhB降解的促进主要表现在反应动力学方面. 结合Cl-浓度和PAA投加量梯度试验得出,在Cl-浓度与PAA投加量比例相差较大的情况下,单独增加反应体系中另一种试剂的量对RhB的降解率不会有明显的提升,在反应体系中,仅当催化剂Cl-和氧化剂PAA用量均处于最优范围内才能达到优良的降解效果. 综合考虑该试验中染料脱色效果、降解动力学及经济成本,将2.0 mmol/L PAA和400 mmol/L Cl-设置为Cl-/PAA反应体系的后续处理条件,用以开展后续试验.
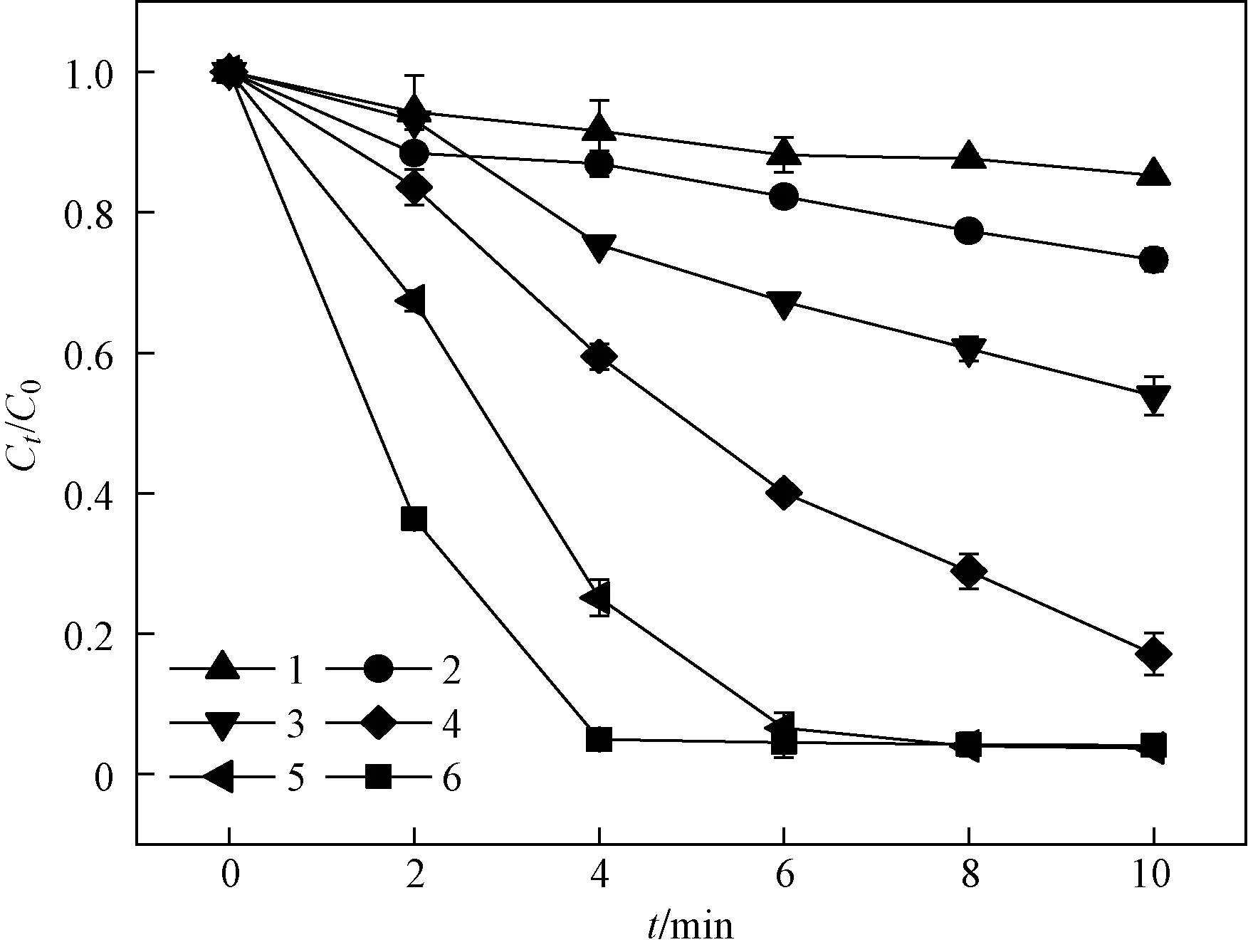
Cl-浓度/(mmol/L): 1—12.5; 2—25; 3—50; 4—100; 5—200; 6—400.图4 Cl-/PAA体系中Cl-浓度对RhB降解的影响Fig.4 Effect of initial Cl- loading on the degradation of RhB in the Cl-/PAA system
2.2.3初始染料浓度的影响
固定PAA投加量为2.0 mmol/L,Cl-浓度为400 mmol/L,考察初始染料浓度对RhB降解的影响,结果如图5所示. 由图5可见,初始染料浓度与染料的降解率均呈负相关. 在10 min内,当初始RhB浓度为5、10、15、20 mg/L时,RhB的降解率分别为98.8%、96.2%、95.0%、88.1%. 此外,如表1所示,kobs随着染料浓度的升高也呈现出逐渐降低的趋势. 表明随着单位体积溶液中染料分子数量的增多,这些过量的染料分子可能会与PAA活化生成的活性物质产生竞争效应. 具体来说,由于反应体系中氧化剂和活化剂的含量固定不变,产生的活性物质的数量也是定值,同时反应过程中染料本身产生的中间产物也会竞争有限的活性位点和功能基团,因此当处理更高浓度的RhB溶液时,脱色效果会随之下降. 在初始RhB浓度为5 mg/L条件下,RhB在反应开始前2 min内已基本完全降解,因反应过快,动力学特征不易归纳总结,同时不利于清晰研究该体系的内在机制. 此外,考虑到实际染料废水色度较高的特性,最终选择10 mg/L作为Cl-/PAA体系中设定的初始染料浓度.
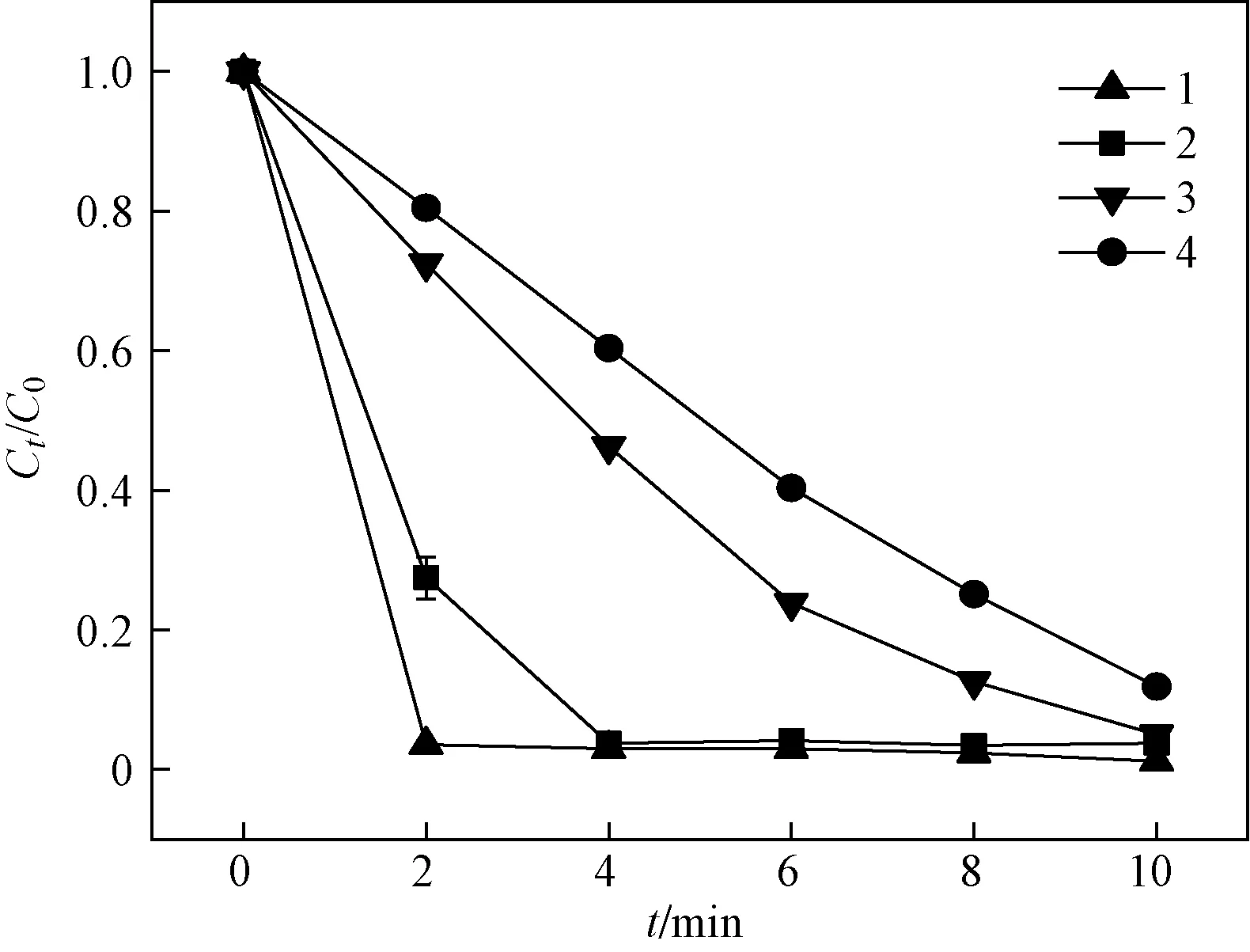
初始RhB浓度/(mg/L): 1—5; 2—10; 3—15; 4—20.图5 Cl-/PAA体系中初始染料浓度对RhB 降解的影响Fig.5 Effect of initial pollutant concentration on the degradation of RhB in the Cl-/PAA system
2.2.4溶液初始pH对RhB降解的影响
染料废水成分复杂且其pH范围波动较大[21],pH是影响污水处理效果的关键性因素之一. 为研究Cl-/PAA体系对溶液pH是否具有依赖性,设置5.0、7.0、9.0三个初始pH分别对酸性、中性、碱性染料废水进行模拟,用H2SO4和NaOH对溶液pH进行调整,初始pH对RhB降解的影响如图6所示. 由图6 可见,Cl-/PAA体系溶液对初始pH适应度较高,说明该体系的酸碱耐受性较强. 当调整RhB溶液的初始pH分别为5.0、7.0、9.0时,染料去除率分别为94.6%、96.2%和94.9%. 在碱性条件下,PAA多以阴离子的形态存在〔见式(2)〕,这可能会影响到PAA部分活性. 相较于中性条件,初始pH=5及pH=9条件下的RhB降解受到轻微的抑制,但影响效果相当微弱. 较低或较高的溶液初始pH对Cl-/PAA体系降解RhB的抑制影响可忽略不计. 在实际染料的处理中无需额外投加酸碱药品对废水pH进行预调节,具有高效且环保的优点.
CH3C(O)OOH+H2O→CH3C(O)OO-+H3O+
(pKa=8.2)
(2)

初始pH: 1—5.0; 2—7.0; 3—9.0.图6 Cl-/PAA体系中初始pH 对RhB降解的影响Fig.6 Effect of initial pH value on the degradation of RhB in the Cl-/PAA system
2.3 催化机理研究
2.3.1自由基捕获试验研究
首先对Cl-/PAA体系中溶液可能产生的各种活性自由基进行研究,从而初步验证在降解RhB过程中占主导地位的活性物质. 采用自由基捕获剂的方法来分析Cl-/PAA反应体系降解RhB的催化机理. TBA是一种常用的·OH捕获剂,可以和·OH发生脱氢反应〔k=6.0×108L/(mol·s)〕,而对有机自由基无淬灭影响,用于评价·OH的贡献[22]. 2,4-HD对乙酰氧基及乙酰过氧基有淬灭作用,可用于区分·OH和有机自由基对有机污染物降解的作用[23]. PBQ和TEMPOL均是优良的超氧自由基捕获剂,对苯醌在反应中被氧化为对苯酚,用以检验·O2-[24].1O2在D2O中的寿命是在H2O中的10倍,因此可以通过对D2O和H2O溶剂交换加强1O2的作用以验证其是否存在[25]. MeOH除可捕获·OH〔k=9.7×108L/(mol·s)〕,还可与CH3C(O)O·等基团发生反应,最终被氧化为甲醛. 在试验设定的处理条件下,添加10 mmol/L的捕获剂对RhB降解的影响如表2所示.
由表2可知,TBA、2,4-HD、TEMP、FFA、MeOH的加入明显抑制了RhB的降解,降解率从96.2%分别降至15.3%、6.0%、17.6%、4.5%、3.7%,而PBQ和TEMPOL的影响相当有限,对应的降解率分别为81.3%和92.0%. 值得注意的是,D2O替代试验中RhB的降解效果与空白组相差无几,这一结果与1O2捕获试验得到的结果存在一定的差异,1O2在RhB降解中的作用仍不明晰,可能是反应体系中的1O2增强有限或D2O使用量不足导致. 通过自由基捕获试验可初步得出结论,在Cl-/PAA体系中,促进RhB降解过程中占主导地位的活性物质可能包括·OH、CH3C(O)O·(乙酰氧基)、CH3C(O)OO·(乙酰过氧基)、1O2,但这些活性物质的具体影响及·O2-的作用有待进一步验证.

表2 Cl-/PAA体系中捕获剂对RhB降解的影响
2.3.2电子自旋验证
通过活性物质捕获试验中初步推断了Cl-/PAA体系中促进RhB降解的3种可能活性基团. 为进一步验证反应体系中起主导作用的自由基物质,结合ESR自旋捕获测试更为直观地检测反应中的活性物质. 将一定量的Cl-分别溶于水和甲醇中,绘制的ESR谱图如图7所示.

图7 不同反应体系的ESR谱图Fig.7 ESR spectra of radical adducts indifferent reaction systems
图7(a)中的波谱中未检测到DMPO-·OH和DMPO-·O2-的特征信号(分别为四重和六重峰)[26],说明在Cl-/PAA体系中 ·OH和 ·O2-并非主要的活性物质,·OH未被检测到的原因也可能是Cl-会与·OH反应生成氧化性较低的产物[27]. 而图7(b)中可观察到TEMP-1O2的特征图谱(三重峰)[28],表明Cl-/PAA 体系中1O2是起主要作用的活性物质,ESR试验结果与自由基捕获试验的结论相吻合. 综合分析捕获试验和ESR试验结果,确定R-O·(有机自由基)和1O2(单线态氧)是Cl-/PAA体系中促进RhB降解的主要活性物质,可能的反应见式(3)~(7):
CH3C(O)OOH→CH3C(O)O·+·OH
(3)
CH3C(O)O·→·CH3+CO2
(4)
·CH3+O2→CH3OO·
(5)
CH3C(O)O·+ CH3C(O)OOH→
CH3C(O)OO·+ CH3C(O)OH
(6)
CH3C(O)OOH+ CH3C(O)OO-→
CH3C(O)OH+ CH3C(O)O-+1O2
(7)
结合自由基捕获试验及ESR测试分析可知,PAA可被Cl-活化产生CH3C(O)O·、CH3C(O)OO·等R-O·及1O2,而溶液中大量存在的Cl-可能会发生次生反应被氧化形成如HClO、Cl·等活性氯物质,以上活性物质可同时攻击RhB的发色基团并使其实现快速脱色降解,直至将大分子污染物降解为小分子物质或直接矿化成CO2和H2O.
2.3.3氧化剂利用效率研究
为研究Cl-/PAA体系中氧化剂的利用效率,在设定处理条件下进行连续4次重复性试验来分析RhB的去除效果. 反应时间均设置为10 min,在前一次试验结束后,需补充母液使后一次试验中初始染料浓度和总体积保持不变,以保证前后试验的统一性. 只投加污染物,不重复性投加氧化剂和催化剂,RhB的降解曲线如图8所示. 由图8可知,相较于第1次降解,后3次试验中RhB的降解率逐渐降低,第2次的降解率略有下降,而后两次试验的降解率均小于50%. 试验结果表明,在不额外添加催化剂的情况下,PAA被活化后产生的活性物质在10 min内未被完全消耗,可继续作用于污染物的降解,污染负荷和降解产物的累积会使得染料的再次降解率下降,但在不持续投加催化剂和氧化剂投加的情况下,该体系还是可以维持几次循环. 在10 min反应结束后溶液中残余的活性物质相对较少,在无额外投加下虽活性减弱,但该体系中氧化剂仍可持续性进行多次高效利用.

图8 Cl-/PAA体系中RhB在循环 试验中的降解率Fig.8 Degradation of RhB in the Cl-/PAA system in cyclictests
为探究Cl-/PAA反应体系中氯离子的催化活性,以10 min为一个催化反应周期,在每次循环结束后,补充母液使初始染料浓度和总反应体积保持不变,并再次添加2.0 mmol/L PAA用以启动下一循环,在无额外添加催化剂Cl-的情况下,重复以上循环试验4次来解析RhB的降解率(见图9). 由图9可见,4次连续性循环试验中RhB去除率均维持在较高水平,由第1次反应的97.8%分别转至91.7%、95.0%及90.8%,呈现出先降后升再降的趋势,但都维持在90%以上. 脱色率降低是由于在取样过程中会同时将部分氯离子取出的原因而导致. 而由图8可知,氧化剂在10 min反应后仍然在体系中保持一定的活性,重复试验过程中添加氧化剂可因其本身而产生累积效应,这可能是反应活性有略微升高的原因. 试验结果表明,Cl-/PAA反应体系中剩余PAA可实现多次高效利用,Cl-/PAA体系的良好稳定性也肯定其在实际废水净化中的应用潜能.
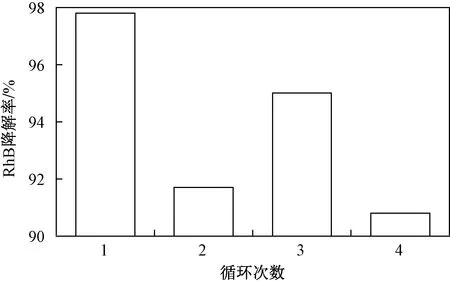
图9 持续投加PAA情况下Cl-/PAA体系中 RhB在循环试验中的降解率Fig.9 Degradation efficiency of RhB in the Cl-/PAA system with the addition of PAA in cyclic tests
2.4 实际废水中应用潜能研究
2.4.1共存阴阳离子对RhB降解的影响
无机盐离子在实际废水中的存在是影响反应动力学及降解率的重要因素,研究共存离子的影响有利于发掘Cl-/PAA体系在实际废水中的应用价值. 向反应溶液中添加10 mmol/L的常见共存无机盐离子,其中,所有阳离子投加过程中皆投加对应的氯盐,其对RhB去除的影响见表3.

表3 添加阴(阳)离子后Cl-/PAA体系中RhB 在10 min处的降解率
阳离子Fe3+的加入可以加速对RhB的降解,Fe3+可与H2O2反应,但反应速率常数〔kapp为0.001~0.01 L/(mol·s)〕要低得多,可生成HO2·〔见式(8)〕[29],因此推测PAA和Fe3+可能存在类似的反应〔见式(9)〕,在反应过程中可能加速有机自由基的产生,同时在复合体系中也可能加速Fe3+与Fe2+之间的循环〔见式(10)〕,进而加速对污染物降解进程. K+的加入对染料的降解有着一定的抑制效果(约为20%),可能是K+会竞争有限的活性位点,而Mn2+加入对染料的降解无明显影响.
H2O2+Fe3+→HO2·+Fe2++H+
(8)
CH3C(O)OOH+Fe3+→
CH3C(O)OO·+Fe2++H+
(9)
CH3C(O)OOH+Fe2+→
CH3C(O)O·+Fe3++OH-
(10)
结合分析不同阴离子化合物的添加,得出阴离子的抑制程度为SO42- 2.4.2不同水源对RhB降解的影响 选取自来水和反渗透水两种水源作为溶剂配制RhB溶液进行试验,以分析Cl-/PAA体系可能受到外界因素的影响. 自来水取自重庆大学内部供水系统,反渗透水取自超纯水机. 自来水中包含用漂白粉和消毒剂(Cl2、NaClO等)处理后剩余的Cl-和ClO-、自然水体中本身含有的部分Ca2+、Mg2+、K+及SO42-等微量矿物质以及管道和水龙头带入的微量杂质(铅、铜等). 反渗透水通过反渗透膜过滤,能够去除水体中95%以上以离子态存在的杂质,通常作为超纯水制备的水源. 超纯水中电导率和含盐量都处于极低的水平,可近似忽略不计. 不同水源对Cl-/PAA体系中RhB降解的影响见图10. 由图10可知,RhB在自来水和反渗透水介质中的降解率相较于超纯水分别下降了2.81%和2.89%,但均在93.0%以上,原因可能是自来水和反渗透水中的微量元素会与反应中的主要活性物质发生反应,从而极少量相对抑制了RhB的去除,但也几乎可忽略不计. 总体上来看,RhB降解率受到配水影响很小,证明了Cl-/PAA体系在实际染料废水的去除中具有良好的应用潜能. 图10 Cl-/PAA体系中采用不同水源时 RhB的降解率Fig.10 Degradation efficiency of RhB in the Cl-/PAA system using various water resources a) Cl-/PAA体系具有较好的催化性能和降解动力学,其对RhB的降解过程符合拟一级反应动力学模型. b) RhB降解率随PAA投加量、Cl-浓度的升高而升高,随初始RhB浓度的升高而降低. 当PAA投加量为2.0 mmol/L、Cl-浓度为400 mmol/L、初始RhB浓度为10 mg/L时,反应10 min RhB降解率即达到96.2%. c) Cl-/PAA体系中产生的CH3C(O)O·、CH3C(O)OO· 及1O2等活性物质对RhB发色基团的攻击是其实现高效降解的主要动力. 母液循环试验初步验证反应过程中剩余PAA可实现多次高效利用,同时Cl-也保持较高的催化活性. d) 向体系中投加无机盐离子,阳离子投加中,Fe3+对RhB降解有促进作用,K+对染料降解轻微抑制. 而阴离子投加的抑制程度表现为NO2-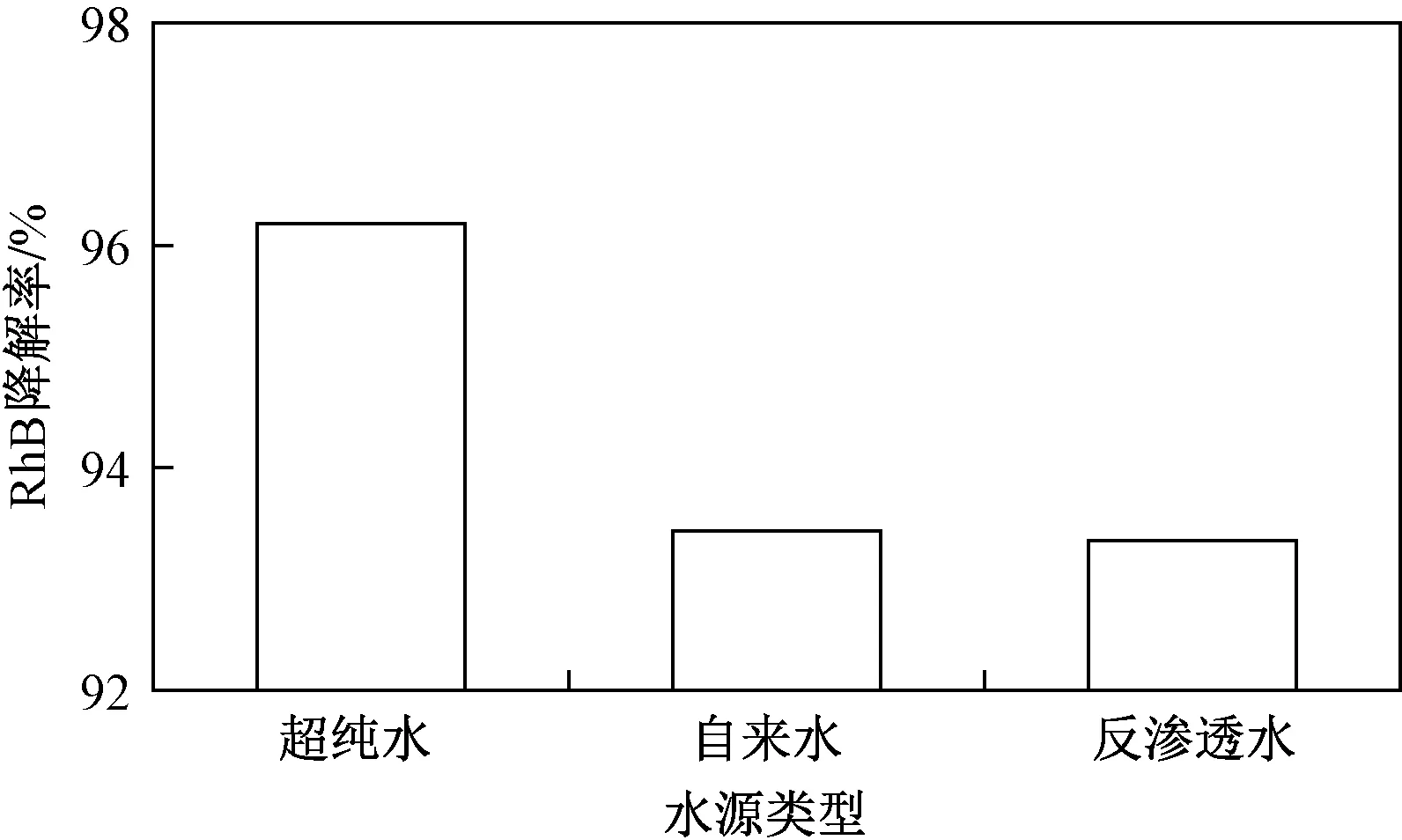
3 结论
