miR-7155-3p在乳腺癌患者血清中的表达及对乳腺癌细胞增殖和侵袭的影响
2021-12-20黄玉琴张玉毅许乃寒
呙 月,黄玉琴,张玉毅,许乃寒,胡 波
(湖北医药学院附属襄阳市第一人民医院 肿瘤科,湖北 襄阳 441000)
乳腺癌是全球女性最常见的恶性肿瘤之一,其发病率呈逐年增加的趋势,严重危害女性身体健康[1]。手术切除、放疗、化疗、内分泌治疗是乳腺癌的主要治疗方式,大多数乳腺癌患者的预后较好,然而仍有部分晚期患者的治疗效果很差[2-3]。探究新的诊断标志物和治疗靶点对提供全球乳腺癌诊疗水平具有重要意义。微小 RNA(microRNA,miRNA)是一类由19至26个核苷酸构成的非编码单链RNA,通过与下游靶基因的信使RNA(mRNA)3’非翻译区互补配对,降解靶基因mRNA或直接抑制其翻译[4]。miRNA是近年来细胞生物学研究的热点,通过影响肿瘤细胞的生长和转移等病理过程,参与调控恶性肿瘤的发生、发展[5]。miR-7155-3p是一个新发现的miRNA,仅有研究表明miR-7155-3p在急性心肌梗死患者血清中异常低表达[6]。miR-7155-3p在肿瘤特别是乳腺癌中的表达、功能及作用机制尚未明确。本研究旨在观察miR-7155-3p在乳腺癌患者血清及乳腺癌细胞系中的表达,探讨其对乳腺癌细胞增殖和侵袭的影响及其作用机制,为乳腺癌的分子诊断和基因靶向治疗提供一定的实验依据。
1 材料与方法
1.1 临床标本 收集2018年9月至2019年5月本院住院的乳腺癌患者40例,术前采集静脉血,所有患者术后均经病理检查确诊为乳腺浸润性导管癌,术前均未进行放疗、化疗药物治疗。40例乳腺癌患者按TNM分期为Ⅰ期9例、Ⅱ期14例、Ⅲ期15例、Ⅳ期2例。选取体检健康女性40例,采集静脉血。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 细胞与试剂 乳腺癌细胞系MCF7、HCC1937、MB-MDA-468、SKBR3和人永生化正常乳腺上皮细胞MCF-10A购于美国ATCC细胞库;RPMI-1640培养基、DMEM/F12培养基及胎牛血清购于美同Hyclone公司;Lipofectamine 3000购于美国Invitrogen公司;双荧光素酶报告实验试剂盒购于美国Promega公司;Transwell小室购于美国Millipore公司;野生型TRIB1基因3′端非翻译区荧光素酶质粒及其突变型质粒购于美国Promega公司;聚合酶链反应(Real-time PCR,RT-PCR)试剂盒购于武汉博士德生物工程有限公司;miR-NC(阴性对照序列)和miR-7155-3p 模拟物由上海吉凯生物工程有限公司合成;MTT试剂盒购于上海碧云天生物科技有限公司;Matrigel基质胶购于美国BD公司;抗体(β-Tubulin、TRIB1、p-Ras、p-Raf、p-MEK、p-ERK1/2)购于美国CST公司。
1.3 细胞培养与转染 MCF7、HCC1937、SKBR3接种于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基,MB-MDA-468、MCF-10A接种于含10%胎牛血清、100 U/L青霉素、100 U/mL链霉素的DMEM/F12培养基,在37°C 5% CO2培养箱中进行培养。由于miR-7155-3p在SKBR3细胞中表达最低,取对数生长期的SKBR3细胞接种于6孔板,待细胞融合度为40%~60%时,按Lipofectamine 3000说明书配制转染体系,分别转染miR-NC和miR-7155-3p模拟物,命名为miR-NC组和miR-7155-3p组。转染8 h后更换为新鲜培养基。
1.4 RT-PCR检测miR-7155-3p和TRIB1的表达 Trizol法提取血清和细胞中总RNA,采用紫外分光光度计检测RNA纯度和浓度,取500 ng总RNA逆转录为cDNA。按试剂盒说明书,配制RT-PCR反应体系。分别以GAPDH和U6为内参,检测TRIB1和miR-7155-3p的表达。miR-7155-3p上游引物:5’- GGTCTGAGGTCTTGGG-3’,下游引物:5’-CAGTGCGTGTCGTGGAGT-3’。β-Tubulin上游引物:5’-TGGTGGACTTAGAGCCAGG-3’,下游引物:5’-CCCTTTCGCCCAGTTGTTC-3’。U6上游引物:5’-CTCGCTTCGGCAGCACA-3’,下游引物:5’-AACGCTTCACGAATTTGCGT-3’。TRIB1上游引物:5’-GCTGCAAGGTGTTTCCCATTA-3’,下游引物:5’- TCCCCAAAGTCCTTCTCAAAGA-3’。设定扩增条件:95 ℃变性5 min、95 ℃ 10 s、60 ℃ 25 s、70 ℃ 25 s,40个循环。采用2-ΔΔCt法进行计算。
1.5 生物信息学软件预测及双荧光素酶报告实验验证 采用生物信息学软件miRTarBase和miRDB预测,miR-7155-3p的下游靶基因可能是TRIB1。将对数生长期SKBR3细胞接种于6孔板,随机分为4组:野生型+miR-NC组(转入野生型质粒+miR-NC)、野生型+miR-7155-3p组(转入野生型质粒+miR-7155-3p)、突变型+miR-NC组(转入突变型质粒+miR-NC)、突变型+miR-7155-3p组(转入突变型质粒+miR-7155-3p)。采用双荧光素酶报告实验试剂盒检测每组萤火虫荧光素酶活性和海肾荧光素酶活性,以两者的比值代表相对荧光素酶活性。
1.6 Western blot 收集转染72 h的SKBR3细胞,采用RIPA裂解液裂解,检测蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,硝酸纤维素膜转膜,封闭液在室温下封闭。以1∶1 000稀释相应一抗,在4 °C下孵育过夜。以1∶5 000稀释相应二抗,在室温下孵育。滴加ECL显影液,在凝胶成像系统中曝光显影。
1.7 MTT检测SKBR3细胞增殖能力 收集转染72 h的SKBR3细胞,接种到新的96孔板。MTT检测时,加入50 μL/孔 MTT试剂,培养箱中培养4 h。加入150 μL/孔二甲基亚砜,摇床振荡,采用酶标仪检测在470 nm处每孔的吸光度(A)值。每天检测1次,连续检测5次。实验重复4次。
1.8 Transwell侵袭实验检测SKBR3细胞侵袭能力 采用不含血清的培养基稀释Matrigel基质胶,加入100 μL/孔包被Transwell小室上室面,培养箱内凝固后放入24孔板。收集转染72 h的SKBR3细胞,采用不含血清的培养基调整细胞密度(4×106个/mL),接种3×104个细胞至小室上室,24孔板每孔加入500 μL含血清的培养基。培养箱中培养24 h后,采用甲醇固定10 min,0.1%结晶紫染色10 min,棉签擦去上室面多余细胞,冲洗多余染色。在100倍倒置显微镜下观察、计数穿膜细胞数,实验重复4次。

2 结果
2.1 miR-7155-3p在乳腺癌患者血清中的表达 RT-PCR结果显示,乳腺癌患者血清和正常人血清中miR-7155-3p表达量分别为(1.03±0.17)和(4.99±0.67)。与正常人血清相比,乳腺癌患者血清中miR-7155-3p的表达明显降低(见图1)。

*:与正常人血清相比,P<0.01。 图1 miR-7155-3p在乳腺癌患者血清和正常人血清中的表达
2.2 miR-7155-3p在乳腺癌细胞系中的表达 RT-PCR结果显示,与MCF-10A细胞相比,乳腺癌细胞系中miR-7155-3p的表达较低。SKBR3细胞中miR-7155-3p的表达最低,故选择SKBR3细胞进行研究(见图2)。
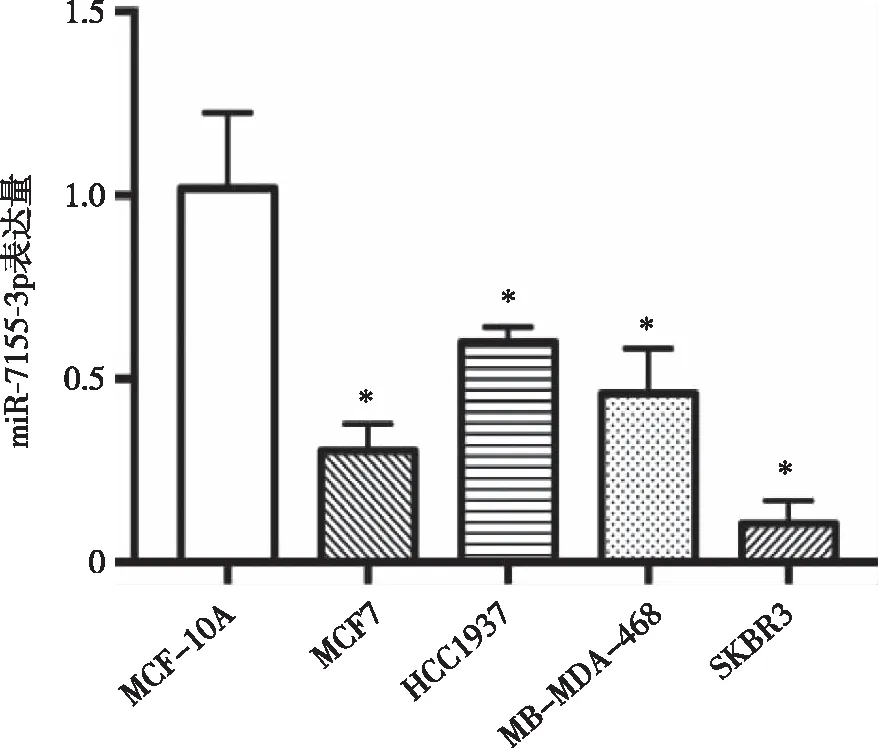
*:与MCF-10A细胞相比,P<0.01。 图2 miR-7155-3p在乳腺癌细胞和正常乳腺上皮细胞中的表达
2.3 RT-PCR检测转染后miR-7155-3p的表达 RT-PCR的结果表明,miR-7155-3p组乳腺癌SKBR3细胞中miR-7155-3p的表达水平(8.52±1.96)明显高于miR-NC组(1.08±0.23),提示外源性miR-7155-3p在SKBR3细胞中成功表达。
2.4TRIB1基因3’非翻译区与miR-7155-3p配对序列 采用生物信息学软件miRTarBase和miRDB预测,miR-7155-3p的下游靶基因可能是TRIB1。如图3,miR-7155-3p种子区存在与TRIB1基因mRNA的3’非翻译区互补配对的序列。
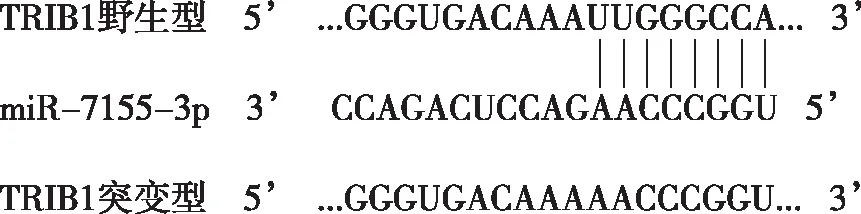
图3 miR-7155-3p与 TRIB1 3′UTR互补配对的序列
2.5 双荧光素酶报告实验 与野生型+miR-NC组相比,野生型+miR-7155-3p组相对荧光素酶活性较低(见图4),表明miR-7155-3p可有效抑制野生型质粒荧光素酶活性。因此,miR-7155-3p可有效与野生型质粒3′-UTR区结合。

A:野生型+miR-NC;B:野生型+miR-7155-3p;C:突变型+miR-NC;D:突变型+miR-7155-3p;*:与野生型+miR-NC相比,P<0.01。图4 双荧光素酶报告实验
2.6 RT-PCR检测转染后TRIB1的表达 RT-PCR的结果表明,miR-7155-3p组乳腺癌SKBR3细胞中TRIB1的表达水平(0.31±0.07)明显低于miR-NC组(1.02±0.14),表明miR-7155-3p可下调SKBR3细胞中TRIB1的表达。
2.7 miR-7155-3p对乳腺癌SKBR3细胞TRIB1及MAPK信号通路蛋白表达的影响 Western blot结果显示(见图5),与miR-NC组相比,miR-7155-3p组的TRIB1表达水平降低,MAPK信号通路蛋白p-Ras、p-Raf、p-MEK、p-ERK1/2蛋白表达水平降低。
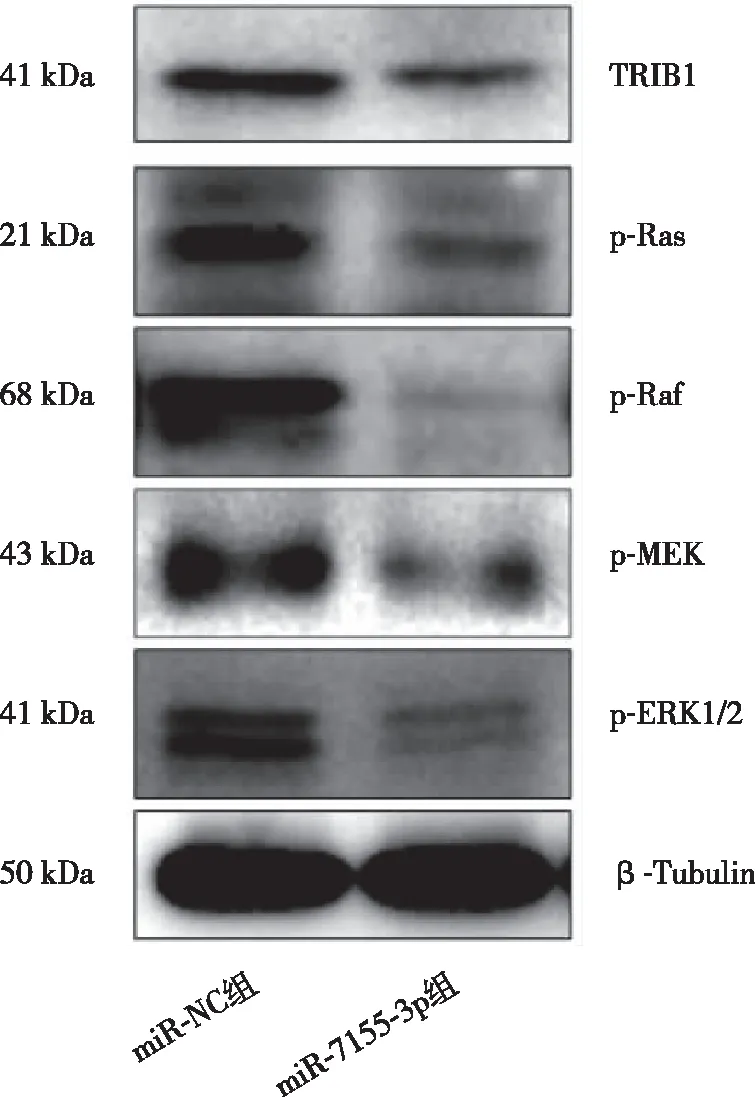
图5 转染miR-7155-3p对乳腺癌SKBR3细胞中TRIB1及MAPK信号通路蛋白表达的影响
2.8 miR-7155-3p对乳腺癌SKBR3细胞增殖的影响 MTT法检测结果显示(见图6),与 miR-NC组相比,miR-7155-3p组的SKBR3细胞增殖活力明显降低。
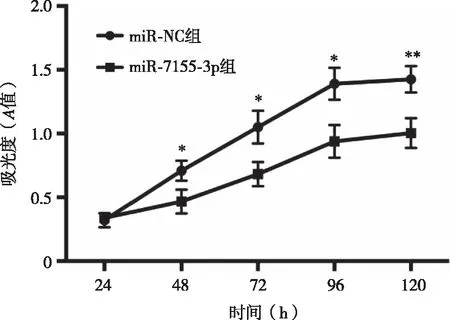
*:与miR-NC组相比,P<0.05;**:与miR-NC组相比,P<0.01。 图6 转染miR-7155-3p对乳腺癌SKBR3细胞增殖的影响
2.9 miR-7155-3p对乳腺癌SKBR3细胞侵袭的影响 由图7可见,miR-7155-3p组穿透滤膜的细胞数(31.49±7.60)个明显少于转染miR-NC组穿透滤膜的细胞数(80.14±8.92)个。Transwell实验的结果显示过表达miR-7155-3p可抑制乳腺癌细胞SKBR3的侵袭能力。
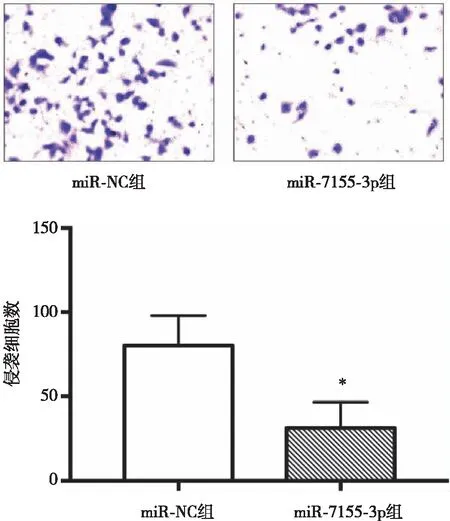
*:与miR-NC组相比,P<0.01。 图7 转染miR-7155-3p对乳腺癌SKBR3细胞侵袭的影响
3 讨论
miRNA 在肿瘤细胞中的异常表达与肿瘤的发生、发展显著相关,参与肿瘤生长、转移、血管生成等多种病理过程,miRNA为肿瘤的分子诊断、靶向治疗提供了新的方向[7-8]。越来越多的miRNA被证明在乳腺癌中表达上调或下调,起着“癌基因”或“抑癌基因”的作用[9-11]。You等[12]研究报道,miR-106a在乳腺癌组织中异常高表达,上调miR-106a可显著增强乳腺癌细胞的增殖、迁移和侵袭能力,同时miR-106a过表达可显著降低乳腺癌细胞对顺铂的敏感性。Zhang等[13]研究报道,在体内和体外实验中,上调miR-135b-5p均可增加乳腺癌细胞对阿霉素的敏感性。Huang等[14]研究报道,miR-370在乳腺癌中异常高表达,且其表达水平与乳腺癌患者的预后不良有关,miR-370可促进乳腺癌细胞的生长。miR-7155-3p作为一种新发现的miRNA,在急性心肌梗死患者血清中异常低表达,血清中miR-7155-3p的表达模式可能对疾病的诊断具有一定的指导意义[6]。miR-7155-3p在乳腺癌中的研究尚未见报道。
本研究结果表明,与健康人血清相比,miR-7155-3p在乳腺癌患者血清中明显低表达,提示miR-7155-3p可能在乳腺癌中具有分子诊断标志物价值。与正常乳腺上皮细胞相比,miR-7155-3p在乳腺癌细胞系中明显低表达,提示miR-7155-3p可能参与乳腺癌的发生、发展。采用生物信息学软件miRTarBase和miRDB预测,miR-7155-3p的下游靶基因可能是TRIB1,miR-7155-3p种子区存在与TRIB1基因mRNA的3’非翻译区互补配对的序列。TRIB1是一种Tribbles同源蛋白,包含N端结构域、C端结构域和中心假激酶结构域[15]。TRIB1具有激酶活性,参与调解多种信号通路的转导[16]。TRIB1在包括结直肠癌、前列腺癌、在内的多种恶性肿瘤中异常高表达,作为癌基因显著促进肿瘤细胞的生长和转移[17-18]。TRIB1的异常高表达可促进乳腺癌细胞的增殖,与乳腺癌患者的不良预后显著相关[19]。双荧光素酶报告实验进一步证明,miR-7155-3p可与TRIB1基因mRNA的3′ 非翻译区互补配对。RT-PCR和Western blot显示,在乳腺癌细胞SKBR3中上调miR-7155-3p后,TRIB1基因表达降低,表明miR-7155-3p可抑制TRIB1基因的表达。丝裂原活化蛋白激酶(MAPK)信号通路在乳腺癌细胞增殖和侵袭等过程中发挥重要作用[20]。Western blot显示,乳腺癌细胞SKBR3中TRIB1基因表达降低后,MAPK信号通路蛋白如p-Ras、p-Raf、p-MEK、p-ERK1/2表达降低,提示乳腺癌细胞MAPK信号通路被阻滞。MTT实验和Transwell实验进一步证明,miR-7155-3p过表达可明显抑制SKBR3细胞的增殖和侵袭能力。
综上所述,miR-7155-3p在乳腺癌患者血清和细胞系中表达显著降低,miR-7155-3p可能通过靶向下调TRIB1的表达,阻滞MAPK信号通路,抑制乳腺癌的增殖和侵袭能力。miR-7155-3p可能在乳腺癌分子诊断和基因靶向治疗中具有一定的研究意义。
