药用植物巴西吐根的引种繁殖及栽培初探
2021-12-18严珍岳建军马小军何金荣张丽霞杨春勇
严珍 岳建军 马小军 何金荣 张丽霞 杨春勇

摘 要: 吐根作为治疗痢疾的特效药而著名,主要具有祛痰、催吐和抗阿米巴痢疾的作用。我国目前对吐根药材的需求全部依赖于进口,国内未有大规模种植,为此,该文对原产巴西的吐根进行了引种繁殖及栽培研究。结果表明:(1)云南省西双版纳傣族自治州景洪市的气候条件能满足吐根的正常生长发育的需求,可作为吐根的引种地。(2)吐根的分根和茎下段可用于扦插繁殖,其發根率和存活率分别100.0%和100.0%、68.0%和75.0%,前者优于后者。(3)用20 mg·L-1的IAA或IBA浸泡1 h,吐根茎下段的扦插成活率为90.0%或88.0%,均显著高于对照,可用于提高吐根茎下段的扦插成活率。(4)采用分根繁殖的吐根植株在植株生长和药材外观性状较好,单株总根体积较高,吐根一年生植株平均株高为10.66 cm,两年生平均株高为16.54 cm,一年生植株根总体积为2.71 mL,两年生根总体积为3.54 mL。(5)吐根栽培基质可用腐殖土∶椰糠体积比为4∶1。(6)在吐根的年周期生长中,地径1—3月和9—11月增长明显,株高7—11月增长明显,叶片长和宽3—9月增长明显,根据这些特点,可科学制定相应的水肥管理措施。该研究结果可为吐根的引种繁殖和栽培提供一定的科学参考。
关键词: 吐根, 引种, 繁殖, 栽培, 年生长动态
中图分类号: Q945.5
文献标识码: A
文章编号: 1000-3142(2021)11-1889-08
Introduction, propagation and cultivation technique of medicinal plant Cephaelis ipecacuanha
YAN Zhen1, YUE Jianjun2, MA Xiaojun1,3*, HE Jinrong4, ZHANG Lixia1, YANG Chunyong1
( 1. Institute of Medicinal Plant Development Yunnan Branch, Chinese Academy of Medical Sciences and Peking Union Medical College, Key Laboratory of Dai and Southern Medicine of Xishuangbanna Dai Autonomous Prefecture, Jinghong 666100, Yunnan, China; 2. School of Traditional Dai-Thai Medicine, West Yunnan University of Applied Sciences, Jinghong 666100, Yunnan, China; 3. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China; 4. Ningbo PFAFFia Food Co., Ltd., Ningbo 315000, Zhejiang, China )
Abstract: Cephaelis ipecacuanha has a wide reputation as a specific medicine for amebic. The roots of C. ipecacuanha are the sources for an expectorant, emetic and amoebacide. At present, this plant has not been grown on a large scale in China, and its demand mainly depends on imports. To solve the problem, the introduction, propagation and cultivation technique of C. ipecacuanha were studied. The results were as follows: (1) Jinghong City, Yunnan Province, China could be used as an introductory place, and its climatic indexes could meet the needs of this plant normal growth and development. (2) C. ipecacuanha was propagated by root or bottom stem cutting, and rooting and survival rates of Brazilian ipecac by the former (100.0% and 100.0%) were better than that of the latter (68.0% and 75.0%). (3) The bottom stem cutting treated with IAA or IBA (20 mg·L-1+1 h) could be used to improve cutting survival rate of Brazilian ipecac, and survival rate of the treated group had significantly better values (90.0% or 88.0%) than that of control group. (4) C. ipecacuanha propagated by root cutting had good growth, appearance and total root volume. Plant height of one-year-old and two-year-old root cuttings were 10.66 and 16.54 cm, respectively. The corresponding total root volume were 2.71 and 3.54 mL, respectively. (5) The forest humic soil∶coconut chaff=4∶1 (Volume rate) was used as culture substrates of C. ipecacuanha. (6)During the annual growth trend of the above-ground of C. ipecacuanha, the ground diameter obviously increased from January to March and from September to November, the plant height obviously increased from July to November and the leaf length and leaf width obviously increased from March to September. According to these features, the corresponding cultivation techniques of soil water and nitrogen fertilizer can be managed scientifically. The results of this study can provide a certain scientific reference for the introduction, propagation and cultivation of C. ipecacuanha.
Key words: Cephaelis ipecacuanha, introduction, propagation, cultivation, annual growth trend
吐根为茜草科植物Cephaelis ipecacuanha或C. acuminata的干燥根,原产于巴西,1648年被从巴西引入欧洲,作为治疗阿米巴痢疾的特效药而著名,是世界天然药物市场上重要和知名的草药之一。吐根具有祛痰和催吐等作用(Smith & Smith,1961;Jha et al.,1988),在巴西国家药典、美国药典、日本药方局和欧洲药典等均有收录(李庆华,1957;SJP, 2006;USPC, 2009;EPC, 2010)。吐根的主要活性成分为生物碱类,如吐根酚碱和吐根碱(Jha S & Jha TB, 1989;Yoshimatsu & Shimomura, 1991;孙磊等,2012;王超等,2013),可能对新型冠状病毒肺炎(COVID-19)和严重急性呼吸综合征(SARS)等由病毒引起的咳嗽和痰多症状有改善,具有临床应用的潜在价值。目前,国外已在吐根的种苗组培快繁(Ideda et al., 1988;Jha et al., 1988;Teshima et al., 1988;Jha S & Jha TB, 1989;Rout et al., 2000)、栽培技术(German, 1991; Rodriguez & Blanco, 2016)、生长调控(Yoshimatsu & Shimomura, 1991;Isogai et al., 2008)、种质资源保护(Chaudhuri & Jha, 2008;De Oliveira et al., 2010)、生殖发育(Souza et al., 2003, 2006)和根活性成分分离(Itoh et al., 1991)等方面进行了一些研究,以促进吐根的栽培应用。如对吐根组织培养技术已有较多探索,Jha S & Jha TB(1989)报道了利用吐根的芽尖和节点等外植体进行组培,Yoshimatsu & Shimomura(1991)以及Yamuna et al.(1993)研究发现可以用吐根节间段进行组培,而Yoshimatsu & Shimomura(1994)介绍了用吐根根部切段进行组培的方法,然而,这些研究获得的组培苗均未完成田间阶段的系统试验。
长期以来,我国制药企业对吐根药材的需求全部依赖进口,因此对吐根进行引种繁殖及栽培研究十分必要。吐根曾被成功引种到缅甸、马来西亚、印度、尼泊尔等亚洲国家(李庆华,1957;Jha S & Jha TB, 1989;马小军,1992)。我国虽然也有引种吐根的相关记载(马小军,1989),但与栽培技术相关的栽培基质、生长特性和繁殖方式等方面缺乏详细的数据参考。因此,本文对原产巴西的吐根开展与之相关的引种繁殖及栽培研究,旨在为其在国内推广种植提供依据。
1 材料与方法
1.1 材料
吐根的引种种源来自巴西马托格罗索州(Mato Grosso),经中国医学科学院药用植物研究所马小军研究员鉴定为吐根(Cephaelis ipecacuanha)。2016年12月从巴西引进后种植于中国医学科学院药用植物研究所云南分所苗圃。在每年的最低温度月份(西双版纳12月到翌年2月),吐根置于使用塑料薄膜覆盖的大棚中,保持晚上覆盖白天打开,大棚有专人进行日常栽培管理。
1.2 方法
1.2.1 吐根扦插繁殖研究
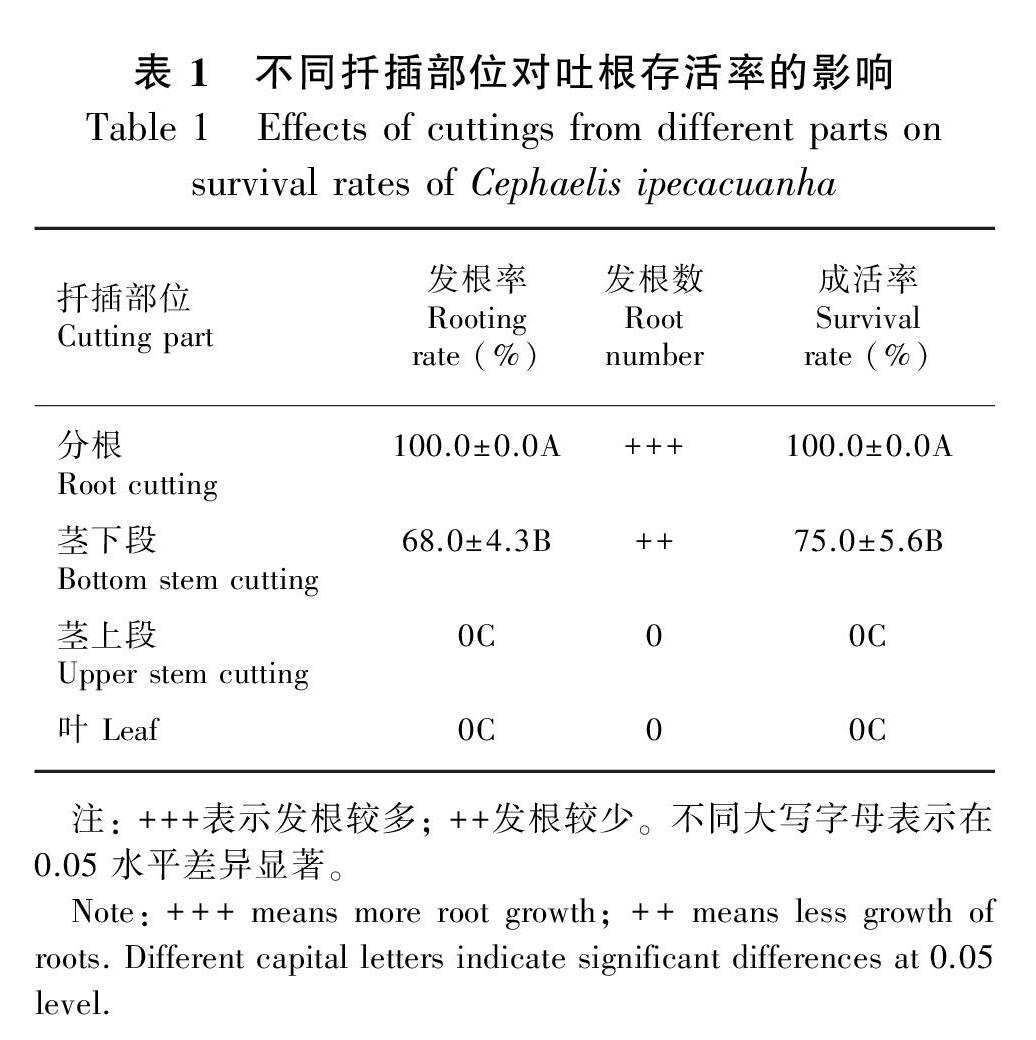
1.2.1.1 不同扦插部位对吐根存活率的影响 选取长势一致的植株,分别以分根(根长9.0~12.0 cm,根粗5.00~7.00 mm)、茎下段[茎长(7.5±1.1)cm,茎粗(2.59±0.15)mm]、茎上段[茎长(6.6±0.7)cm,茎粗(2.06±0.62)mm]和叶[叶长(12.3±0.2)cm,叶宽(7.2±0.2)cm]为扦插材料,种植容器为控根器(底盘直径为60 cm,高为30 cm),培养基质使用腐殖土∶椰糠体积比为4∶1,控根器内栽培基质填装厚度为20 cm,每处理组种植15株,每控根器种植1株,保持一致的水肥管理条件,2个月后观察发根情况,统计发根率,生长后期统计各处理的成活率。
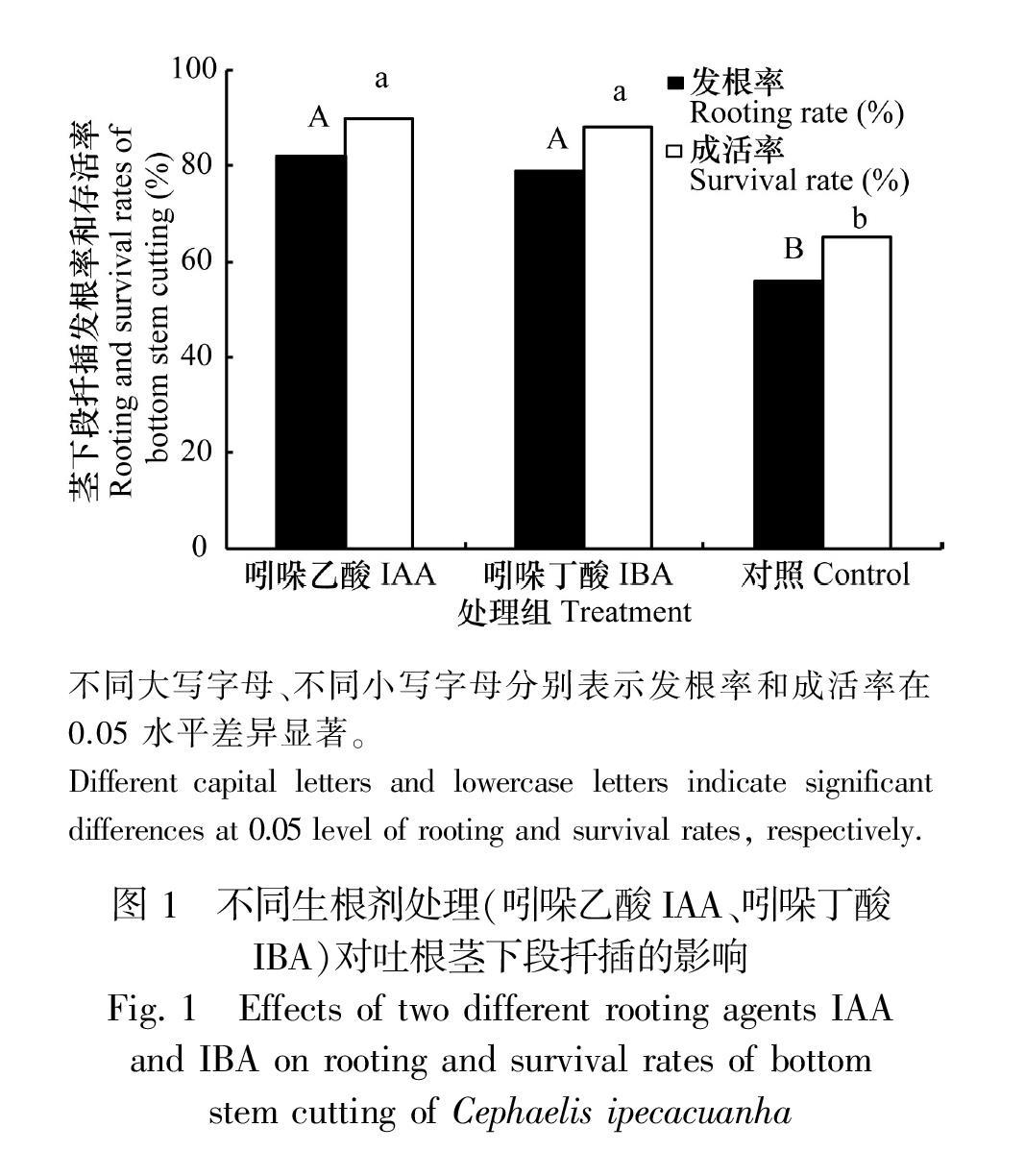
1.2.1.2 不同生根剂处理对扦插的影响 选取长势一致的植株,将植株茎用枝剪剪成上下段,取茎长≥5.8 cm、茎粗≥2.41 mm茎下段用于扦插。扦插前分别用IAA(吲哚乙酸)20 mg·L-1、IBA(吲哚丁酸)20 mg·L-1和清水(对照)浸泡1 h,每种处理种植15株,培养基质使用腐殖土∶椰糠体积比为4∶1,保持一致的水肥管理条件,2个月后观察发根情况,统计发根率,生长后期统计各处理的成活率。
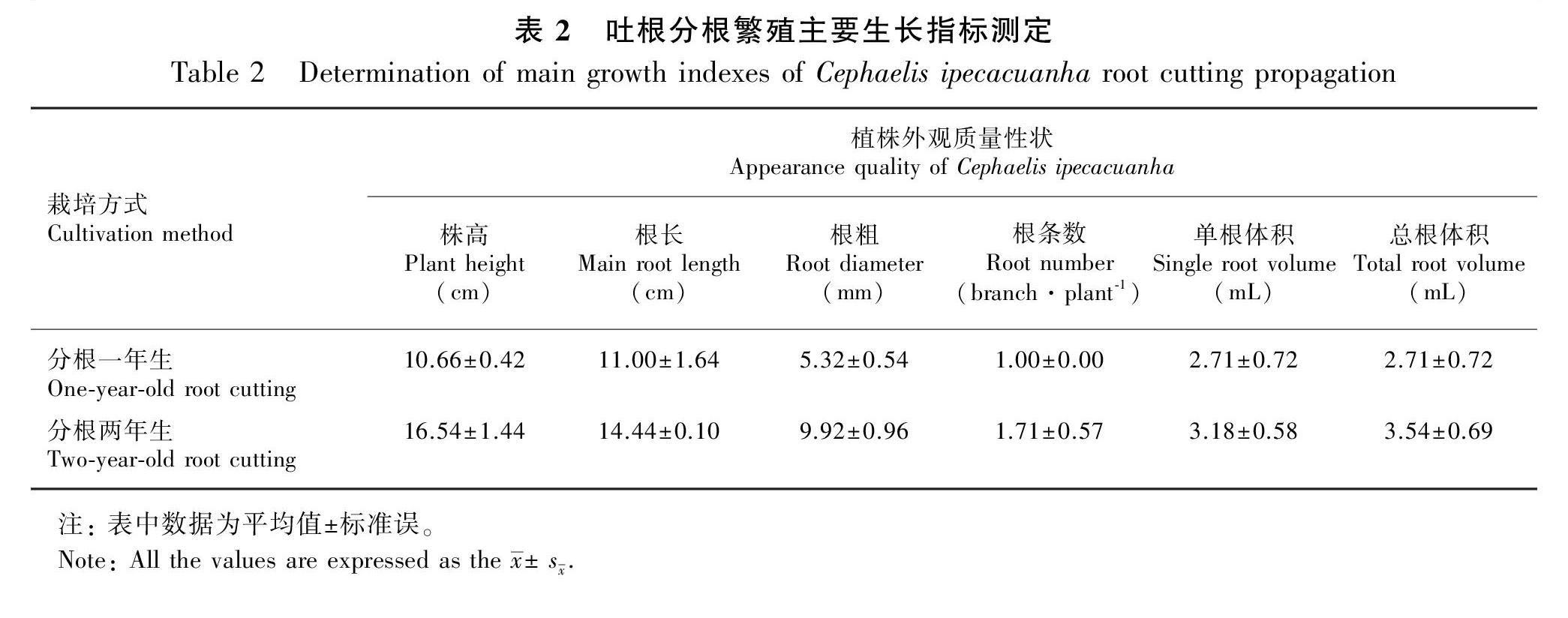
1.2.2 吐根分根繁殖研究 选择健壮、直径3.00~4.00 mm、长5.0~7.0 cm的一年生根条,作分根繁殖的种,栽种于控根器内。培养基质使用腐殖土∶椰糠体积比为4∶1,保持水肥等管理条件一致。每隔一年测量1次株高、根長、根粗和根条数等生长指标,共测量20株,分别计算分根一年生和分根两年生的根体积和总根体积。其中,根体积=3.14 ×(根粗/2)2×根长,总根体积为单株根体积之和。
1.2.3 吐根栽培研究
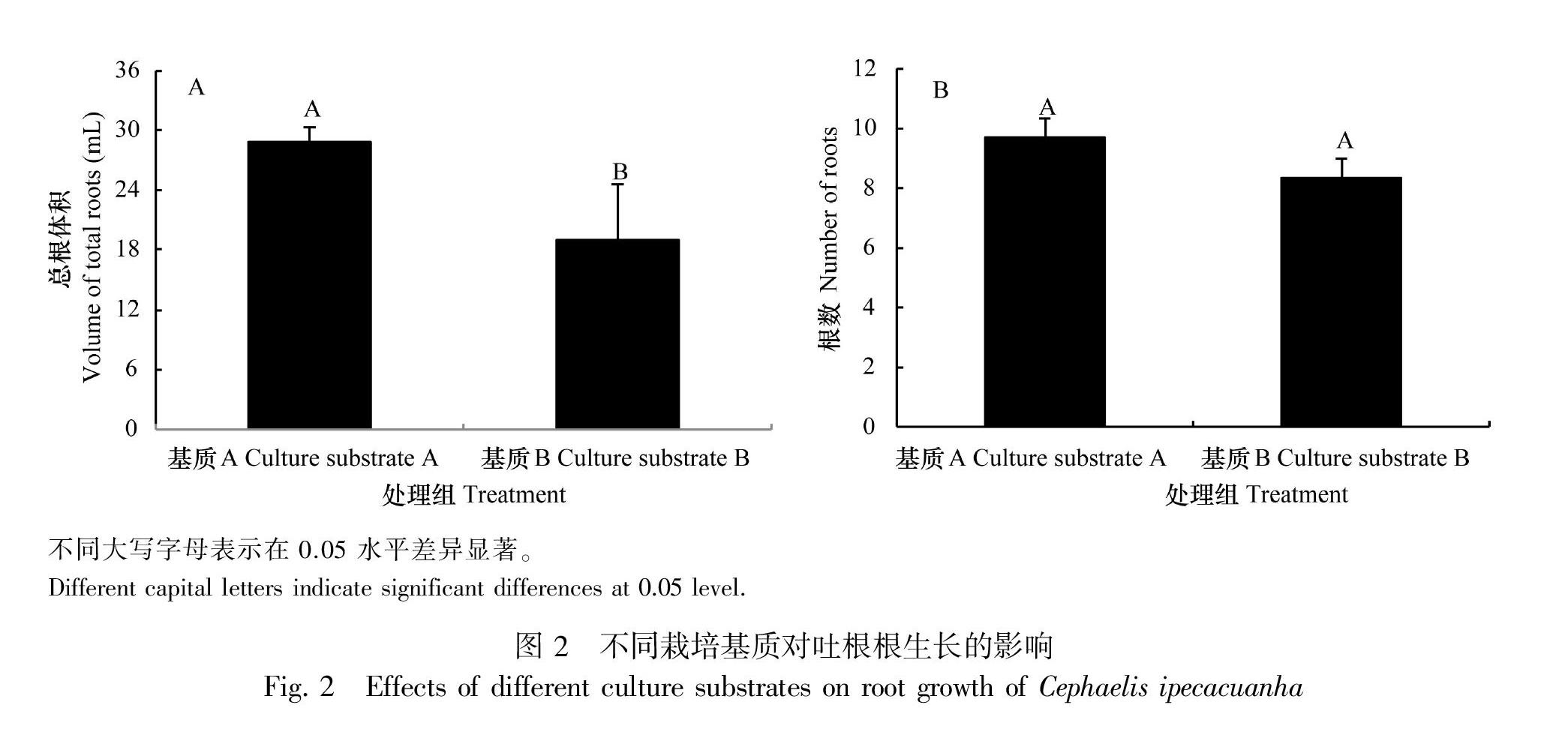
1.2.3.1不同栽培基质对吐根根生长的影响 选取生长较一致的吐根幼苗,采用不同的基质进行种植,试验分别设置基质A(腐殖土∶椰糠体积比为4∶1)和基质B(沙土)共2个处理,每个处理15株,保持一致的水肥等管理条件。每个控根器种植1株。一年后使用直尺测量根长及使用游标卡尺测量根粗(最大直径)生长指标,统计根数和总根体积。
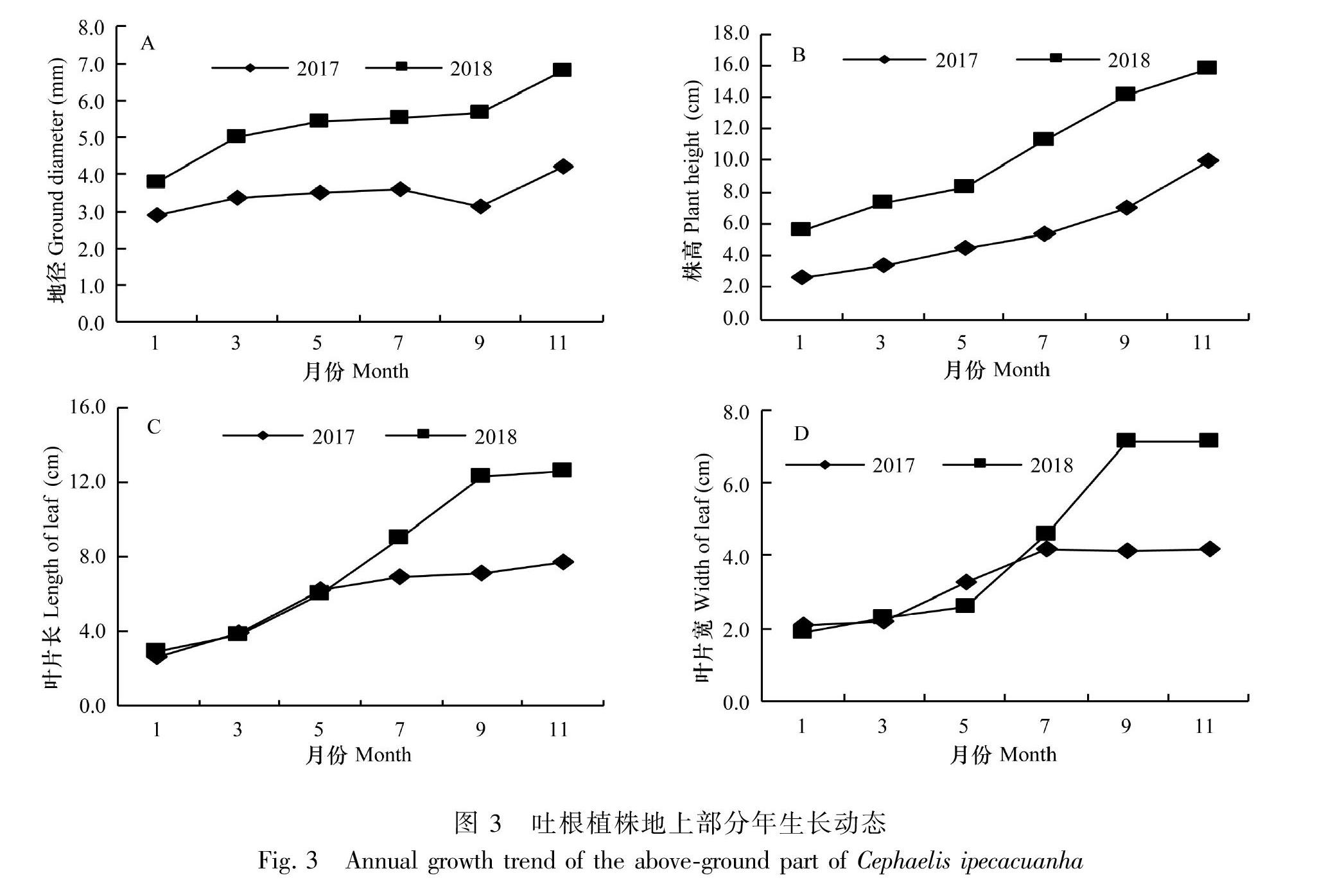
1.2.3.2 吐根地上部分年生长动态指标测定 选取长势一致的吐根幼苗于塑料薄膜覆盖的大棚中进行培育管理。每隔2个月测量植株的地径、株高、叶片长和叶片宽等指标,共测量20株。栽植时每控根器种植1株,培养基质使用腐殖土∶椰糠体积比为4∶1,水肥等管理条件一致。从2017年1月开始,连续观察两年。
1.3 数据处理
数据采用 Excel 2003和SAS 9.1软件进行分析,差异显著性分析采用Duncan’s新复极差法(Duncan’s multiple range test, DMRT),2种栽培基质对吐根根生长的影响采用t-Test检验法。
2 结果与分析
2.1 吐根扦插繁殖研究
2.1.1不同扦插部位对吐根存活率的影响 由表1可知,使用分根为扦插材料,发根率和存活率均达100.0%;使用茎下段为扦插材料,发根率和存活率分别为68.0%和75.0%;使用茎上段及叶片,发根率和存活率均为0。因此,可利用吐根的分根和茎下段进行扦插繁殖,且分根繁殖显著优于茎下段。
2.1.2不同生根剂处理对扦插的影响 图1表明,利用IAA和IBA浸泡处理后,茎下段的扦插发根率和成活率均显著高于对照组。其中,IAA 20 mg·L-1浸泡1 h,成活率为90.0%;IBA 20 mg·L-1浸泡1 h,成活率为88.0%。统计分析显示,两者差异不显著,说明IAA和IBA的扦插效果相当,均可以用于吐根茎下段的扦插繁殖。
2.2 吐根分根繁殖研究
对引种于云南西双版纳傣族自治州的吐根植株,连续两年测量其茎和根的生长指标,结果如表2所示,吐根一年生植株平均株高为10.66 cm,两年生平均株高为16.54 cm,呈持续生长状态。根在外观上总体呈柱状、有分叉、表面有极细的纵皱和一些椭圆形瘫痕,一年生植株根长平均为11.00 cm,根粗平均为5.32 mm,总根体积为2.71 mL;两年生有分叉根长平均为14.44 cm,根粗平均为9.92 mm,总根体积为3.54 mL。根呈灰色、灰棕色或红棕色,呈红棕色者往往具有横向环绕的脊,脊宽为0.5~1.0 mm,长约为根周长的一半,每厘米根有1~6条脊,有时可见以不规则间隙分布的环。可见,目前采用分根的吐根在植株和药材外观性状较好,单株总根体积较高,可作为云南地区比较适合推广的栽培方式。
2.3 吐根栽培研究
2.3.1不同栽培基质对吐根根生长的影响 由图2可知,基质A(腐殖土∶椰糠体积比为4∶1)和基质B(沙土)对根数的影响差异不显著,但基质A的根体积显著大于基质B,可见,基质A更利于吐根根生长。
2.3.2 吐根地上部分年生长动态指标测定 引种于云南西双版纳傣族自治州的吐根地上部分年生长动态观测结果如图3所示,吐根苗的地径和株高随着年时间进程而不断增大,其中,地径1—3月份和9—11月份增长明显;株高随着年时间进程持续增加,在7—11月增长明显;叶片长和宽在3—9月份增长明显,9月份之后基本停止生长。这些生长特点与西双版纳旱季和雨季分明的气候条件密切相关,因此可根据这些特点制定出科学的吐根水肥管理措施。
3 讨论与结论
本研究结果表明,云南省西双版纳傣族自治州景洪市的气候条件能满足吐根的正常生长发育需求,可作为吐根的引种地。吐根的分根和茎下段可用于扦插繁殖,可使用20 mg·L-1的IAA或IBA浸泡1 h的方法提高吐根茎下段的扦插成活率。采用分根繁殖的吐根植株在植株生长和药材外观性状较好,单株总根体积较高,吐根一年生植株平均株高为10.66 cm,两年生平均株高为16.54 cm,一年生植株根总体积为2.71 mL,两年生根总体积为3.54 mL。吐根栽培基质可选用腐殖土∶椰糠体积比为4∶1,在吐根的年周期生长中,地径在1—3月和9—11月增长明显,株高在7—11月增长明显,叶片长和宽在3—9月增长明显,根据这些特点,可科学制定相应的水肥管理措施。目前,吐根已经在云南省西双版纳傣族自治州繁殖成功,将为吐根在国内栽培种植提供技术保障,以后可通过吐根规模化栽培,逐步满足国内药企的需求,对推动吐根相关产业链有序发展具有重要意义。
吐根依据现有文献资料,在我国目前未有人研究及栽培成功,国内吐根药材全部依赖于进口,虽然已有亚洲国家如印度、尼泊尔、缅甸、马来西亚等进行引种种植(李庆华,1957;Jha S & Jha TB, 1989;马小军,1992),但我们是从原产地巴西首次引种到中国国内并成功种植。结合原引种地巴西的温度、降雨量等主要气候条件以及西双版纳傣族自治州引种吐根的栽培经验,在我国南部部分省份以及印度北部、尼泊尔南部等地区种植吐根具有巨大发展潜力,将其扩大种植在北纬23°以南亦可行。可为今后在中国云南省南部地区如西双版纳傣族自治州、红河州、普洱市,广东省雷州半岛、 海南省的中南部地区如五指山市、 三亚市, 越南和老挝等的热带雨林区域进行规模化栽培奠定坚实基础。
种子繁殖、扦插繁殖和组织培养是植物重要的繁殖方法。本课题组研究发现吐根可以通过分根和茎下段进行扦插繁殖,虽然扦插繁殖获得成功,但繁殖系数低于种子繁殖和组织培养;而使用吐根种子繁殖的方式,播种后每周观察一次,未见种子发芽。Mitra & Chakraborty(1949)在印度加尔各答也报道了这种现象,吐根种子是否属于顽拗型种子?吐根种子是否存在形态后熟或生理后熟?还需进一步研究。
采用組织培养技术进行吐根繁殖是研究的重要方面,国外已有一些有益的探索并取得了初步成功,如Chaudhuri & Jha(2008)使用Kn(2 mg·L-1)、BAP(2 mg·L-1)、2iP(2~3 mg·L-1)、NAA(0.2 mg·L-1)和腺嘌呤(40~100 mg·L-1)作为添加剂的MS培养基用于诱导节点分生组织的新芽繁殖和节间段的芽生长,获得组培成功,并且在田间条件下各项生长指标均良好,其中有25%的植物能够在一年内开花。此外,组培获得的吐根形态学特征稳定,且具有稳定的染色体数目(2n = 22)(Chaudhuri & Jha, 2008)。
在吐根栽培中发现,吐根病虫害发生较普遍,尤其是西双版纳州的雨季月份的高温高湿环境利于病害流行,如病毒病以及真菌类的炭疽病。害虫主要有同翅目的粉蚧以及蜗牛等有害动物。German et al.(1991)也报道了吐根病害如叶斑病(Mycena citricolor )、茎枯病(Sclerotium rolfsii)和枯萎病(Fusarium sp.)的危害。因此,一方面需要做好吐根病虫害的预防工作,如采取清除落叶等病残体、苗床消毒、使用沤熟的有机肥和合理的植物间距等措施。另一方面,还需对吐根病虫害生物学生态学及绿色防控技术开展研究。此外,建议吐根田间种植行距20~30 cm、株距10~15 cm较为合适,因为合理的种植密度可减少病虫害发生。Rodriguez & Blanco(2016)研究发现,吐根种植密度为行距20.0 cm、株距7.5 cm时可减少真菌病害发生,有效降低病害造成的损失。
吐根的生长发育与西双版纳州旱季和雨季分明的气候条件密切相关。结果表明,其在云南9月份生长最好。11月份开始,叶片会出现变褐现象,11月底叶片变褐明显,同时有落叶现象。本研究发现,吐根叶片变褐并非病原菌导致。通过使用遮阳网和加强水管理有了较为明显的改善,说明吐根对遮阴度及湿度有一定需求,最佳遮阴度和湿度有待进一步探索。
吐根在云南9月份生长最好。而吐根曾被成功引种到印度加尔各答,在8月生长最佳(Mitra & Chakraborty,1949),物候期與本文有一定差异,原因可能是不同气候环境导致。在印度8月份降雨量为391.15 mm,平均温度为26.39 ℃,而云南西双版纳8月份正值雨季,雨量充沛,气候差异明显。西双版纳傣族自治州冬季月份的最低平均温度为17.2 ℃,不能充分满足吐根的生长需求,我们试验中将部分种苗放在温室种植,提高温度到28~32 ℃,并保持一定的昼夜温差,发现明显地促进了吐根的生长。因此,规模化种植时,在冬季建议采用保护地种植模式。观察还发现,吐根在云南3月份地径、叶片长和宽增长明显,在加强水管理的条件下,旱季月份的短期低温条件较利于吐根生长。
参考文献:
CHAUDHURI RK, JHA TB, 2008. Conservation and production of Ipecac (Cephaelis ipecacuanha Rich.) plants from long term shoot cultures [J]. Plant Tiss Cult Biotechnol, 18(2): 157-164.
DE OLIVEIRA LO, VENTURINI BA, ROSSI AA,et al., 2010. Clonal diversity and conservation genetics of the medicinal plant Carapichea ipecacuanha (Rubiaceae) [J]. Genet Mol Biol, 33(1): 86-93.
GERMAN RC, FABIO AB, HERNN RN, 1991. Enfermedades más comunes de la raicilla (Cephaelis ipecacuanha Rich.) en Costa Rica y recomendaciones para su cultivo [J]. Uniciencia, 8(1): 11-16.
IDEDA K, TESHIMA D, AOYAMA T, 1988.Clonal propagation of Cephaelis ipecacuanha [J]. Plant Cell Rep, 7(4): 288-291.
ISOGAI S, TOUNO K, SHIMOMURA K, 2008. Gibberellic acid improved shoot multiplication in Cephaelis ipecacuanha [J]. In Vitro Cell Dev Biol, 44(3): 216-220.
ITOH A, TANAHASHI T, NAGAKURA N, 1991. Six tetrahydroisoquinoline-monoterpene glucosides from Cephaelis ipecacuanha [J]. Phytochemistry, 30(9): 3117-3123.
JHA S, JHA TB, 1989. Micropropagation of Cephaelis ipecacuanha A. Richard [J]. Plant Cell Rep, 8(8): 437-439.
JHA S, SAHU NP, MAHATO SB, 1988. Production of the alkaloids: emetine andcephaeline in callus culture of Cephaelis ipecacuanha [J]. Planta Med, 54(6): 504-506.
LI QH, 1957. Pulvis ipecrcuanhae composita and compound camphok tincture [J]. Chin Pharm J, (3): 117-119. [李庆华, 1957. 复方吐根散和复方樟脑酊 [J]. 中国药学杂志, (3): 117-119.]
MA XJ,1989. Study on introduction and cultivation of foreign medicinal plants [J]. Chin Seed Ind, (3): 40-41. [马小军, 1989. 国外药用植物的引种与栽培 [J]. 作物品种资源, (3): 40-41.]
MA XJ,1992. Research progress on cultivation techniques of foreign medicinal plants [J]. Drugs Clinic, 7(4): 151-156. [马小军, 1992. 国外药用植物栽培技术研究近况 [J]. 国外医药·植物药分册, 7(4): 151-156.]
MITRA GC, CHAKRABORTY D, 1949. A preliminary investigation on the growth of Cephaelis ipecacuanha (Brot) A. Rich., under tropical conditions at calcutta [J]. J Pharm Pharmacol, 1(1): 396-400.
The Uintied States Pharmacopeia Convention(USPC). USA Pharmacopeia [S]. Rockville: 2009: 2682.
RODRIGUEZ NH, BLANCO FA, 2016. Efecto de las distancias de siembra en la Ipecacuana o Raicilla (Cephaelis ipecacuanha Rich.) [J]. Uniciencia, 7(1): 15-18.
ROUT GR, SAMANTARAY S, DAS P, 2000. In vitro somatic embryogenesis from callus cultures of Cephaelis ipecacuanha A. Richard [J]. Sci Hort-Amsterdam, 86(1): 71-79.
SMITH RP, SMITH DM, 1961. Acute ipecac poisoning [J]. New Engl J Med, 265(11): 523-525.
SOUZA MM, MARTINS ER, PEREIRA TN, 2003. Reproductive studies in ipecac (Cephaelis ipecacuanha (Brot.) A. Rich.; Rubiaceae): Flower bud and anther size associated to male gamete development stages [J]. Cytol Tokyo, 68(4): 351-356.
SOUZA MM, MARTINS ER, PEREIRA TN, 2006. Reproductive studies on ipecac (Cephaelis ipecacuanha (Brot.) A. Rich.; Rubiaceae): meiotic behavior and pollen viability [J]. Braz J Biol, 66(1A): 151-159.
European Pharmacopoeia Commission (EPC). European Pharmacopoeia [S]. Strasbourg: 2010: 1155-1156.
SUN L, HUXR, LIU LN, et al., 2012. Rapid detection of alkaloids in ipecac by direct analysis in real time tandem mass spectrometry (DART-MS / MS) [J]. Chin J Chin Mat Med, 37(10): 1426-1430. [孫磊, 胡晓茹, 刘丽娜, 等, 2012. 实时直接分析-串联质谱法 (DART-MS /MS) 快速检测吐根中生物碱 [J]. 中国中药杂志, 37(10): 1426-1430.]
TESHIMA D, IKEDA K, SATAKE M, et al., 1988. Production of emetic alkaloid by in vitro culture of cephaelis ipecacuanha A. Richard [J]. Plant Cell Rep, 7(4): 278-280.
Society of Japanese Pharmacopoeia (SJP). The Japanese Pharmacopoeia [S]. Tokyo: 2006: 1303.
WANG C, PEI CY, WANG ZQ, et al., 2013. Determination of emetine and cephaeline in Cephaelis ipecacuanha by HPLC [J]. Mod Chin Med, 15(10): 832-834. [王超, 裴彩云, 王宗权, 等, 2013. HPLC测定吐根中吐根碱和吐根酚碱的含量 [J]. 中国现代中药, 15(10): 832-834.]
YAMUNA P, BOSE I, JHA TB, et al., 1993. Direct organogenesis from internodal segments of in vitro grown shoots of Ipecac, Cephaelis ipecacuanha Rich. [J]. Ind J Exp Biol, 31: 926-929.
YOSHIMATSU K, SHIMOMURA K, 1991. Efficient shoot formation on internodal segments and alkaloid formation in the regenerates of Cephaelis ipecacuanha A. Richard [J]. Plant Cell Rep, 9(10): 567-570.
YOSHIMATSU K, SHIMOMURA K, 1994. Plant regeneration on cultured root segments of Cephalis ipecacuanha A. Richard [J]. Plant Cell Rep, 14(2-3): 98-101.
(责任编辑 李 莉)
