沼泽红假单胞菌蛋白Rhp-PSP对烟草花叶病毒的系统抗性诱导及互作蛋白筛选
2021-12-17周寒梅陈丽洁翟忠英张德咏
周寒梅,陈丽洁,翟忠英,张德咏,2,苏 品,2,刘 勇,2*
(1. 湖南大学研究生院隆平分院,长沙 410125;2. 湖南省农业科学院植物保护研究所,长沙 410125)
关 键 字:沼泽红假单胞菌;防御酶;抗病相关基因;蛋白互作
烟草花叶病毒Tobacco mosaic virus(TMV)是一种具有代表性的植物病毒,可侵染黄瓜、番茄、辣椒等350多个物种,每年造成巨大的经济损失,是仅次于黄瓜花叶病毒Cucumber mosaic virus(CMV)的第二大优势病毒[1,2]。目前,TMV的防治措施主要为抗病品种选育、实行套种轮作等农业防治手段以及治蚜防病、药剂防治等化学手段[3]。但由于高抗品种选育难、防治效果不理想、抗药性、残留、食品安全等一系列问题,目前还未出现国际公认的抗TMV药物[4]。在当前的绿色农业背景下,生物防治由于其低毒、环境友好等特点已成为重点研究方向。用于生物防治的生防因子包括拮抗微生物、抗生素和植物诱导子等[5]。
光合细菌(Photosynthetic bacteria)是指可以在光照下进行光合作用的厌氧或兼氧生长的一类细菌[6]。作为一种生防菌在生物防治领域已得到广泛研究和应用[7]。研究人员发现光合细菌能诱导植物产生系统抗性[8]。如经过光合细菌处理后的蚕豆与苋色藜植株,对黄瓜花叶病毒、香石竹斑驳病毒的抗病性增强[9],刘勇等[10]的研究发现光合细菌稀释液可有效防治田间辣椒病毒病;Su等[11]的研究表明,在烟草叶际施用光合细菌活菌悬液后,对TMV产生了明显的抗性。但大部分研究未对光合细菌发挥抗病作用的物质进行深入研究。前期试验证明,在光合细菌沼泽红假单胞菌菌液中发现了一种高氯酸溶性蛋白(perchloric acid-soluble protein,PSP),命名为Rhp-PSP,该蛋白属于YjgF/YER057c/uK114家族蛋白成员。该家族蛋白多参与细胞的基础代谢,生理生化功能多样,但功能背后的分子机制却不明确[12]。而在微生物中,该类蛋白的功能也被多是基于其蛋白结构与活性基团的假设[13],对于其诱导抗病机制还有待研究。
研究发现蛋白Rhp-PSP不仅对TMV病毒粒子有直接抑制作用,且接种TMV前用Rhp-PSP处理过的烟草叶片,更能有效防控病毒的侵染,在100 μg/mL浓度下,Rhp-PSP对叶片的保护效果为76.5%[14]。因此,推测蛋白Rhp-PSP能诱导烟草产生对TMV的系统抗性,为进一步验证猜想,本研究通过检测烟草相关防御酶活性与丙二醛(MDA)含量变化、抗病相关基因的表达情况,初步筛选互作蛋白,旨在探讨蛋白Rhp-PSP诱导烟草产生系统抗性的作用机理,希望能够为光合细菌应用于生物防治提供理论依据。
1 材料与方法
1.1 材料
供试菌株、质粒:酵母菌株Saccharomyces cerevisiaeY2HGold、Y187、载体pGBKT7-53、pGBKT7-Lam和pGADT7-T均购于CLONTECH公司;大肠杆菌E.coli感受态细胞DH5α购于擎科生物技术有限公司;载体pGADT7和pGBKT7均由湖南省植物保护研究所保存。
试剂及培养基:本氏烟cDNA文库构于上海欧易生物医学科技有限公司;BamHI/NdeI限制性内切酶、T4 DNA连接酶、聚合酶链式反应试剂盒、荧光定量 PCR试剂盒、质粒小提试剂盒、胶回收试剂盒购于TAKARA公司;过氧化物酶(POD)测定试剂盒,多酚氧化酶(PPO)测试盒,苯丙氨酸解氨酶(PAL)测试盒,丙二醛(MDA)测定试剂盒购于南京建成生物工程研究所;LB液体培养基:1%胰蛋白胨、0.5%酵母提取物、1% NaCl、pH 7.0~7.5;LB固体培养基:LB液体培养基中添加1.7%的琼脂粉;酵母完全培养基(yeast extract peptone dextrose,YPDA):2%胰蛋白胨、1%酵母提取物、0.003%腺嘌呤、2%葡萄糖。
酵母筛选培养基(synthetic dropout,SD)、色氨酸缺陷型酵母培养基(SD/-Trp)、亮氨酸和色氨酸缺陷型酵母培养基(SD/-Trp/-Leu)、色氨酸、亮氨酸和组氨酸缺陷型酵母培养基(SD/-Trp-His-Ade)和色氨酸、亮氨酸、组氨酸和腺嘌呤缺陷型酵母培养基(SD/-Trp/-Leu/-His/-Ade)、X-α-gal,均购于CLONTECH公司。
仪器:Milli-QA10纯水机,法国Millipore公司;小型台式离心机5415C,德国Eppendorf公司;水平电泳仪,国产;超净工作台,苏州净化仪器设备厂;PCR仪,Eppendorf;凝胶成像系统,美国AlphaInnotech公司;pHS-818精密型酸度计,贵阳学通仪器仪表有限公司;自动电热压力蒸汽灭菌锅,上海申安医疗器械厂;赛福PRX450D智能人工气候箱,宁波海曙赛福实验仪器厂;-80℃超低温冰箱,日本三洋公司;旋涡器,国产;摇床,国产;水浴锅,国产;其它小型仪器,国产。
1.2 蛋白Rhp-PSP的诱抗作用
1.2.1 蛋白 Rhp-PSP处理后烟草叶片中防御酶活性及抗病相关物质含量 挑选健康的 5周龄本氏烟草植株,设置4个处理组,分别是清水对照、Rhp-PSP+TMV、蛋白Rhp-PSP以及TMV,每个处理5株烟草,3次重复。蛋白处理方法喷施处理,将100 μg/mL的蛋白Rhp-PSP对烟草进行喷施处理,直至烟草叶片铺满细密的水滴,既不聚集也不流下,24 h后接种TMV病毒粒子。TMV接种方法为摩擦接种。分别于接种TMV后的第1、3、5和7 d时的烟草顶部叶片进行取样,检测烟草叶片中过氧化物酶POD、多酚氧化酶PPO、苯丙氨酸解氨酶PAL以及丙二醛MDA含量的变化。
1.2.2 蛋白Rhp-PSP处理后烟草叶片中抗病相关基因的表达量 取健康的5周龄本氏烟草植株,蛋白处理以及TMV病毒粒子接种方法同1.2.1,本试验设置3个处理组,喷施蛋白Rhp-PSP后接种TMV(T1)、喷施清水后接种TMV(T2)和喷施清水后用清水摩擦接种(CK)。分别在TMV接种处理后第1、2、3、4 d收集叶片进行检测。每个处理5株,3次重复。
采用Trizol法[15]对烟草总RNA进行提取,使用TaKaRa公司的反转录试剂盒进行cDNA合成,以 cDNA产物为模板,Actin作为内参基因,使用全式金生物技术有限公司的 qPCRmix试剂盒进行基因表达量检测。抗性基因及内参基因的引物序列见表1。qPCR 程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃30 s,72 ℃ 30 s,40 个循环。通过 2-△△Ct法计算病程相关基因PR-1、PR-3、PR-5以及PDF1.2的相对表达量,其中△△Ct=(待测组目的基因Ct值-待测组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值)。

表1 qPCR引物Table 1 The primers in qPCR
1.3 酵母双杂交筛选互作蛋白
1.3.1 诱饵质粒的构建 根据Rhp-PSP序列和pGBKT7载体序列设计带酶切位点的特异性引物,其中上游引物带 NdeI酶切位点(5'-TCAGAGGAGGACCTGCATATG GTTGAGCAGAAGCTCG-3'),下游引物带BamHI酶切位点(5'-CGCTGCAGGTCGACGGATCCTCAGGCGACCTCGAAC-3');并以实验室前期工作中保存的PET28A-RhpPSP质粒为模板进行PCR扩增,胶回收目的片段;分别对PCR扩增序列及pGBKT7载体进行NdeI和BamHI的双酶切,并胶回收线性化后的片段;T4 DNA连接酶构建连接体系,并将连接产物转化大肠杆菌感受态细胞,挑选单克隆并测序,对测序结果正确的克隆菌株进行质粒提取,即为诱饵载体pGBKT7-RhpPSP。
1.3.2 诱饵载体的自激活及毒性检测 采用LiAc法[16]制备酵母菌株Y2HGold的感受态细胞,将诱饵质粒pGBKT7-RhpPSP与pGADT7空载体共转化Y2HGold为自激活检测组,以含有pGBKT7-53和pGADT7-T质粒的酵母菌为阳性对照组,以含有pGBKT7-Lam和pGADT7-T质粒的酵母菌为阴性对照组。将转化后的菌液涂布于SD/-Leu/-Trp、SD/-Trp-Leu-Ade-His、SD/-Trp-Leu-Ade-His/x-α-gal平板上,置于30 ℃培养箱培养3~5 d,观察菌落的显色情况,确定诱饵蛋白是否具有自激活活性
将诱饵载体 pGBKT7-RhpPSP和对照空载体 pGBKT7分别转化 Y2HGold酵母感受态细胞并涂布于SD/-Trp平板,在30 ℃恒温培养箱中倒置培养3 d后,观察转化诱饵载体和对照载体的转化菌菌落大小以及生长状态,以判定诱饵蛋白是否对酵母菌株产生毒性。
1.3.3 酵母 cDNA文库筛选 采用 Mating杂交法进行酵母文库筛选,具体参照 CLONTECH公司的Matchmaker Gold Yeast Two-Hybrid System操作手册。挑取新鲜培养的2~3 mm诱饵酵母菌落于50 mL SD/-Trp液体培养基中,30 ℃培养20 h。当OD600达到0.8时,离心并弃去上清液,用5 mL SD/-Trp重悬,将5 mL含诱饵载体的Y2HGold菌液和1 mL Y187 cDNA文库菌液加入含有45 mL 2×YPDA/Kan(50 ug/mL)液体培养基中,30 ℃摇床低速振荡培养24 h,在显微镜下(40×)观察到二倍体接合型后离心,用10 mL 0.5×YPDA培养基重悬后涂布于直径150 mm的SD/-Trp-Leu/ X-α-gal平板上,30 ℃避光培养5 d,随后将平板上的蓝色菌落转移到SD/-Trp-Leu-Ade-His/ X-α-gal平板上,30 ℃避光培养10 d。
挑取上述平板中直径超过2 mm的蓝色单菌落,于SD/-Leu/-Trp液体培养基中扩繁,提取酵母质粒并以 pGADT7 载体通用引物(F:5'-CTATTCGATGATGAAGATACCCCACCAAACCC-3';R:5'-GTGAACTTG CGGGGTTTTTCAGTATCTACGATT-3')进行 PCR鉴定文库阳性克隆,分析插入片段的大小并排除重复克隆。
将符合要求的阳性克隆进一步转化到大肠杆菌DH5α感受态细胞中,并涂布于 LB固体培养基上(含50 μg/mL Ampicillin),37 ℃过夜培养,挑选单克隆扩繁并进行测序验证;根据测序结果去除重复的克隆;再将筛选后的阳性克隆序列在NCBI数据库中进行Blast比对分析,初步获得候选基因信息。
1.4 酵母双杂交一对一验证
根据GenBank中同源基因的序列,设计PCR扩增的特异性引物,并加入特定的酶切位点。扩增获得对应全长基因序列后,将其插入 pGADT7载体中构建重组子。重组子分别与质粒 pGBKT7和 pGBKT7-RhpPSP共转化酵母菌Y2HGold,转化产物涂布SD/-Leu/-Trp平板,30 ℃培养箱培养3~5 d,观察菌落生长情况。挑取平板上生长的单克隆菌落溶于20 μL ddH2O中,即为初始菌液浓度,按4个浓度梯度(10-1,10-2,10-3和 10-4)对初始菌液进行稀释,接种于 SD/-Trp/-Leu/-His/-Ade平板,以含有 pGBKT7-53和pGADT7-T质粒的酵母菌为阳性对照组,以含有pGBKT7-Lam和pGADT7-T质粒的酵母菌为阴性对照组,30 ℃培养箱培养3~5 d,观察菌落生长情况。
2 结果与分析
2.1 蛋白Rhp-PSP的诱抗作用
2.1.1 蛋白Rhp-PSP处理后烟草叶片中防御酶活性及抗病相关物质含量变化 通过检测蛋白Rhp-PSP处理后烟草防御酶活性变化,试验结果表明,经过Rhp-PSP处理后接种TMV的3种防御酶活性(PPO、POD、PAL)都普遍高于其他处理组,且PAL与POD的酶活性呈现先升高后降低的趋势,分别在5和7 d时达到酶活性最大值。与只接种 TMV组相比,Rhp-PSP+TMV组 PAL与 POD的酶活性分别提高 37.79%和54.50%,PPO酶活性则持续升高,第9 d时可高达62.84 U/mg。在MDA含量检测结果中,Rhp-PSP+TMV处理组中的MDA含量呈现先降低再升高,后又降低的趋势,而只接种TMV组的MDA含量则随时间持续上升(图1)。
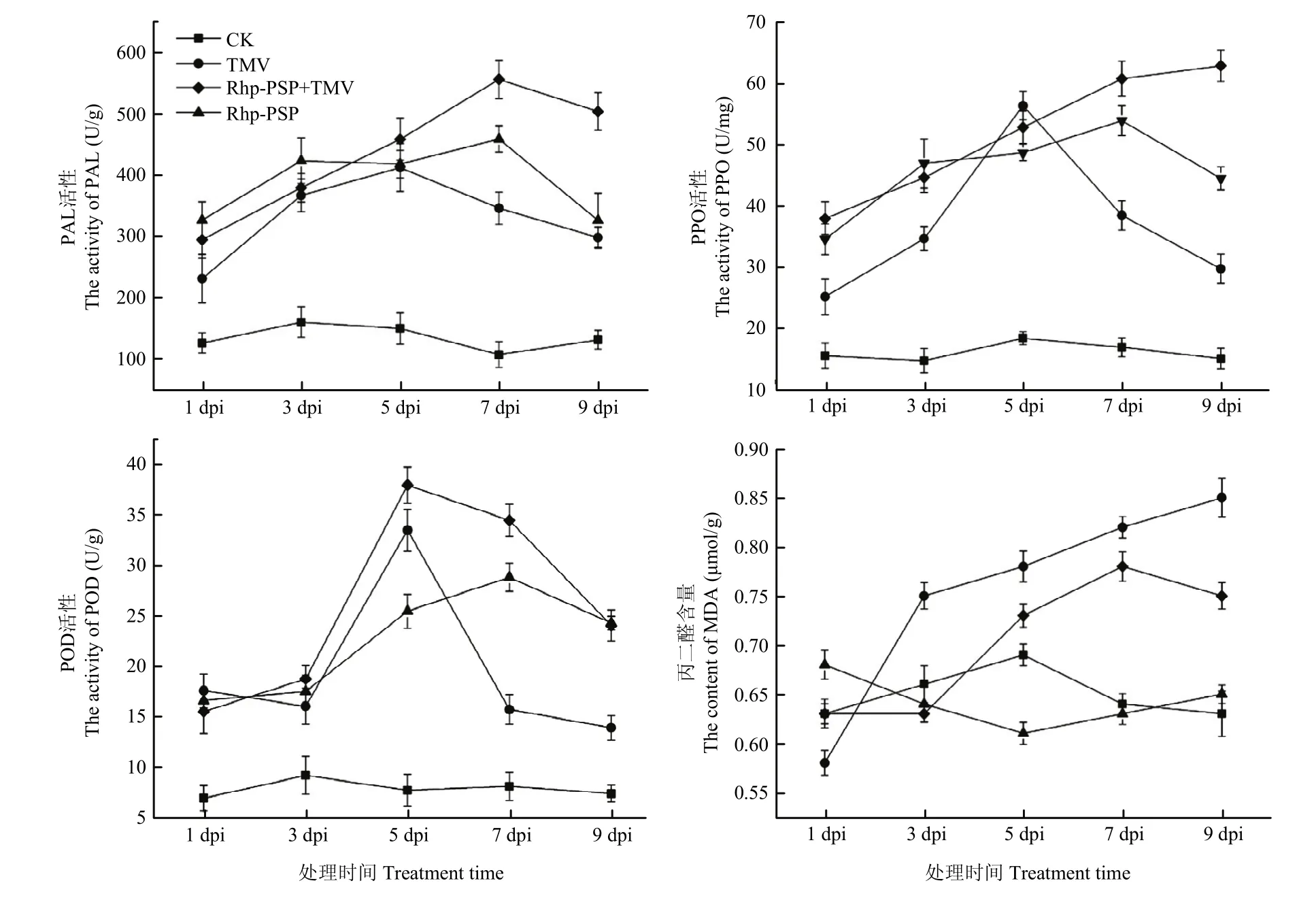
图1 蛋白Rhp-PSP处理对烟草叶片防御酶活性及MDA含量的影响Fig. 1 Dynamic curve of protective enzyme activities and content of MDA after Rhp-PSP treatment in tobacco
2.1.2 蛋白Rhp-PSP处理后烟草叶片中抗病基因表达量检测 通过qPCR方法对蛋白处理后烟草中抗性基因表达量进行检测结果显示,抗性基因PR-1、PR-3、PR-5、PDF1.2在蛋白Rhp-PSP处理后的烟草中,表达量明显上调,在3 d表达量达到最高值,分别为空白对照组的4.9、3.9、8.6和7.7倍,接种TMV组的3.7、2.2、4.3和4.7倍(图2)。

图2 抗性基因PR-1、PR-3、PR-5、PDF1.2的相对表达量Fig. 2 Relative expression levels of PR-1、PR-3、PR-5、PDF1.2
2.2 酵母双杂交筛选互作蛋白
2.2.1 诱饵质粒的构建 经PCR扩增得到的Rhp-PSP序列,通过NdeI/BamHI双酶切,将Rhp-PSP构建至诱饵载体pGBKT7上获得重组质粒。对重组质粒pGBKT7-RhpPSP进行琼脂糖凝胶电泳检测(图3A)和双酶切验证(图 3B),结果与预测值相同。并经测序验证,结果和目的基因序列一致,说明已成功构建了酵母诱饵质粒pGBKT7-RhpPSP。
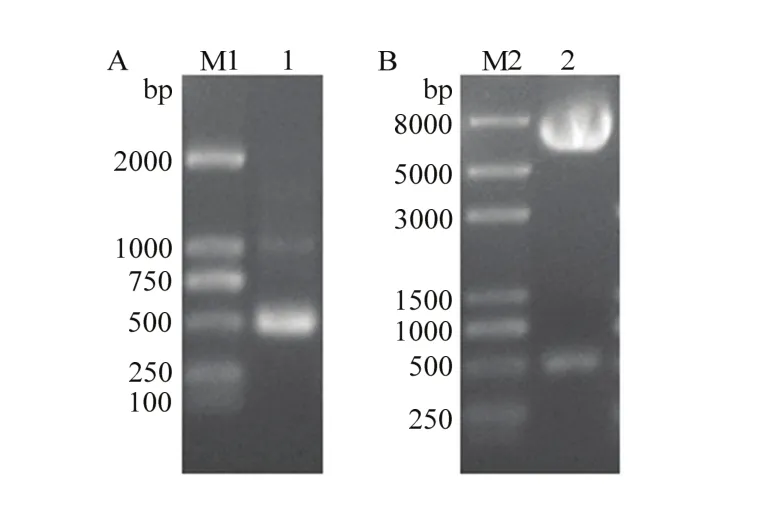
图3 重组诱饵载体pGBKT7-RhpPSP的PCR验证(A)及双酶切验证(B)Fig. 3 Dentification of the recombinants of pGBKT7-RhpPSP by PCR (A) and double enzyme digestion (B)
2.2.2 诱饵载体的自激活检测及毒性检测 将自激活检测组、阳性对照组、阴性对照组转化到 Y2HGold酵母感受态细胞后,在SD/-Leu/-Trp、SD/-Trp-Leu-Ade-His、SD/-Trp-Leu-Ade-His/x-α-gal平板上培养5 d结果表明,三组均能在 SD/-Leu/-Trp平板上正常生长(图 4A),说明质粒已共转化到酵母菌株中。在SD/-Trp-Leu-Ade-His培养基上,自激活检测组同阴性对照组一样无法生长(图4B),并且在加了X-α-Gal的平板上只有阳性对照组变蓝色(图4C),表明所构建的酵母诱饵载体报告基因没有自激活活性。因此,构建的诱饵表达载体pGBKT7-RhpPSP可以用于后续酵母双杂交的筛选试验。

图4 重组诱饵载体pGBKT7-RhpPSP的自激活检测Fig. 4 Self-activating detection of the recombinants of pGBKT7-RhpPSP
在SD/-Trp平板上可观察到诱饵质粒的酵母菌同对照相比,两者在菌落生长速度、大小、形态以及数目上并没有明显的差异(图5)。结果表明,诱饵载体pGBKT7-RhpPSP对酵母菌株Y2HGold没有毒性。

图5 重组诱饵载体pGBKT7-RhpPSP对酵母菌株Y2HGold的毒性检测Fig. 5 Analysis of toxicity of pGBKT7-RhpPSP to yeast strain Y2HGold
2.2.3 酵母双杂交筛选互作蛋白 以pGBKT7-RhpPSP为诱饵筛选烟草cDNA文库,统计SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上共有51个蓝色阳性菌落,利用PCR鉴定cDNA文库插入片段的大小,舍弃500 bp以下的小片段,其余的阳性酵母质粒转化大肠杆菌 DH5α,并进行测序分析。根据测序结果,去除重复序列,最终获得了11个与Rhp-PSP互作的蛋白(表2)。

表2 与 Rhp-PSP 相互作用蛋白质的生物信息学分析Table 2 Bioinformatics analysis of proteins interacting with Rhp-PSP
2.3 酵母一对一验证结果
为了进一步验证相互作用,避免假阳性情况,构建诱饵载体 pGADT7-CP2410A、pGADT7-Cab10b、pGADT7-protein40、pGADT7-Cab10A、pGADT7-cab91R、pGADT7-protein7、pGADT7-Lhcb1、pGADT7-CAB7、pGADT7-GPI、pGADT7-HCF136、pGADT7-VAN3,与质粒pGBKT7和pGBKT7-RhpPSP共转化酵母菌 Y2HGold。结果显示,阳性对照(pGBKT7-53+pGADT7-T)正常生长,而阴性对照(pGBKT7-Lam+pGADT7-T)及11个诱饵质粒与pGBKT7共转化的单克隆菌株在SD/-Ade/-His/-Leu/-Trp平板上均不能正常生长,说明所验证的诱饵载体均无自激活活性。pGADT7-Cab10A、pGADT7-GPI、pGADT7-VAN3诱饵载体与pGBKT7-RhpPSP共转化在4个不同浓度上均能长出白色菌落(图6)。由上述结果可知,筛选出的同源蛋白中GPI锚定蛋白、VAN3结合蛋白及叶绿素结合蛋白A与Rhp-PSP具有相互作用。

图6 蛋白互作验证Fig. 6 Verify protein interactions
3 讨论
抗性诱导是生物防治的途径之一,并作为一种防治农作物病害有效的方法被广泛研究[17]。蛋白是一种能介导植物获得系统抗性的物质。如Liang等[18]报道了大叶黄萎病菌的PevD1蛋白与Nbnrp1蛋白互作诱导烟草产生系统抗性,郭景红等[19]表明玫瑰黄链霉菌产生的诱抗粗蛋白能够诱导黄瓜抗病性的提升。付强等[20]以枯斑三生烟和普通烟为试验对象,采用半叶枯斑法以及田间试验,表明超敏蛋白不仅明显提高了烟草的抗性,还能有效促进烟株生长。
本研究通过蛋白Rhp-PSP诱导抗性试验结果表明,蛋白Rhp-PSP提高了烟草叶片防御酶的活性和抗病相关基因的表达,其中POD、PPO、PAL活性与植物抗病性密切相关[21],PR-1、PR-3、PR-5在水杨酸(SA)信号通路中起重要作用,PDF1.2是茉莉酸/乙烯(JA-ET)信号通路的标志基因[22],并降低了MDA的含量,MDA作为膜脂过氧化作用的指标,MDA的含量低,膜受损程度越小,相反则越大。综上所述,蛋白Rhp-PSP可诱导烟草产生对TMV的抗病性。为进一步探讨诱抗机理,我们对Rhp-PSP与烟草之间的互作情况进行探究。选用酵母双杂交方法筛选互作蛋白,确认pGBKT7-RhpPSP诱饵载体无自激活活性及无毒性后,用Mating法进行互作蛋白筛选。结果初步筛选到11个蛋白,通过酵母双杂交一对一进一步验证了叶绿素结合蛋白A、GPI锚定蛋白、VAN3结合蛋白与Rhp-PSP的互作。
叶绿素结合蛋白与植物的光合作用密切相关;Van3结合蛋白根据UniProt提供的GO功能注释分析为叶维管束、韧皮部或木质部组织发生相关蛋白;GPI锚定蛋白是一种在真核生物细胞膜表面普遍存在的蛋白质,最大特点是没有跨膜结构域和胞质尾区,通过翻译后修饰产生的GPI结构锚定在细胞膜上[23]。GPI锚定蛋白这类细胞表面受体研究较少,现在普遍认为,它们涉及细胞识别、生长、分化和程序性死亡等重要的生命过程[24]。Shen等[25]的研究表明GPI锚定蛋白与拟南芥FLS2关联,通过调节FLS2的积累和信号传导来调节植物免疫。Yu等[26]的研究揭示了植物多肽RALF被CrRLK1L型受体激酶与GPI锚定蛋白复合物识别,表明GPI蛋白可作为受体直接识别配体,介导植物细胞膜内外信号的转导。Li等[27]的研究表明GPI蛋白参与多种类受体激酶的转运及其质膜定位,并作为这些激酶的共受体感知外部信号。这一系列的研究结果表明,GPI锚定蛋白在植物信号识别与传导过程中具有重要作用。但还未见GPI锚定蛋白参与对TMV系统抗性诱导的报道。
本研究下一步将重点对GPI锚定蛋白进行体内和体外互作的进一步验证,明确其诱导产生系统抗性的通路以及其中的互作进程。本研究对深入了解沼泽红假单胞菌Rhp-PSP的基因功能及其参与的诱导抗性机制研究有重要意义。
