黑枸杞花青素对巨噬细胞RAW264.7 炎性与自噬交互作用的影响
2021-12-17薛才华王梦杰刘嘉华张龙飞张家玮
薛才华,武 强,王梦杰,刘嘉华,张龙飞,张家玮,吴 华
(青海大学农牧学院,青海西宁 810016)
炎症是指机体受到外界刺激后,通过系统本身的活体组织对外界致炎因子产生的一种防御作用。巨噬细胞作为免疫系统的重要组成成分,参与机体的特异性免疫与非特异性免疫,在炎症反应及疾病的发生发展过程中发挥着重要作用[1]。TLR4/NF-κB 信号通路是细胞识别病原激活免疫反应的一条经典信号通路,也是多种药物治疗炎症、免疫相关疾病的作用靶位[2-3]。细胞自噬是真核生物进行自我保护的一种机制,主要是通过溶酶体对细胞内的蛋白质和细胞器进行融合降解从而达到细胞稳态[4]。其中mTOR 信号通路是最常见的自噬调节通路之一,mTOR 介导的信号通路是调控细胞能量和营养代谢的重要枢纽。
黑枸杞花青素是从黑枸杞中分离提取出来的一种紫红色素,属于类黄酮类物质。黑枸杞花青素在细胞免疫上,具有增强淋巴细胞增殖、促进肿瘤细胞凋亡的功能[5]。研究发现,细胞内的信号通路之间并非各自独立、单一地执行某种功能,而是存在着许多“对话”,并相互交汇形成复杂的信号网络[6-7],对细胞的各项生命活动进行精准调控。细胞自噬参与众多固有免疫信号的调控,本文基于自噬调控通路mTOR 通路来研究黑枸杞花青素对小鼠巨噬细胞RAW264.7 TLR4/NF-κB 通路的影响,为黑枸杞资源的深度开发利用提供参考依据。
1 材料与方法
1.1 试验材料 小鼠巨噬细胞株RAW264.7 购买于中国科学院上海细胞库;黑枸杞花青素购于青海金麦杞生物科技有限公司(花青素61%、灰分0.6%、蛋白质6%、糖1.32%、氨基酸3.56%)[8];DMEM 干粉和胎牛血清购自于Gibco 公司;PBS 购自Hfart 公司;胰蛋白酶溶液和BCA 蛋白定量试剂盒购自Solarbio 公司;雷帕霉素(RAPA)购自MedChemExpress 公司;TRNzol Universal 总RNA 提取试剂盒、cDNA 反转录试剂盒和SuperReal 彩色荧光定量预混试剂盒均购自天根生化科技有限公司;山羊抗IgG 购自Abcam 公司;NF-κBp65抗体和p-NF-κBp65 抗体购自北京博奥龙免疫技术有限公司;p-mTOR 购自SAB 公司;Ant-GAPDH 购自Immunoway 公司。
1.2 试验仪器 超净工作台(江苏通净净化设备有限公司);CO2细胞培养箱(美国NUAIRE 公司);高速低温离心机(英国Dynamica 公司);PCR 仪及荧光定量系统(BIO-RAD);Western blot 转膜仪,Western blot 电泳仪及Western blot 电源(北京六一生物科技公司);摇床(美国SCILOGEX 公司);化学发光成像仪(北京赛智科技有限公司)。
1.3 试剂配制 花青素溶液的配制:准确称取0.01 g 花青素溶于10 mL DMEM 培养基中,配成1 mg/mL 的花青素母液,-20℃保存,使用前稀释成相应浓度。
LPS 溶液的配制:将1 mg LPS 粉末溶解于10 mL的PBS 溶液中,配制成100 μg/mL 的LPS 母液,分装后保存于-80℃冰箱,使用前稀释成相应浓度。
雷帕霉素抑制剂的配制:精确称取0.0914 g 雷帕霉素粉末加入1 mL 的PBS 溶液,配制成浓度为100 mmol/L的母液稀释使用,置于-20℃冰箱保存,试验中雷帕霉素的最终浓度为100 nmol/L。
BAY11-7082 抑制剂的配制:精称量0.0207 g BAY11-7082 溶入到1 mL PBS 中配制成100 mmol/L 的BAY11-7082溶液,取1μL 的BAY11-7082溶液加入到999 μL PBS 中,配制成100 μmol/L 的BAY11-7082 母液,然后将所有浓度的BAY11-7082 溶液置于-20℃冰箱保存。
1.4 细胞培养及分组 将小鼠巨噬细胞RAW264.7 置于37℃、5% CO2、饱和湿度的培养箱中培养,用含10%胎牛血清和1% 双抗的DMEM 培养液进行培养,每24 h换1 次液,待细胞生长70%~80%融合时将其传代,取处于对数生长期的细胞用于试验细胞分为对照组、花青素组(25 μg/mL)、脂多糖组(1 μg/mL)、花青素(25 μg/mL)+脂多糖(1 μg/mL)组、脂多糖(1 μg/mL)+雷帕霉素(100 nmol/L)组、花青素(25 μg/mL)+脂多糖(1 μg/mL)+雷帕霉素(100 nmol/L)组、脂多糖(25 μg/mL)+BAY11-7082(20 μmol/L)组、花青素(25 μg/mL)+脂多糖(1 μg/mL)+BAY11-7082(20 μmol/L)组。
1.5 实时荧光定量PCR 按上述分组进行试验,以细胞浓度为1×106接种至6 孔细胞培养板后常规培养,待细胞达到70%~80% 融合时分组处理,每组3 个重复。根据反转录试剂盒的操作步骤,将RNA 反转录成cDNA。之后使用荧光定量试剂盒进行荧光定量PCR 反应,使用上海生物公司设计合成的引物,如表1 所示。采用2-ΔΔCt法计算各目的基因的相对表达量。

表1 相关因子引物序列
1.6 Western Blot 检测相关因子蛋白表达 按上述分组进行试验,处理完各组细胞后,分别收集各组细胞,加入蛋白裂解液提取总蛋白,利用BCA 蛋白定量试剂盒检测蛋白含量。用30 μL 5×上样缓冲液与120 μL 蛋白样本混合于200 μL 离心管中,于PCR 仪上变性后泳道上样,经 SDS-PAGE 电泳后,半干转膜至PVDF 膜,按比例配制 NF-κBp65 抗体、p-NF-κBp65 抗体、p-mTOR抗体及 GADPH 抗体,4℃封闭过夜,TBST 洗膜,室温5×6 min 摇洗,加入山羊抗IgG 二抗,室温1 h 后TBST 洗膜,室温5×6 min 摇洗。将保鲜膜置于暗盒中,可以在其底部加水以固定薄膜,将PVDF 膜正面(蛋白附着面)朝上,放置于薄膜里。将发光液试剂盒中两种液体按1:1 比例混合,摇匀。滴加到PVDF 膜上,反应5 min。用镊子夹起PVDF 膜一角,使发光液自然流下,曝光显影观察。
1.7 统计分析 采用Image J 对条带量化,所有试验数据经Excel 软件初步处理后,所有数据采用 SPSS25.0 One-Way ANOVA Duncan's 法进行分析,计量资料采用平均数± 标准差表示。P<0.05 为差异显著,P<0.01为差异极显著,P>0.05 为差异不显著。
2 结果
2.1 阻断mTOR 通路后黑枸杞花青素对小鼠巨噬细胞RAW264.7 TLR4/NF-κB 通路的影响。
2.1.1 阻断mTOR 通路后黑枸杞花青素对小鼠巨噬细胞RAW264.7 TLR4/NF-κB 通路相关因子mRNA 表达的影响 如图1 所示,对照组相比,脂多糖组的TLR4、NFκB、TRAF6和MyD88的mRNA 表达均提高(P<0.01);当mTOR 被抑制后,与脂多糖+雷帕霉素组对比,花青素+脂多糖+雷帕霉素组的TRAF6mRNA 表达水平减低(P<0.05)。

图1 阻断mTOR 通路后黑枸杞花青素对TLR4、NF-κB、TRAF6、MyD88 mRNA 表达水平的影响
2.1.2 阻断mTOR 通路后黑枸杞花青素对小鼠巨噬细胞RAW264.7 TLR4/NF-κB 通路关键因子蛋白表达的影响由图2 可知,与对照组相比,脂多糖组的NF-κBp65 和p-NF-κBp65 的蛋白表达水平提高(P<0.01);当mTOR被抑制后,与脂多糖+雷帕霉素组对比,花青素+脂多糖+雷帕霉素组的NF-κBp65 蛋白表达水平降低(P<0.01)。
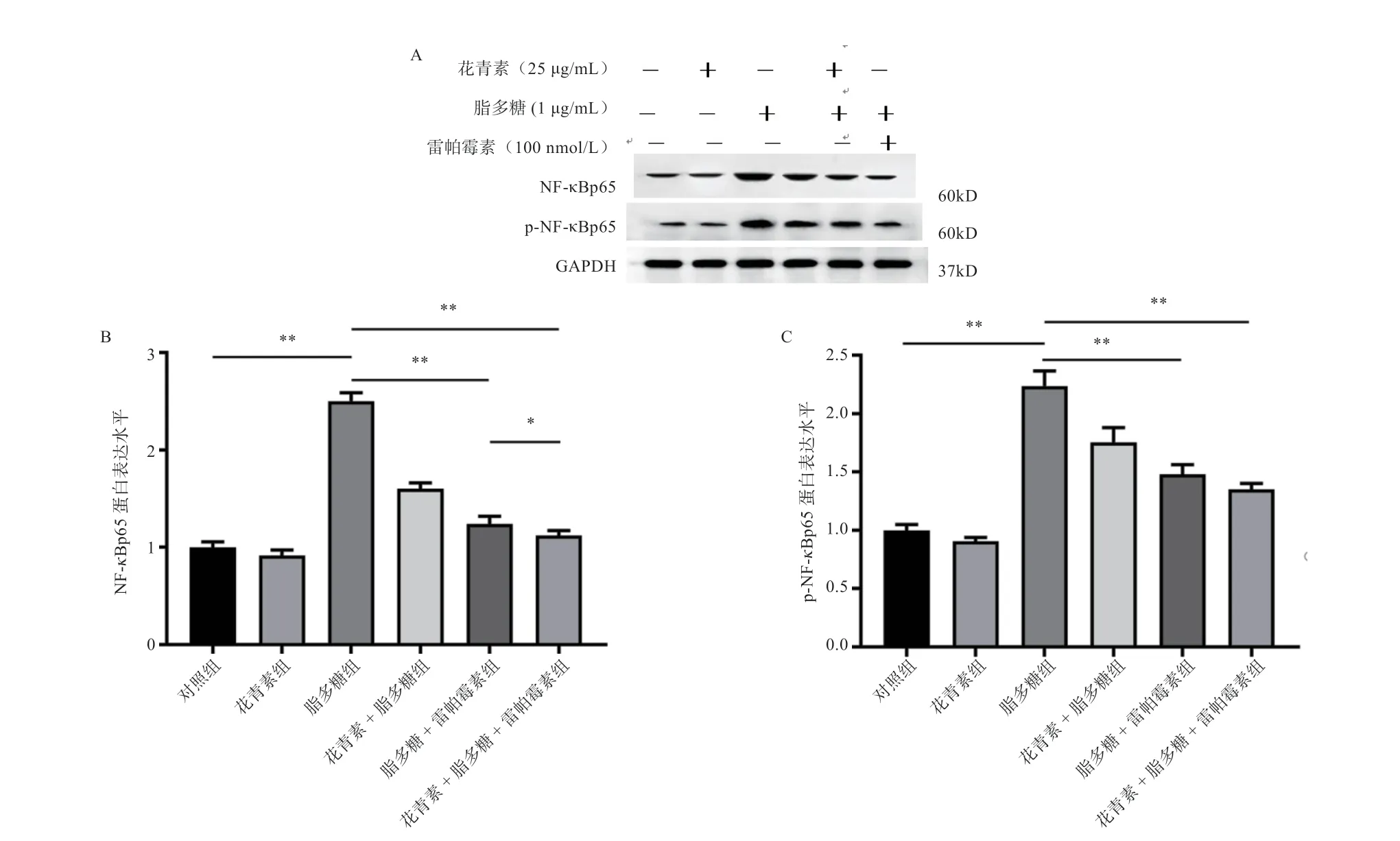
图2 阻断mTOR 通路后黑枸杞花青素对NF-κBp65 和p-NF-κBp65 蛋白表达的影响
2.2 抑制NF-κB 后黑枸杞花青素对mTOR 通路的影响
2.2.1 抑制NF-κB 后黑枸杞花青素对自噬相关因子mRNA 表达的影响 由图3 可知,与对照组相比,脂多糖组Beclin1、LC3和ULK1的mRNA 表达提高(P<0.01),mTORmRNA 表达降低(P<0.05);当NF-κB 被抑制后,与脂多糖+BAY11-7082 组对比,花青素+脂多糖+BAY11-7082 组mTOR和ULK1的mRNA表达水平降低(P<0.05)。
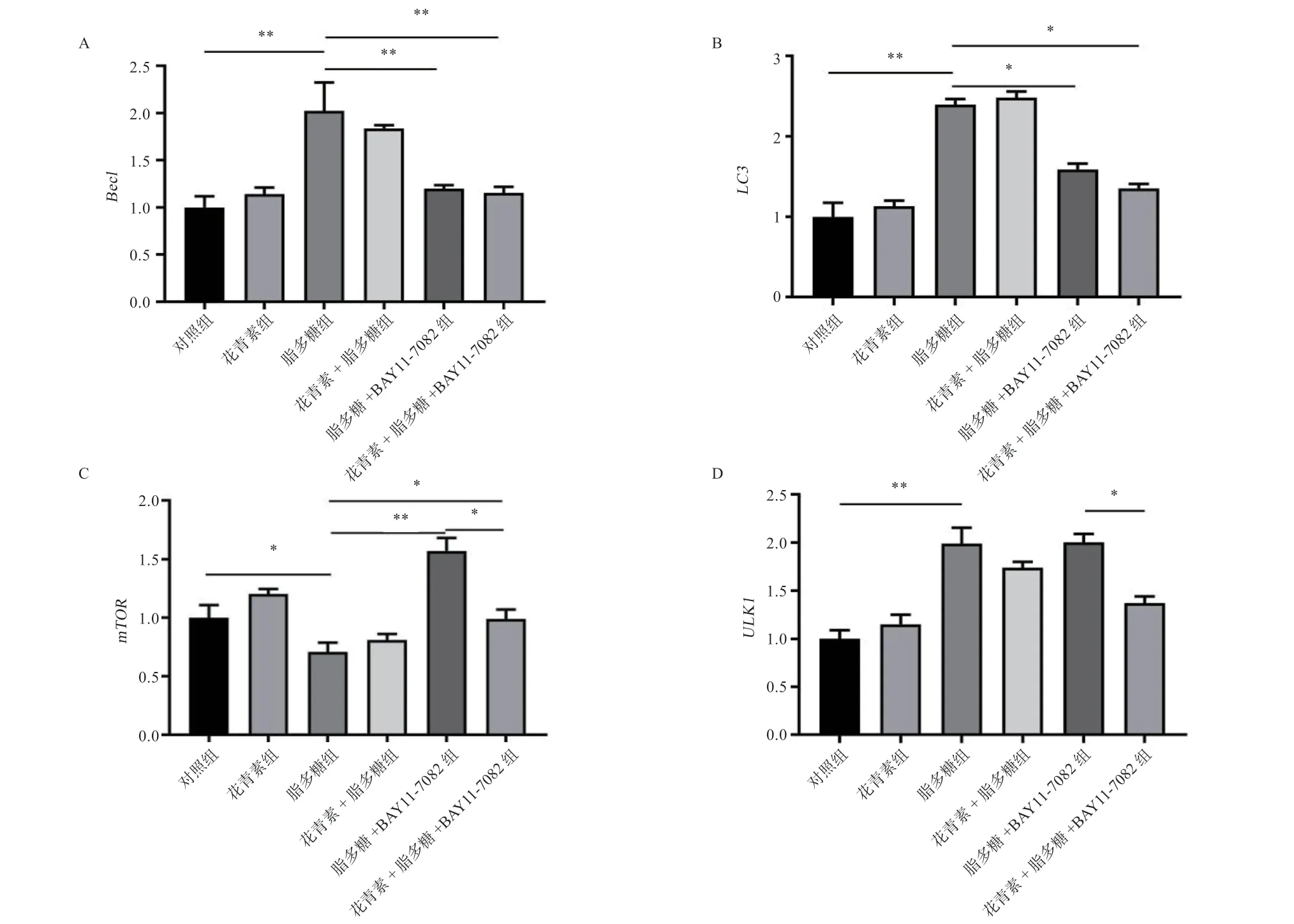
图3 抑制NF-κB 后黑枸杞花青素对自噬相关基因 mRNA 表达的影响
2.2.2 抑制NF-κB 后黑枸杞花青素对mTOR 通路关键因子蛋白表达的影响 由图4 可知,与对照组相比,脂多糖组p-mTOR 蛋白表达降低(P<0.05);当NF-κB 被抑制后,与脂多糖+BAY11-7082 组对比,花青素+脂多糖+BAY11-7082 组的p-mTOR 的蛋白表达水平降低(P>0.05)。

图4 抑制NF-κB 后黑枸杞花青素对p-mTOR 蛋白表达的影响
3 讨 论
巨噬细胞是参与机体免疫应答反应的重要成分,在多种疾病中有效发挥其吞噬作用,是机体抵御细菌感染和癌症的第一道防线。因此,巨噬细胞在启动适应性免疫应答中扮演着重要的角色并参与自身免疫性疾病、感染和炎症性疾病的发病机制[9]。LPS 为革兰阴性细菌细胞壁的主要成分,能够刺激巨噬细胞产生过量的炎症介质(如NO 和TNF-α)以及炎性细胞因子(如IL-1β和IL-6),这些物质通过与其他炎症介质的协同作用促进过敏性哮喘等炎症性疾病的发生与发展[10-12]。TLR4/NF-κB 通路是炎症信号传导途径中的重要通路之一,TLR4 被激活后可经MyD88 依赖性途径和TRIF 依赖性途径传导信号激活NF-κB,从而诱导细胞因子等免疫相关分子的表达。NF-κB 是一种核转录因子,通常以p65和p50 2 个亚基形成异二聚体的形式普遍存在于真核细胞中,其中p65 亚基磷酸化是NF-κB 活化并启动下游基因表达的必要条件[13]。NF-κB 可调控多种细胞因子的转录表达,在细胞的增殖、分化、凋亡和自噬等生命活动中发挥着重要作用。TLR4 是细胞自噬的一个感受器,自噬是TLR4 受体激活后产生的一个效应机制。自噬是巨噬细胞吞噬和清除体内病原微生物的重要调控机制,有研究[14]表明,巨噬细胞的自噬功能下降可以降低其对体内凋亡细胞吞噬的效率。mTOR 是由高度保守的丝氨酸/苏氨酸蛋白激酶组成,它的主要作用是调控细胞的生长和新陈代谢[15-16]。当细胞在营养缺乏、新陈代谢紊乱、炎症反应及外界压力的刺激下,细胞会产生相应的应激反应,mTOR 的活性会降低,同时激活细胞的自噬;当细胞营养充足时,mTOR 活性又会被激活,从而抑制细胞自噬[17]。研究发现,细胞内的信号通路之间并非是独立的,而是相互交汇的,并且形成了复杂的信号网,细胞自噬参与众多固有免疫信号的调控,在固有免疫的调控中,自噬mTOR 通路对TLR4/NF-κB 通路的调控起着重要作用[18]。Mojgan 等[19]研究发现NF-κB 的活化可抑制TNF-α 诱导的细胞自噬,这一作用与mTOR 调控信号分子有关。本试验结果显示,与对照组相比,脂多糖组上调了TLR4、NF-κB、TRAF6、MyD88、LC3、ULK1和Beclin1的mRNA 表达及NF-κBp65 和p-NF-κBp65 的蛋白表达,说明脂多糖在诱导小鼠RAW264.7 细胞发生自噬的同时也激活了TLR4/NF-κB 信号通路。当mTOR 被抑制时,脂多糖对NF-κBp65 磷酸化水平较抑制前明显降低,而在mTOR被抑制后黑枸杞花青素对NF-κBp65 磷酸化水平没有明显的影响;当TLR4/NF-κB 通路被阻断后,LPS 诱导的自噬水平较抑制前显著降低,此时黑枸杞花青素下调LC3、ULK1、Beclin1和mTOR的mRNA 表达及p-mTOR的蛋白表达。这一结果说明黑枸杞花青素具有抑制巨噬细胞自噬的功能且LPS 对TLR4/NF-κB 的激活受到mTOR 的调控,mTOR 通路可能是自噬调节炎症的免疫信号途径。
4 结 论
本试验结果显示,黑枸杞花青素对LPS 诱导的炎症具有保护作用,且TLR4/NF-κB 通路的激活受mTOR的调控,mTOR 通路可能是自噬调节炎症等免疫反应的信号途径。
