食管内镜黏膜下剥离术后大面积狭窄的危险因素分析
2021-12-16程文会宁敏曼
程文会,宁敏曼,王 忠
重庆市第五人民医院消化内科,重庆 400062)
食管癌是常见恶性肿瘤之一,其发病率和病死率均较高,患者5年生存率在5.0%以下[1]。早期食管癌临床症状不明显,患者就诊时大多已错过手术根治最佳时机,因此食管癌的早期诊疗尤为重要。随着内镜技术的发展,内镜下黏膜切除术和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)等方法逐渐在早期食管癌的治疗中广泛应用,其中ESD已成为早期食管癌的主要治疗方式之一。与内镜下黏膜切除术相比,ESD可用于全食管病变的根治性切除,从而降低局部残留及术后复发风险[2]。然而,ESD后往往会发生食管狭窄,其主要病理生理过程涉及黏膜保护屏障被破坏、炎症、组织重塑等[3],黏膜缺损>3/4食管圆周是狭窄发生的预测因素[4]。食管狭窄会导致患者不同程度的吞咽困难,严重时会出现呕吐、体质量下降、病情恶化等,极大降低了患者的生活质量,也影响ESD的临床效果。目前关于早期食管癌ESD后食管大面积狭窄的影响因素研究较少,导致临床上对于何种情况下需要进行食管ESD后大面积狭窄的预防尚无统一指导意见。本研究回顾性分析我院经内镜及病理诊断为早期食管癌并行ESD治疗的158例患者的临床资料,探讨食管ESD后大面积狭窄的危险因素,以期为临床治疗提供参考。
1 资料与方法
1.1 临床资料
回顾性分析2018年1月至2020年1月于我院行ESD的158例早期食管癌患者的临床资料,将其作为训练集,并将术后发生食管大面积狭窄的患者记为狭窄组,未发生狭窄的患者记为未狭窄组。另选择2017年2月至2019年4月于我院行ESD治疗的76例早期食管癌患者作为验证集。训练集和验证集患者年龄、性别、病变相关因素、操作相关因素等临床资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。纳入标准:①行ESD治疗并成功剥离食管病变;②术后经内镜及病理诊断为低级别或高级别上皮内瘤变;③肿瘤浸润深度不超过SM1(黏膜下层<200 μm)。排除标准:①术后追加外科手术或放化疗等其他治疗;②失访,临床资料不全;③处于妊娠期或哺乳期。本研究经我院医学伦理委员会批准(2020-047),所有患者均签署手术知情同意书。

表1 训练集和验证集患者的临床资料比较
1.2 方法
1.2.1 术前评估及准备 对术前活检提示为食管高级上皮内瘤变或早期食管癌病变进行内径窄带成像检查及放大观察,评估病变性质及浸润深度等,并使用1.5%卢戈氏液染色确定病变范围。采用超声内镜检查肿瘤局部侵犯及淋巴结转移情况。
1.2.2 ESD操作 使用Dual刀、Flex刀或海博刀在距离病变约0.5 cm处对病变进行环周标记。在透明帽辅助下,于病变标记点外侧,使用注射针于黏膜下多点注射肾上腺素生理盐水或甘油果糖+靛胭脂或亚甲蓝混合液,并逐渐剥离病变,直至完整剥离病变,若有出血则确认出血点,使用电刀、止血钳等进行充分止血。病变完整剥离后取出,测量创面长度,并使用止血钳进行严密止血。
1.2.3 术后标本处理 使用大头针将切下来的病变组织固定在平板上,甲醛固定并送病理检查。
1.3 随访
患者于术后3、6、12个月定期门诊随访,以后每年随访1次。记录是否发生狭窄、狭窄后处理方法等。若患者在随访期间出现食管大面积狭窄或其他不适,则可随时来院治疗。随访至2021年4月或患者死亡。
1.4 观察指标
记录患者性别、年龄、高血压、糖尿病、吸烟史、饮酒史、内镜下形态、病变位置、肿瘤浸润深度、切除情况、剥离环周范围、剥离纵径长度、术中止血夹数量、固有肌层是否损伤、黏膜下注射液、术后口服激素等可能导致患者术后食管大面积狭窄的因素。
食管ESD后大面积狭窄判定标准[5]:患者出现吞咽困难或标准内镜(直径9.8 mm)难以通过狭窄处。术后食管大面积狭窄程度分级[6]:Ⅰ级,食管直径0.6~1.0 cm,可进半流质饮食;Ⅱ级,食管直径0.3~0.5 cm,可进流质饮食;Ⅲ级,食管直径<0.3 cm,难以进流质饮食。
1.5 统计学方法
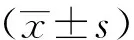
2 结果
2.1 术后食管大面积狭窄发生情况
训练集患者中发生术后食管大面积狭窄112例(70.89%),其中Ⅰ级狭窄24例(21.43%),Ⅱ级狭窄49例(43.75%),Ⅲ级狭窄39例(34.82%)。
2.2 术后食管大面积狭窄发生的单因素分析
狭窄组与未狭窄组患者肿瘤浸润深度、剥离环周范围、剥离纵径长度、固有肌层损伤、术中止血夹数量比较,差异具有统计学意义(P<0.05),见表2。
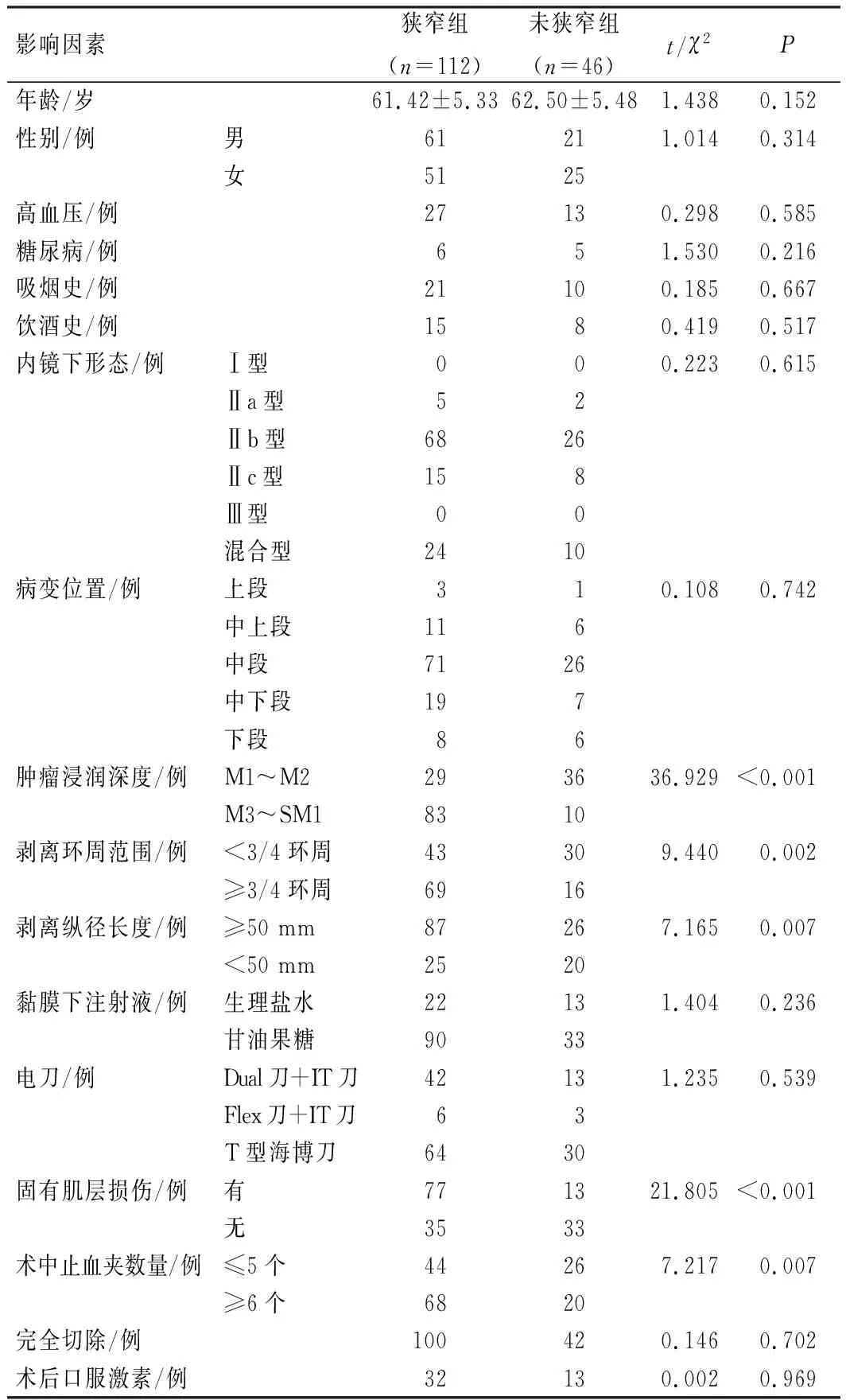
表2 患者术后食管大面积狭窄发生的单因素分析
2.3 术后食管大面积狭窄发生的多因素分析
对单因素分析中差异有统计学意义的变量进行赋值:肿瘤浸润深度,M3~SM1=1,M1~M2=0;剥离环周范围,≥3/4环周=1,<3/4环周=0;剥离纵径长度,≥50 mm=1,<50 mm=0;固有肌层损伤,有=1,无=0;术中止血夹数量,≥6个=1,≤5个=0。将术后是否发生食管大面积狭窄作为因变量并赋值:狭窄=1,未狭窄=0。Logistic回归分析结果表明,肿瘤浸润深度为M3~SM1、剥离环周范围≥3/4环周、剥离纵径长度≥50 mm、固有肌层损伤、术中止血夹数量≥6个是食管ESD后大面积狭窄发生的独立危险因素(P<0.05),见图1。
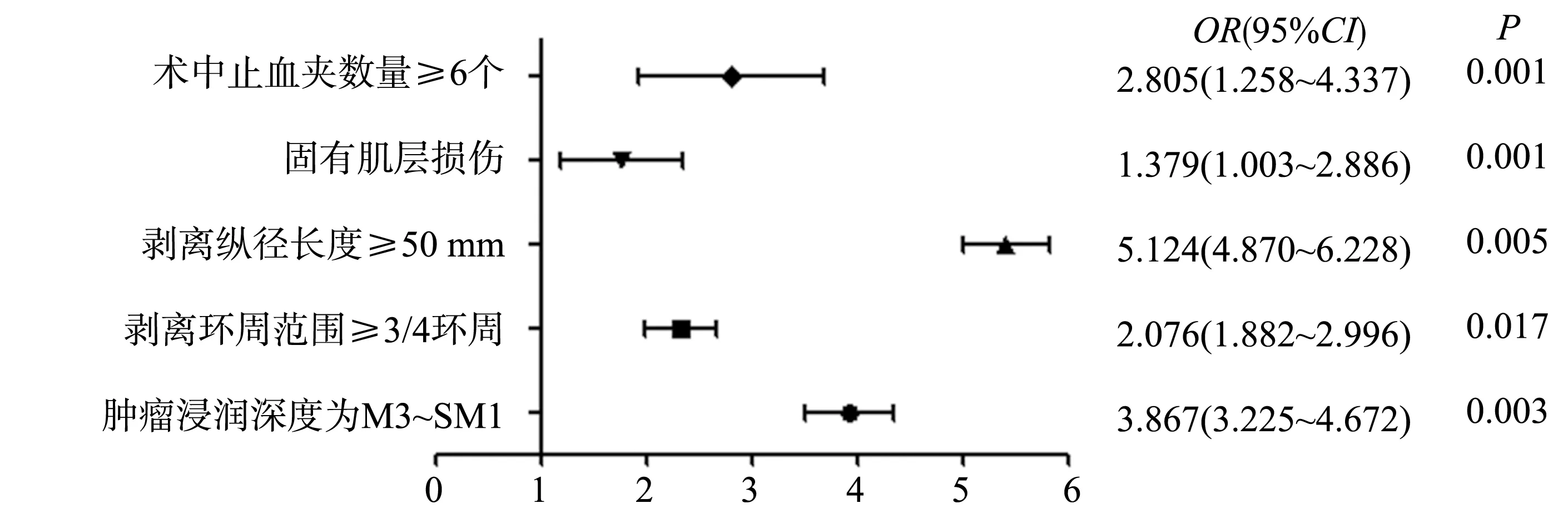
图1 食管ESD后大面积狭窄发生的多因素分析模型森林图
2.4 列线图预测模型的建立
将上述5个独立危险因素纳入预测模型后建立食管ESD后大面积狭窄发生风险的个体化列线图预测模型。从该模型可得出每个预测指标对应的分数值,相加得出总分,与总分相对应的预测概率即为食管ESD后大面积狭窄发生的风险。建立的列线图模型显示:肿瘤浸润深度为M3~SM1的评分为13.6分,剥离环周范围≥3/4环周为36.7分,剥离纵径长度≥50 mm为40.3分,固有肌层损伤为36.1分,术中止血夹数量≥6个为24.8分,总分为151.5分,该分数预测食管ESD后大面积狭窄的发生率为69.74%,见图2。
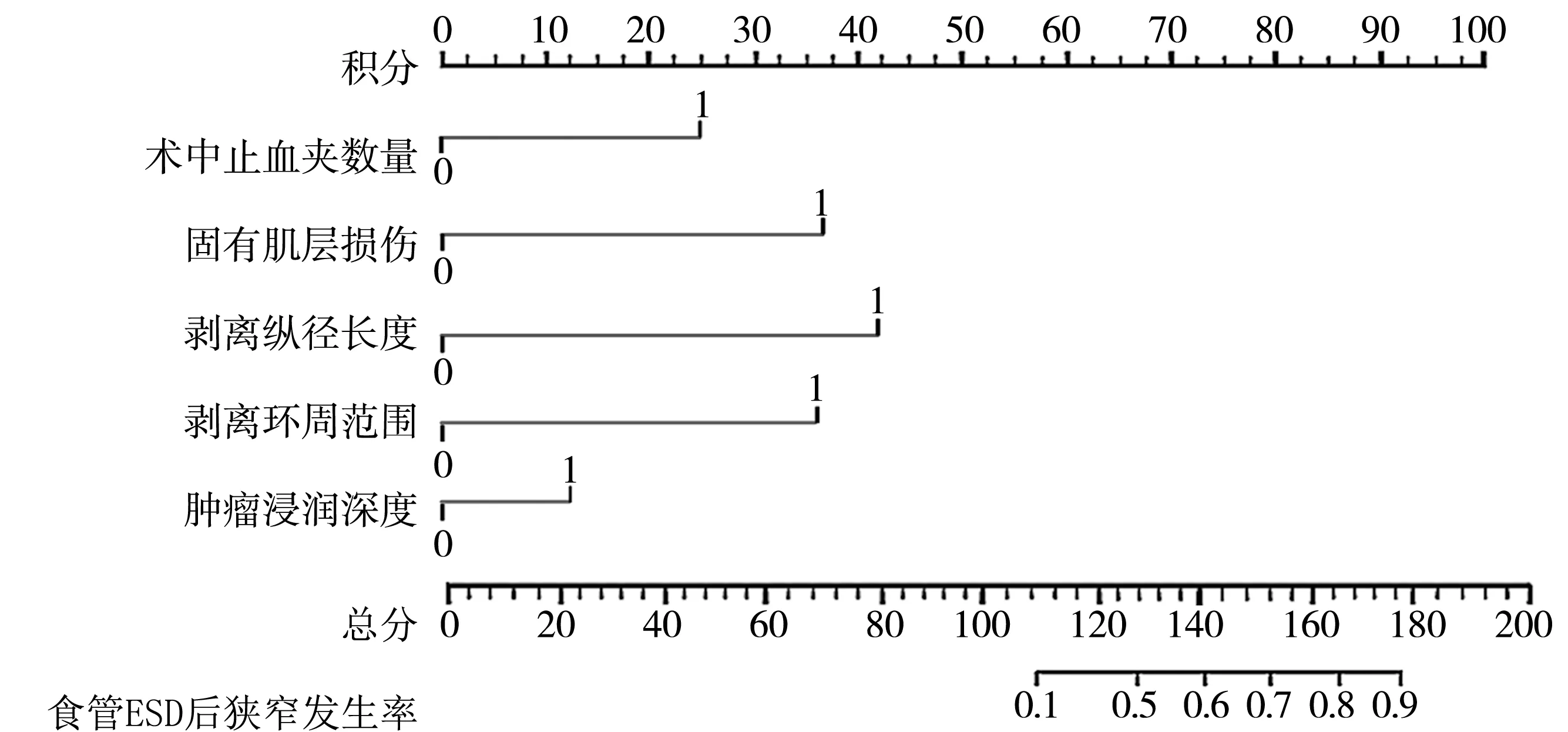
图2 食管ESD后大面积狭窄发生风险的列线图预测模型
2.5 预测模型区分度验证
通过ROC曲线,训练集患者AUC为0.882(95%CI:0.820~0.955),临界值为30.4%,P<0.001;C-index为0.882。验证集患者AUC为0.878(95%CI:0.774~0.928),P<0.001;C-index为0.878。预测模型在训练集和验证集中的C-index均>0.75,见图3。

图3 预测模型在训练集和验证集中的ROC曲线
2.6 预测模型校准度验证
预测模型在训练集和验证集中的GiViTI校准曲线带的80%~95%置信区间区域均未穿过45°角平分线,差异无统计学意义(P>0.05),见图4。对预测模型进行Hosmer-Lemeshow拟合优度检验:训练集中χ2=6.804,P=0.581;验证集中χ2=3.429,P=0.716,差异无统计学意义(P>0.05)。
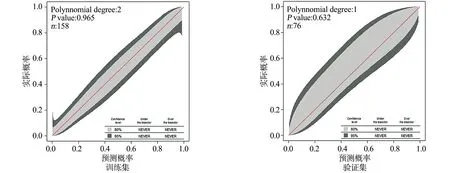
图4 预测模型在训练集和验证集中的校准度
2.7 预测模型临床有效性验证
预测模型在训练集和验证集的DCA曲线中:当阈值概率分别在9%~90%及2%~99%时,患者净获益均比另外2条极端曲线高,在该范围内模型具有临床有效性。通过训练集患者的ROC曲线分析得到的临界值(30.4%)同时在DCA曲线阈值概率范围内,因此该模型具有临床有效性。进一步分析可知:当食管ESD后大面积狭窄发生并采取干预措施的阈值概率设置为30.4%时,在训练集和验证集人群中,每100例运用此模型诊断食管ESD后大面积狭窄发生风险的患者分别有31例(31%)和35例(35%)能从中获益而不损害其他人利益,见图5。
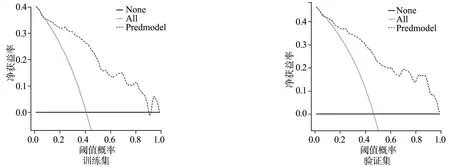
None:假定所有患者术后均未发生食管大面积狭窄,均不治疗,净获益为0;All:所有患者均在术后发生食管大面积狭窄,均接受治疗,净获益为一条斜率为负值的反斜线
3 讨论
ESD是内镜下治疗早期食管癌的有效手段,食管大面积狭窄作为ESD后主要并发症,严重影响患者术后生活质量。目前关于食管狭窄的定义报道不一。我国《中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)》[7]将食管狭窄定义为内镜切除术后需内镜下治疗的食管管腔狭窄,伴有不同程度的吞咽困难,多在术后1个月出现。而其他文献中关于食管狭窄的定义为前端直径9.8 mm的标准胃镜不能通过狭窄部,常伴有吞咽困难[8]。以往研究显示,早期食管癌患者行ESD后食管大面积狭窄发生率为25%~76%[9],本研究术后食管大面积狭窄发生率为70.89%,均提示该并发症发生率较高。因此,临床上应重视早期食管癌术后食管大面积狭窄的影响因素,从而更有效地指导临床预防食管ESD后大面积狭窄。
本研究结果显示,剥离环周范围≥3/4环周是食管ESD后大面积狭窄的独立危险因素。既往有研究报道,剥离环周范围<1/2管腔环周时,术后食管狭窄率极低;剥离环周范围为管腔环周的1/2~3/4时,术后食管狭窄率为5%~29%;剥离环周范围≥3/4环周时,术后食管狭窄率为75%~100%,提示剥离环周范围与ESD后食管狭窄密切相关[10]。分析原因可能是黏膜环周缺损可引起急性炎症,诱发食管黏膜下纤维结缔组织增生,使得食管壁纤维化,最终导致食管狭窄,且剥离环周范围越大,ESD后食管狭窄发生风险也越大。本研究结果显示,肿瘤浸润深度为M3~SM1是食管ESD后大面积狭窄的独立危险因素,与唐健等[11]报道相符。组织浸润深度越深,环周缺损范围越大,纤维化程度越严重,ESD后食管狭窄程度越高[12]。有研究发现,食管ESD后大面积狭窄的发生与黏膜剥离纵径呈正相关[13],孙仁虎等[14]进一步研究发现创面剥离纵径长度>50 mm是ESD后发生食管狭窄的重要因素,本研究结果亦显示剥离纵径长度≥50 mm是食管ESD后大面积狭窄的独立危险因素。原因可能为术中热损伤、食管黏膜层纤维细胞变化及术后炎症反应促进瘢痕形成是管腔狭窄的发生机制,而剥离纵径长度≥50 mm可能通过促进瘢痕形成,扩大纤维化的范围,从而导致管腔狭窄[15]。因此,对于食管大面积狭窄高危患者,ESD应在保证病变完全切除的基础上缩短黏膜剥离的纵径长度。有研究发现,ESD后狭窄不仅与纤维化增生相关,还与固有肌层的改变有关[16]。Honda等[17]发现内镜下黏膜切除术中即使没有破坏固有肌层,在术后7 d仍会出现固有肌层萎缩,术后28 d出现固有肌层纤维化,因此其认为术后食管狭窄与固有肌层的萎缩、纤维化有关。Takahashi等[18]在分析临床食管ESD后狭窄病例时发现,固有肌层损伤是发生ESD后食管狭窄的关键危险因素。本研究结果显示,固有肌层损伤是食管ESD后大面积狭窄的独立危险因素,可能是因为术中固有肌层损伤会加重后期固有肌层纤维化,所以术中应避免固有肌层损伤,以减少术后食管大面积狭窄的发生。另外,本研究结果还显示,术中止血夹数量≥6个是食管ESD后大面积狭窄发生的独立危险因素,由于止血夹会影响创面愈合,特别是数量过多时可能会限制黏膜上皮生长并引起过度纤维化,但关于术中止血夹数量对食管ESD后狭窄的影响鲜有报道,因此该结论尚需进一步研究证明。
目前,临床上尚缺乏对食管ESD后大面积狭窄发生的列线图预测模型的相关研究。本研究通过建立列线图预测模型,根据患者手术前后的实验室检查和影像学检查预测食管ESD后大面积狭窄的发生率,结果显示,将ROC曲线的临界值30.4%作为DCA曲线的阈概率值时,患者的临床净获益率均高于不采取干预以及全部采取干预的两种极端方式,提示当模型预测出患者食管ESD后大面积狭窄发生风险高于30.4%时,若立即干预,会使患者从临床中获益,低于30.4%时可暂时不干预,这有助于ESD后制定患者的临床治疗方案。关于食管ESD后大面积狭窄,目前临床尚无统一的预防策略。以往研究表明,激素对食管ESD后狭窄有一定的预防效果,但长期使用糖皮质激素易引起患者血糖代谢紊乱,诱发或加重感染等[19]。本研究结果显示,口服激素对降低食管ESD后大面积狭窄的发生率并无显著效果,与以往研究结果一致[11]。
综上所述,肿瘤浸润深度为M3~SM1、剥离环周范围≥3/4环周、剥离纵径长度≥50 mm、固有肌层损伤、术中止血夹数量≥6个是食管ESD后大面积狭窄发生的独立危险因素,对于此类患者,应提前告知患者术后发生狭窄的风险并考虑早期干预。
