沉默PROX1基因对甲状腺乳头状癌TPC-1细胞的影响
2021-12-16张晨曦张苗苗孙小莉韩晨博
刘 菲,张晨曦,张苗苗,孙小莉,韩晨博,王 佳
(1.宝鸡市妇幼保健院病理科,陕西 宝鸡 721000;2.宝鸡市妇幼保健院综合外科,陕西 宝鸡 721000;3.西安市人民医院病理科,陕西 西安 710000)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)在甲状腺癌中最为常见。随着外科技术及放化疗技术的发展,PTC患者的10年生存率可达74%~95%,但是复发和远处转移仍然是PTC患者死亡的主要原因[1]。因此,寻找潜在的PTC分子生物学标志物是临床及基础研究的重点。
prospero相关同源异形盒蛋白1(prospero-related homeobox 1,PROX1)是果蝇的同源异型盒基因prospero在哺乳动物中的同源框基因转录因子,在淋巴管的形成和发育中发挥重要作用[2]。越来越多的研究证实,PROX1在脑胶质母细胞瘤、乳腺癌和肝细胞癌等肿瘤组织中高表达,并参与肿瘤的发生发展[3-5]。Notch1是PROX1下游的信号通路[6],在PTC的发生发展中起重要作用[7]。TPC-1是甲状腺乳头状癌细胞,在PTC体外研究中应用广泛[8]。为了探索PROX1在PTC中的表达及意义,本研究检测PTC细胞系TPC-1、BCPAP、K1、IHH4中PROX1的表达,利用RNA干扰技术抑制TPC-1细胞中PROX1的表达,观察TPC-1细胞增殖、侵袭、凋亡及Notch1信号通路相关蛋白表达水平的变化。
1 材料与方法
1.1 材料和仪器
PTC细胞系BCPAP、TPC-1、K1、IHH4和正常甲状腺滤泡上皮细胞系Nthy-ori-3-1均购于中科院上海细胞库,DMEM培养基和胎牛血清购于南京生航生物技术有限公司,质粒由上海吉凯基因科技有限公司设计并提供,LipofectamineTM2000转染试剂盒购于美国Promega公司,CCK-8试剂盒、Annexin V-FITC/PI凋亡检测试剂盒和Transwell小室均购于上海沪震实业有限公司,PROX1、hes1、hes5、NICD和GAPDH抗体均购于美国Sigma公司。仪器:IX71型倒置显微镜(奥林巴斯,日本)、680型酶标仪(Bio-Rad,美国)、AlphaImager Mini型凝胶成像仪(ProteinSimple,美国)、FACSCanto Ⅱ型流式细胞仪(BD,美国)。
1.2 细胞培养及转染
将BCPAP、TPC-1、K1、IHH4、Nthy-ori-3-1细胞接种于含10%胎牛血清的DMEM培养基中,置于5% CO2、37 ℃恒温箱中培养。待细胞融合度达80%时进行传代,取5~15代对数生长期细胞进行后续实验。将TPC-1细胞随机分为NC-siRNA组和PROX1-siRNA组,用LipofectamineTM2000转染NC-siRNA和PROX1-siRNA。NC-siRNA序列:5’-GGACGGGAAGUUAGACAAAGA-3’;PROX1-siRNA序列:5’-GGAAGUUAGACAAAGAUGAGA-3’。转染步骤严格按照试剂盒说明书进行。
1.3 Western blot检测PROX1、hes1、hes5、NICD蛋白表达水平
转染48 h后用RAPI裂解液提取总蛋白,10% SDS-PAGE分离蛋白,用半干转移法将蛋白转至PVDF膜。5%脱脂奶粉封闭2 h,加入PROX1(1∶500)、hes1(1∶1 000)、hes5(1∶1 000)、NICD(1∶1 000)和GAPDH(1∶1 000)一抗,4 ℃孵育过夜,次日除去一抗,用TBST缓冲液洗涤3次后加入二抗(羊抗兔,1∶500),封闭1 h。最后用ECL法显色,凝胶成像系统拍照,用Image J软件分析灰度值。
1.4 CCK-8法检测细胞增殖能力
转染48 h后取对数生长期细胞,接种于96孔板。待细胞贴壁后,分别于培养24 h、48 h、72 h和96 h时加入10 μL CCK-8溶液,孵育2 h后用酶标仪检测光密度OD值,检测细胞增殖能力。设置5个复孔。
1.5 Transwell实验检测细胞侵袭能力
在Transwell小室的上室铺基质胶,随后将TPC-1细胞接种于24孔板,以2×105/mL密度将细胞加入上室,每孔加量100 μL;下室中加入培养基,每孔加量250 μL。待细胞贴壁后更换上室培养液,继续培养24 h。用无菌棉签拭去小室滤膜上的细胞,甲醛固定15 min,HE染色,光镜下统计膜背面侵袭的细胞数。设置5个复孔。
1.6 细胞划痕实验检测细胞迁移能力
取转染后细胞,以5×104个/孔密度将TPC-1细胞接种于6孔板,当细胞融合度达90%时,用无菌枪头进行划痕处理,随后置于无血清培养基中继续培养。培养0 h、24 h时用显微镜拍照,并计算细胞迁移率,细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%[8]。设置5个复孔。
1.7 Annexin V-FITC/PI流式细胞术检测凋亡细胞
取转染后细胞,用500 μL预冷1×结合缓冲液将其制成1×106/mL的悬液。加入5 μL异硫氰基荧光素,混匀后孵育10 min。随后加入2.5 μL碘化丙啶孵育5 min。用流式细胞仪检测细胞凋亡率。设置5个复孔。
1.8 统计学方法
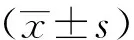
2 结果
2.1 PROX1在PTC细胞系中的表达
与正常甲状腺滤泡上皮细胞系Nthy-ori-3-1比较,PTC细胞系TPC-1、BCPAP、K1和IHH4中PROX1蛋白表达水平明显较高(F=36.989,P<0.05),其中TPC-1最高,见图1。

*:与Nthy-ori-3-1比较,P<0.05
2.2 沉默PROX1基因对TPC-1细胞增殖、侵袭、迁移和凋亡的影响
与NC-siRNA组比较,PROX1-siRNA组PROX1蛋白表达水平较低(t=19.012,P<0.05),48 h、72 h和96 h时细胞增殖活力OD值较低(t=6.034,P<0.05),侵袭细胞数较少(t=10.012,P<0.05),细胞迁移率较低(t=6.783,P<0.05),细胞凋亡率较高(t=7.783,P<0.05),见图2。

a:Western blot检测细胞中PROX1蛋白表达水平;b:CCK-8法检测细胞增殖能力;c:Transwell实验检测细胞侵袭能力(HE染色,×100);d:Annexin V-FITC/PI流式细胞术检测细胞凋亡;e:细胞划痕实验检测细胞迁移能力 *:与PROX1-siRNA组比较,P<0.05
2.3 沉默PROX1基因对TPC-1细胞Notch1信号通路相关蛋白表达的影响
与NC-siRNA组比较,PROX1-siRNA组hes1(t=6.781,P<0.05)、hes5(t=4.290,P=0.05)和NICD(t=8.342,P<0.05)蛋白表达水平较低,见图3。

*:与NC-siRNA组比较,P<0.05
3 讨论
PROX1在癌症的发生和发展中起着重要作用[9-11],但其作用机制尚未完全明确。有研究显示,PROX1可以结合并抑制基质金属蛋白酶-14的表达,从而促进肝细胞癌的血管生成和肿瘤侵袭[12]。PROX1还能够促进核小体重塑,形成去乙酰化酶复合物,进而促进结直肠癌细胞的增殖[6]。另外,PROX1与免疫炎症损伤密切相关[13]。还有研究显示,PROX1高表达于淋巴管内皮细胞,进而参与肿瘤淋巴管新生和淋巴转移[13-14]。PROX1在甲状腺滤泡状癌和髓样癌中高表达[15-16],但PROX1在PTC中的表达以往少有报道。因此,本研究检测PTC细胞系TPC-1、BCPAP、K1、IHH4中PROX1的表达,探讨PROX1在PTC中的表达及意义。
本研究结果显示,与正常甲状腺滤泡上皮细胞系Nthy-ori-3-1比较,PTC细胞系TPC-1、BCPAP、K1和IHH4中PROX1蛋白表达水平明显较高。沉默PROX1表达后TPC-1细胞的增殖、侵袭、迁移均受到抑制,且细胞凋亡率升高,说明PROX1可能作为促癌基因在PTC中发挥作用。Notch1信号通路在甲状腺癌的发生和发展中起着重要作用,其可通过DLL4参与PTC肿瘤血管生成,并通过激活MAPK信号通路促进PTC癌细胞的增殖和侵袭[17-18]。Notch1是PROX1的下游信号通路[6],抑制TPC-1细胞中Notch1的表达可以明显抑制PTC细胞的增殖、侵袭和迁移[18-19]。本研究结果显示,沉默PROX1基因可以明显抑制Notch1信号通路相关蛋白hes1、hes5和NICD的表达,提示沉默PROX1基因可能通过抑制Notch1信号通路抑制TPC-1细胞的增殖、侵袭、迁移,并促进其凋亡。
综上所述,PROX1在PTC细胞中高表达,可能成为PTC的分子生物学标志物。本研究也存在一些局限性,如未检测PTC组织及血清中PROX1的表达,未分析PROX1与PTC临床病理特征和预后的关系,未来需要进一步分析PTC组织中PROX1的表达及其临床意义。
