基于LAMP技术检测速冻肉糜类制品中单增李斯特菌的增菌方法研究及应用
2021-12-16岳慧敏李海鑫罗瑞平
岳慧敏,李海鑫,罗瑞平,赵 亮,4,
(1.中国农业大学食品科学与营养工程学院, 北京 100083;2.中国农业大学(兴化)健康食品产业研究院, 江苏兴化 225700;3.泰州安井食品有限公司, 江苏兴化 225700;4.食品质量安全北京实验室, 食品科学与营养工程学院, 中国农业大学, 北京 100083)
速冻肉糜类制品即我们熟知的“火锅料制品”,是速冻调制食品中的一大类别,其主要原料为畜禽肉、水产品及其制品[1-3]。我国是速冻肉糜类制品产销大国,其市场销售规模由2010年160亿元提升至2017年近273亿元,复合年均增长率为8%[4]。随着食物结构和食物消费的变化,速冻肉糜类制品市场规模还将不断扩大[5]。然而速冻肉糜类制品在加工过程热处理强度低且储运过程需要冷链支持,具有较高的微生物污染风险[6-7]。研究发现,单核细胞增生李斯特氏菌是速冻肉糜类制品中的主要食源性致病菌,据调查显示,此类产品的原料污染率高,生肉中单增李斯特菌检出率为19.1%[8],海产品中检出率为31%[9]。在生产、食用过程中加热不足则易存活,引发食物中毒[10-12]。因此开展单增李斯特菌的检测对速冻肉糜类制品安全保障具有重要意义[13-15]。
目前我国常用的检验方法是传统培养检测法,该方法准确度高,但其操作复杂,检测时间长,检测结果滞后性不能满足食品中,尤其是加工环节样本的单增李斯特菌的快速检测和追溯[15-16]。因此需要建立一种速冻肉糜类制品中单增李斯特菌的快速检测方法。检测食品中单增李斯特菌的快速检测方法有聚合酶链式反应(PCR)、环介导等温扩增技术(LAMP)、酶联免疫吸附法(ELISA)及相关改良方法等。其中,环介导等温扩增技术(Loop-mediated isothermal amplification),简称LAMP,具有快速简便、成本低、特异性强等优点[17-19],已在食源性致病菌的快速检测中得到广泛应用[20-25]。对于食品中单增李斯特菌的LAMP检测,在乳制品[26]、生鸡肉样品中[27]已有报道,然而针对速冻肉糜类制品的研究甚少。作为一种速冻调理肉制品,其中复杂成分对增菌、DNA提取、后续LAMP反应的影响尚不明确。本研究基于已建立的速冻肉糜类制品单增李斯特菌LAMP检测技术基础上,通过四种增菌培养基的比较,筛选出一种增殖效果最佳的增菌培养基,以降低LAMP方法的检出限,并实现单增李斯特菌LAMP检测方法在速冻肉糜类制品中的应用,预期一个工作日完成检测,以期为食品企业快速检测速冻肉糜类制品中单増李斯特菌提供技术支撑。
1 材料与方法
1.1 材料与仪器
单核细胞增生李斯特氏菌(Listeria monocytogenes,FSCC 178006/ATCC 19115 ) 广东环凯微生物科技有限公司;细菌基因组DNA提取试剂盒、SYBR Green I (10000×)、6×DNA 电泳 Loading Buffer 北京天根生化科技有限公司;含0.6%酵母膏的胰酪胨大豆肉汤(TSB-YE)、李氏菌增菌肉汤(LB1,LB2)基础、Half-Fraser培养基、Fraser培养基
青岛海博生物技术有限公司;Bst 2.0 DNA Polymerase(8000 U/mL)、dNTP Mixture、Gelred核酸染料、DEPC水 北京言必信科技有限公司;鸡小胸原料、亲亲肠(速冻机入口处)、亲亲肠(速冻机出口处)、包心鱼丸(速冻机入口处)、包心鱼丸(速冻机出口处) 样本采集自速冻肉糜类制品工厂生产线;速冻肉糜类样品 具体采样信息如表1所示。
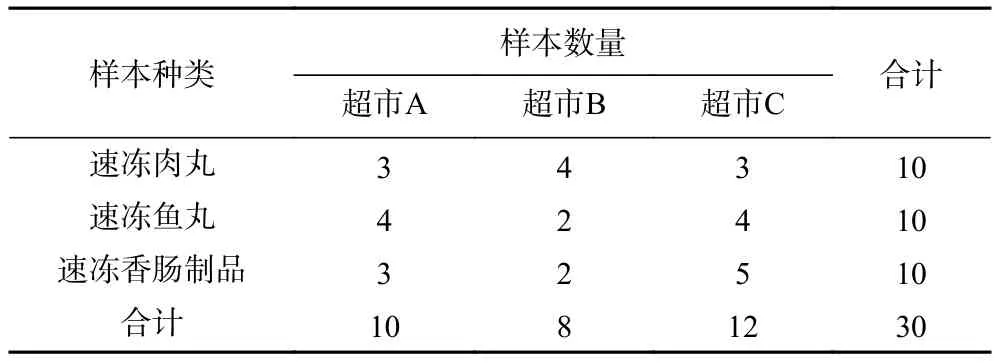
表1 样本种类及数量Table 1 Type and number of samples
1300 SERIES A2生物安全柜 美国Thermo Fisher Scientific公司;ZDX35BI自动高压蒸汽灭菌器 上海申安医疗器械厂;THZ-C恒温振荡器 江苏太仓市实验设备厂;DNP-9082电热恒温培养箱、DK-S24电热恒温水浴锅 上海精宏实验设备有限公司;Infinite®M200 Pro多功能酶标仪 瑞士TECAN公司;SILVER拍击式均质机 西班牙IUL公司;165-8001电泳仪、Sub-Cell®GT水平电泳槽 美国Bio-rad公司;ChampGel 5000全自动凝胶成像仪 北京赛智创业科技有限公司。
1.2 实验方法
1.2.1 菌株培养 将-80 °C保藏的甘油菌种用TSBYE液体培养基活化,于恒温振荡器中37 °C,220 r/min培养8 h,连续活化至第三代作为实验用培养液。
1.2.2 人工污染不同浓度菌液样品的制备 用于人工污染的速冻肉糜类样品经GB 4789.30-2016检测证实不含有单增李斯特菌。在生物安全柜中无菌操作,取速冻肉糜类样品25 g加入到含225 mL的TSB-YE 液体培养基的均质袋中,在拍击式均质机上连续均质2 min,此溶液即为速冻肉糜类样品均质液。
依据国标和ISO标准[28],本实验选用LB1、LB2、Fraser和Half-Fraser四种增菌培养基作为筛选对象,将已知浓度的初始菌液(6.4×109CFU/mL)通过10倍梯度稀释,首先制备浓度分别为6.4×104~6.4×102CFU/mL的菌液。
然后取上述不同浓度的初始菌液1 mL分别加入到9 mL速冻肉糜类样品均质液中,混合均匀后分别接种到 90 mL四种增菌培养基中,使增菌培养基中的菌液终浓度分别大于102CFU/mL(640 CFU/mL)、101CFU/mL(64 CFU/mL)、小于10 CFU/mL(6.4 CFU/mL),于恒温振荡器中 37 °C培养。
以OD600nm值和平板计数活菌数为检测指标,在2、4、6、8 h监测目标菌的生长情况。
1.2.3 基因组 DNA 提取 使用细菌基因组提取试剂盒(TIANGEN)提取DNA,按照说明书进行操作。
1.2.4 LAMP反应操作程序 LAMP反应体系:外引物:内引物浓度比 1:4,Mg2+浓度为 6 mmol/L,dNTPs浓度 1.4 mmol/L,Bst DNA聚合酶浓度为800 U/mL,DNA 模板,无酶无菌水,体系 25 μL。选择hly A基因作为靶基因[29],引物序列如表2所示。
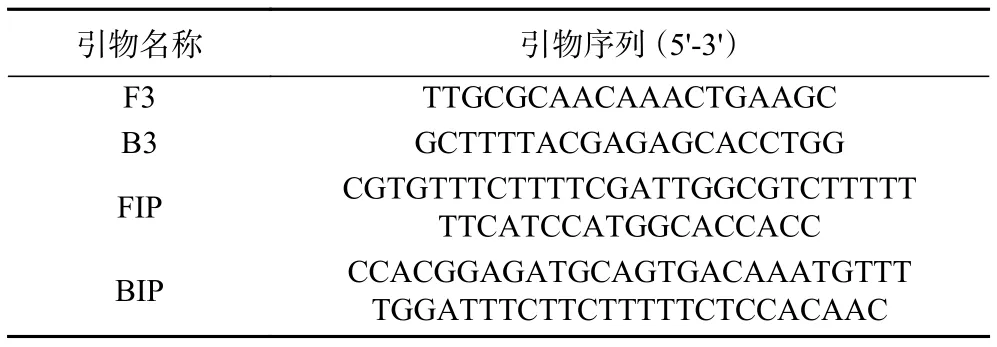
表2 LAMP引物序列[29]Table 2 Sequences of LAMP primers[29]
加入各反应物于200 μL离心管中,混合均匀,在 61 °C 恒温水浴锅中反应 40 min。取产物 5 μL与1 μL Loading Buffer混合均匀,进行1.2%琼脂糖凝胶电泳观察特征性电泳图谱,同时在产物中加入1 μL SYBR Green I荧光染料[30],观察颜色变化。
1.2.5 增菌时间的确定 当接种量为64 CFU/mL时,在Half Fraser培养基增菌过程中,分别取0、2、4、6、8 h的菌液,提取DNA模板后,LAMP方法检测,以电泳检测出现梯形条带及SYBR Green I 荧光染料呈现阳性绿色为检测指标,确定该方法的最短增菌时间。
1.2.6 增菌优化前LAMP检出限评价 将已知浓度的初始菌量(6.4×109CFU/mL)通过10倍梯度稀释,使菌液浓度分别为 6.4×109~6.4×101CFU/mL,分别污染到速冻肉糜类样品中,模拟食物中的初始菌量分别为6.4×109~6.4×101CFU/g,分别提取其基因组DNA,进行LAMP扩增。将产物进行琼脂糖凝胶电泳,观察是否产生梯形条带,同时进行SYBR Green I颜色反应,探究增菌优化前LAMP方法的检出限。
1.2.7 增菌优化后LAMP检出限评价 将已知浓度的初始菌量(6.4×109CFU/mL)通过10倍梯度稀释,使菌液浓度分别为 6.4×108~6.4×100CFU/mL,分别污染到速冻肉糜类样品中,模拟食物中的初始菌量分别为 6.4×108~6.4×100CFU/g。再分别接种于增菌培养基中(依据国标,样品与增菌培养基比例按1:9添加),均质后于37 °C增菌6 h,分别提取其基因组DNA,进行LAMP扩增。将产物进行琼脂糖凝胶电泳,观察是否产生梯形条带,同时进行SYBR Green I颜色反应,探究增菌优化后LAMP方法的检出限。
1.2.8 人工污染速冻肉糜类盲样检测 从市场随机采样,购买速冻肉丸10份,速冻鱼丸10份,速冻香肠制品10份,共计30份。“火锅料制品”种类繁多,包括牛肉丸、香菇贡丸、包心鱼丸、亲亲肠等,按产品主要原料及加工工艺将其主要分为三类,即速冻肉丸、速冻鱼丸、速冻香肠制品。30份样品经GB 4789.30-2016检测,均不含单增李斯特菌,为了验证本实验建立的LAMP方法的准确度,人工污染10份样品(污染浓度和数量分别为:6.4×101CFU/g 三份样品,6.4×102CFU/g 三份样品,6.4×103CFU/g四份样品)后随机混合制成盲样,分别用传统培养方法和LAMP方法重新检测这30份样品。
传统培养方法按照 GB 4789.30-2016[15]进行操作。LAMP方法检测按照无菌操作,取速冻肉糜类样品25 g,放入无菌均质袋,加入225 mL Half-Fraser增菌液,在拍击式均质器上连续均质2 min,于恒温振荡器中37 °C增菌6 h,用试剂盒提取DNA模板。LAMP反应体系按照1.2.4操作。
1.2.9 企业生产线样本检测 某食品企业提供生产线样本30份,包括鸡小胸原料、亲亲肠(速冻机入口处)、亲亲肠(速冻机出口处)、包心鱼丸(速冻机入口处)、包心鱼丸(速冻机出口处)。分别用传统培养方法和LAMP方法进行检测。
1.3 数据处理
实验数据使用SPSS 17.0进行统计分析,结果以平均数±标准差表示。使用单因素方差分析(one way ANOVA)伴随LSD多重比较,当P<0.05时,认为组间具有显著性差异。之后使用Origin Pro软件绘制柱状图。
2 结果与分析
2.1 增菌培养基的选择
2.1.1 不同接种量的菌在Half Fraser中的增菌情况如图1所示,单增李斯特菌的增菌效果与初始菌量有关系,初始菌量越大,生长速度越快。使用SPSS 17.0对实验数据进行单因素方差分析(one way ANOVA)分析,当接种量为640 CFU/mL时,生长至4 h,其OD值为0.49,与初始菌量有显著性差异(P<0.05);当接种量为 64 CFU/mL 时,生长至 4 h,其OD值为0.38,与初始菌量差异不显著(P>0.05),增菌至 6 h,其 OD 值为 0.58,差异显著(P<0.05);当接种量为6.4 CFU/mL时,与64 CFU/mL增殖情况类似,生长至6 h,其OD值为0.45,此时与初始菌量有显著性差异(P<0.05)。
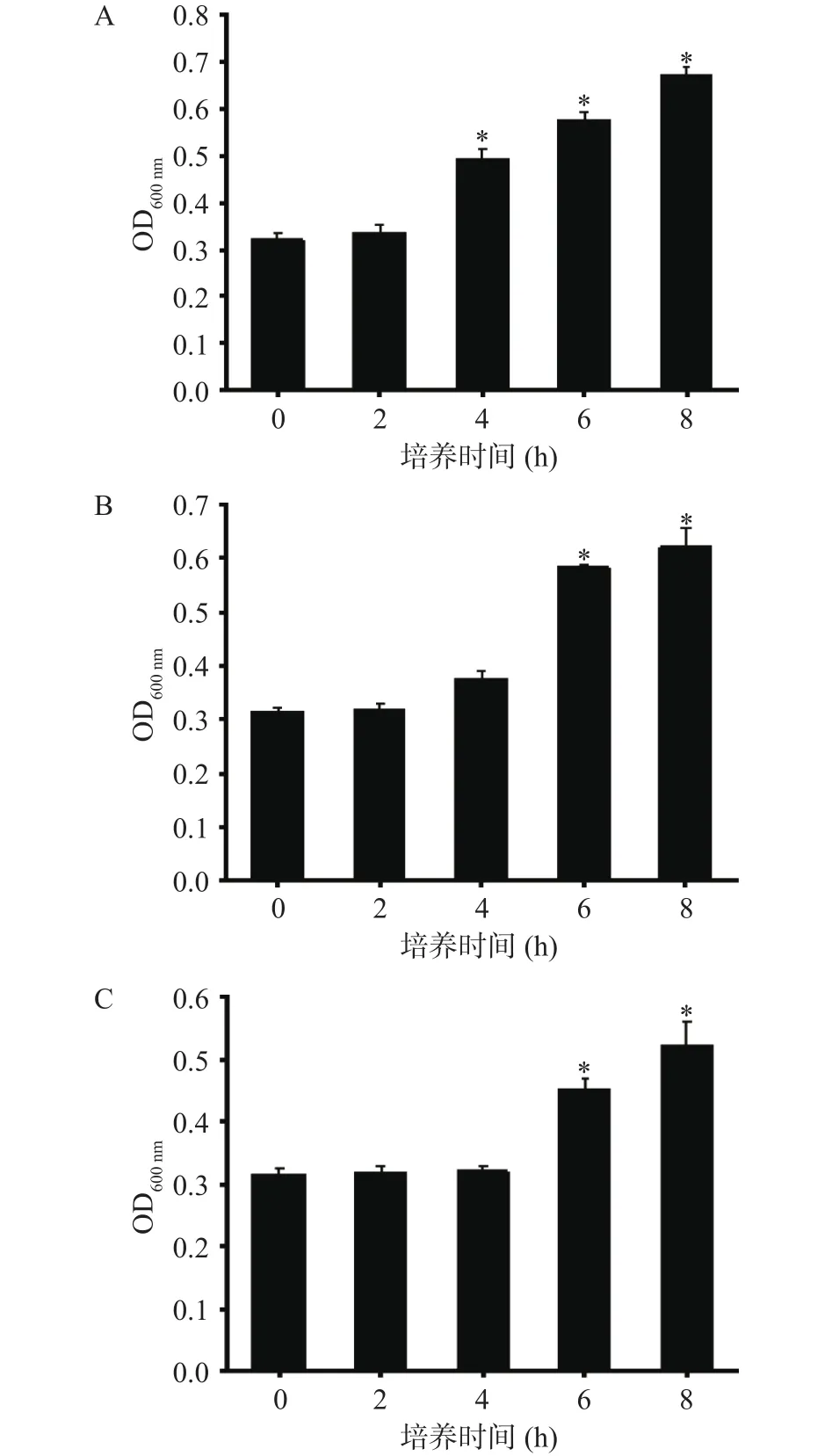
图1 不同接种量的菌在Half Fraser中的增菌情况Fig.1 Bacteria increase with different inoculation amounts in Half Fraser
2.1.2 不同接种量的菌在Fraser中的增菌情况 如图2所示,与 Half Fraser对比发现,当接种量为640 CFU/mL时,生长至6 h,其OD值为0.47,此时与初始菌量有显著性差异(P<0.05);当接种量为64 CFU/mL时,增菌至6 h,其OD值为0.43,差异显著(P<0.05);当接种量为 6.40 CFU/mL 时,需增菌至8 h,目标菌才会有显著性的生长情况(P<0.05),此时OD值为0.48,初步判定Half Fraser增菌效果更好。通过对比两种增菌液培养基成分发现,Half Fraser和Fraser基本成分一致,后者的抑菌剂是前者的两倍,高浓度的抑菌剂使目标菌生长速度变慢。
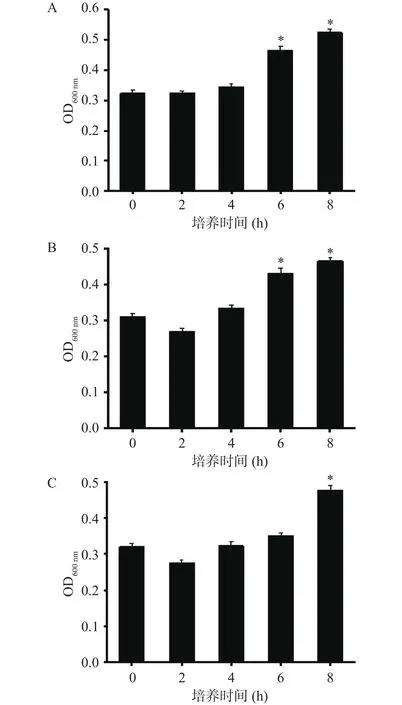
图2 不同接种量的菌在Fraser中的增菌情况Fig.2 Bacteria increase with different inoculation amounts in Fraser
2.1.3 不同接种量的菌在LB1中的增菌情况 如图3所示,当接种量小于等于640 CFU/mL时,其OD值与初始菌量均无显著性差异(P>0.05),这表明单增李斯特菌8 h内在LB1中增菌效果不佳,这可能与培养基中添加的抑菌剂有关,与Half Fraser和Fraser相比,LB1中添加的抑菌剂吖啶黄素和萘啶酮酸浓度较高,抑制杂菌效果好,但却造成了单增李斯特菌生长速度较慢,如果要达到较好的增菌效果,可能需要更长的增菌时间。GB 4789.30-2016检测中一般增菌(24±2) h,本实验预筛选一种增菌速度快的增菌培养基(一个工作日即可完成检测),因此LB1可能不适合作为本实验的前增菌培养基。
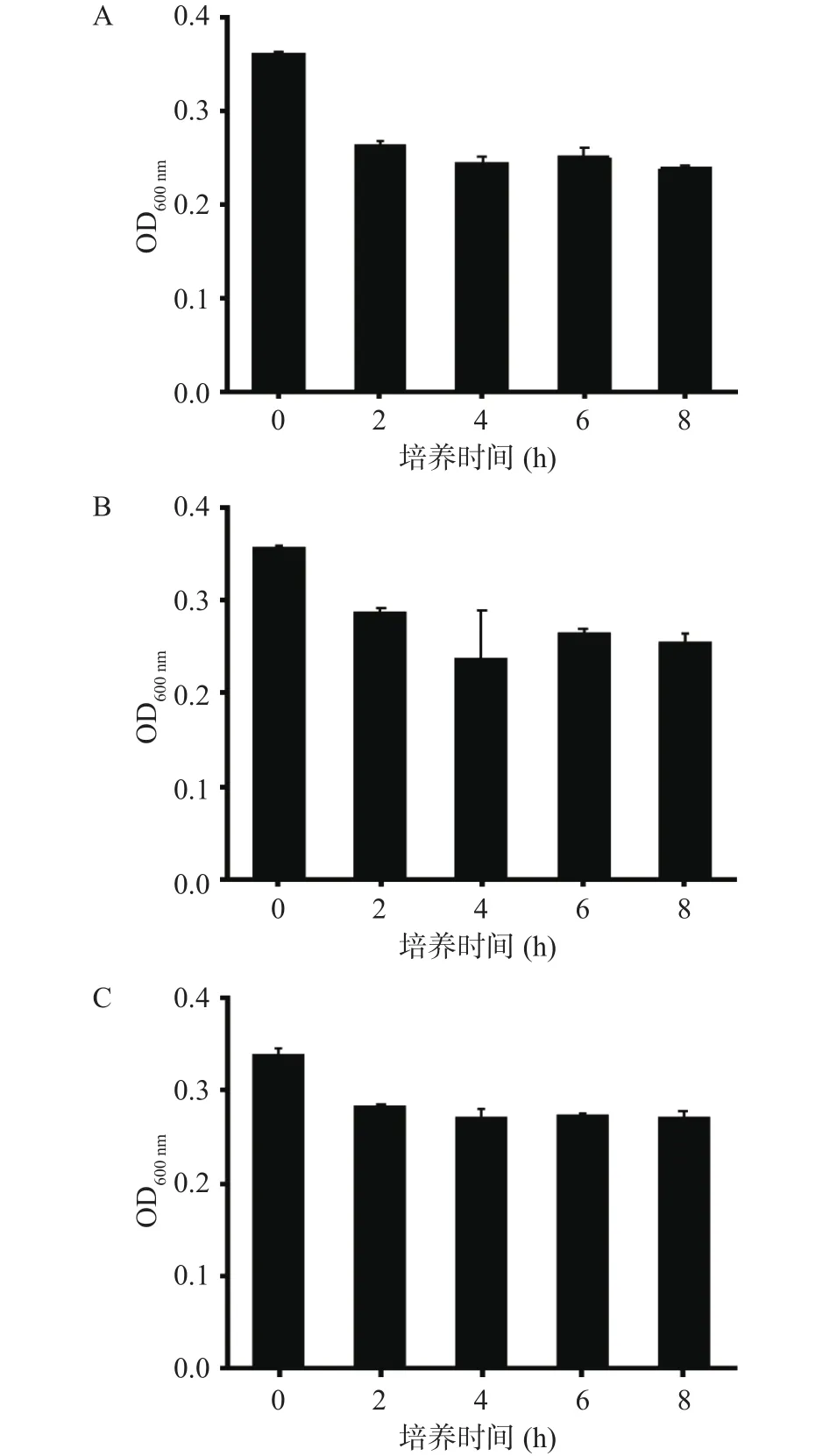
图3 不同接种量的菌在LB1中的增菌情况Fig.3 Bacteria increase with different inoculation amounts in LB1
2.1.4 不同接种量的菌在LB2中的增菌情况 如图4所示,当接种量小于等于640 CFU/mL时,其OD值与初始菌量均无显著性差异(P>0.05),单增李斯特菌8 h内在LB2增菌液中生长受到了抑制。与LB1相比,LB2中添加的抑菌剂吖啶黄素和萘啶酮酸浓度不同,但与Half Fraser和Fraser相比,抑菌剂浓度仍然较高,这可能是造成8 h内Half Fraser肉汤对单增李斯特菌的增菌效果优于LB肉汤的主要原因,因此Half Fraser肉汤更适合作为本实验的增菌培养基。
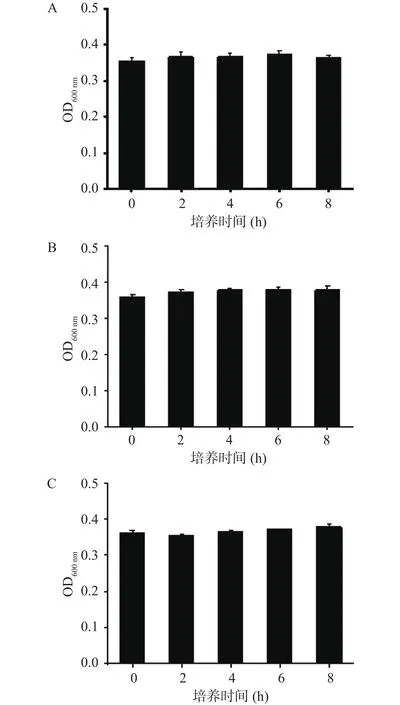
图4 不同接种量的菌在LB2中的增菌情况Fig.4 Bacteria increase with different inoculation amounts in LB2
2.1.5 不同接种量的菌在四种培养基中的活菌数当菌液浓度低于6.4×104CFU/mL,使用细菌基因组提取试剂盒(TIANGEN)提取DNA,核酸提取浓度不能满足LAMP检测,因此需增菌至6.4×104CFU/mL以上。结果如表3、表4所示,单增李斯特菌在四种增菌液中的平板计数结果与OD600nm值结果趋势一致。单增李斯特菌的增菌效果与初始菌量有关系,初始菌量越大,生长速度越快。可以看到,四种增菌培养基中,Half Fraser的增菌效果最好,当接种量为640 CFU/mL时,增菌 4 h,菌液浓度可达到 1.2×104CFU/mL;当接种量为64 CFU/mL时,增菌6 h,菌液浓度可达到 9.4×104CFU/mL;当接种量为6.4 CFU/mL时,8 h内菌液浓度与0 h无显著性差异。综上所述,选取Half Fraser为本实验的增菌培养基,检出限最低降至64 CFU/mL。
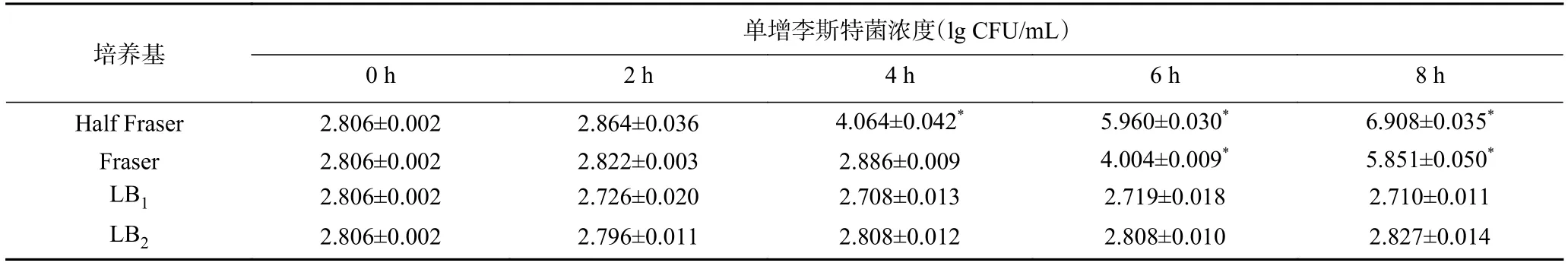
表3 接种量640 CFU/mL时单增李斯特菌在四种增菌液中生长差异性比较Table 3 Comparison of growth situation of Listeria monocytogenes in four kinds of culture medium at 640 CFU/ mL
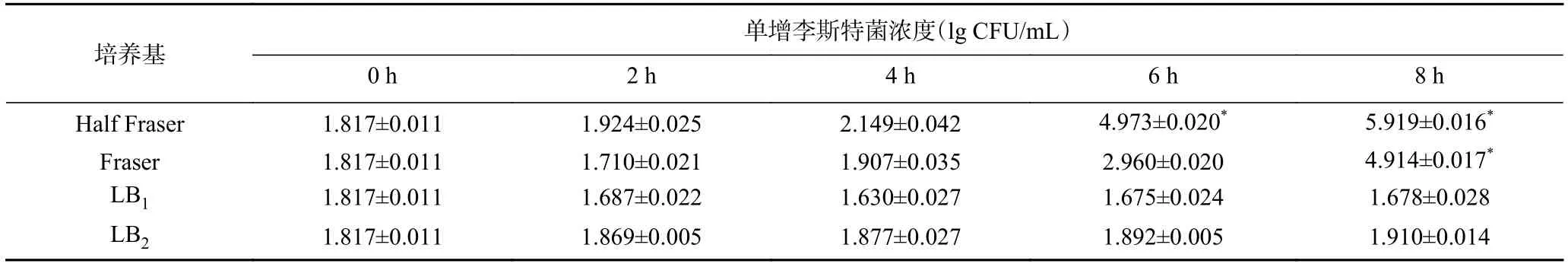
表4 接种量64 CFU/mL时单增李斯特菌在四种增菌液中生长差异性比较Table 4 Comparison of growth situation of Listeria monocytogenes in four kinds of culture medium at 64 CFU/mL
2.2 增菌时间的确定
结果如图5所示,至少增菌6 h才可满足后续DNA的提取,琼脂糖凝胶电泳可检测出梯形条带,核酸荧光染料的染色结果呈阳性绿色。因此,确定该方法的最短增菌时间为6 h 。
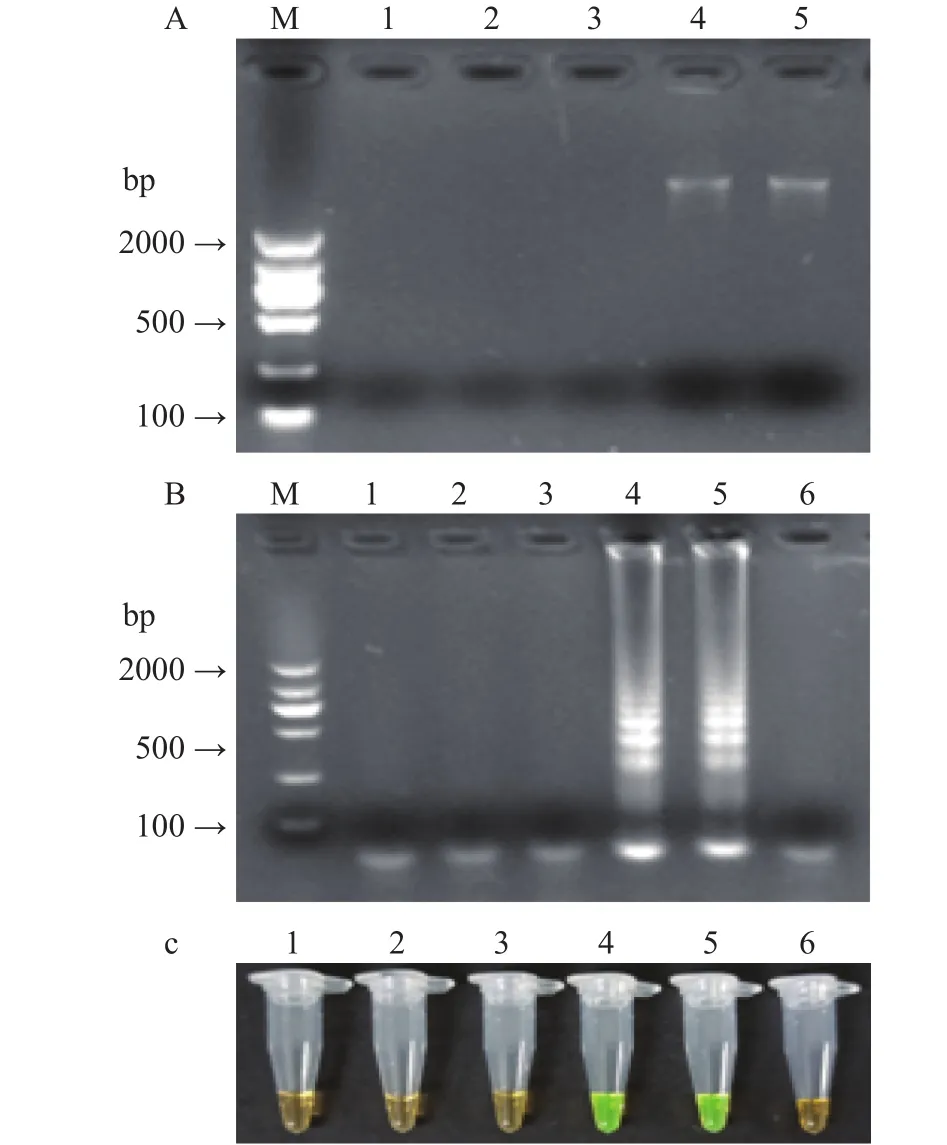
图5 增菌优化反应时间的确定Fig.5 Determination of reaction time for enrichment
2.3 增菌优化前LAMP方法的检出限
结果如图6所示,当菌液浓度为6.4×104CFU/mL时,LAMP反应后可检测到梯形条带,SYBR Green I染色结果为绿色,证明发生了特异性扩增,检测结果呈阳性;而当菌液浓度为6.4×103CFU/mL时,LAMP 扩增后未检测到梯形条带,SYBR Green I染色结果为橙色,检测结果呈阴性,因此,增菌优化前,LAMP检测人工污染速冻肉糜类制品单增李斯特菌的检出限为6.4×104CFU/g。
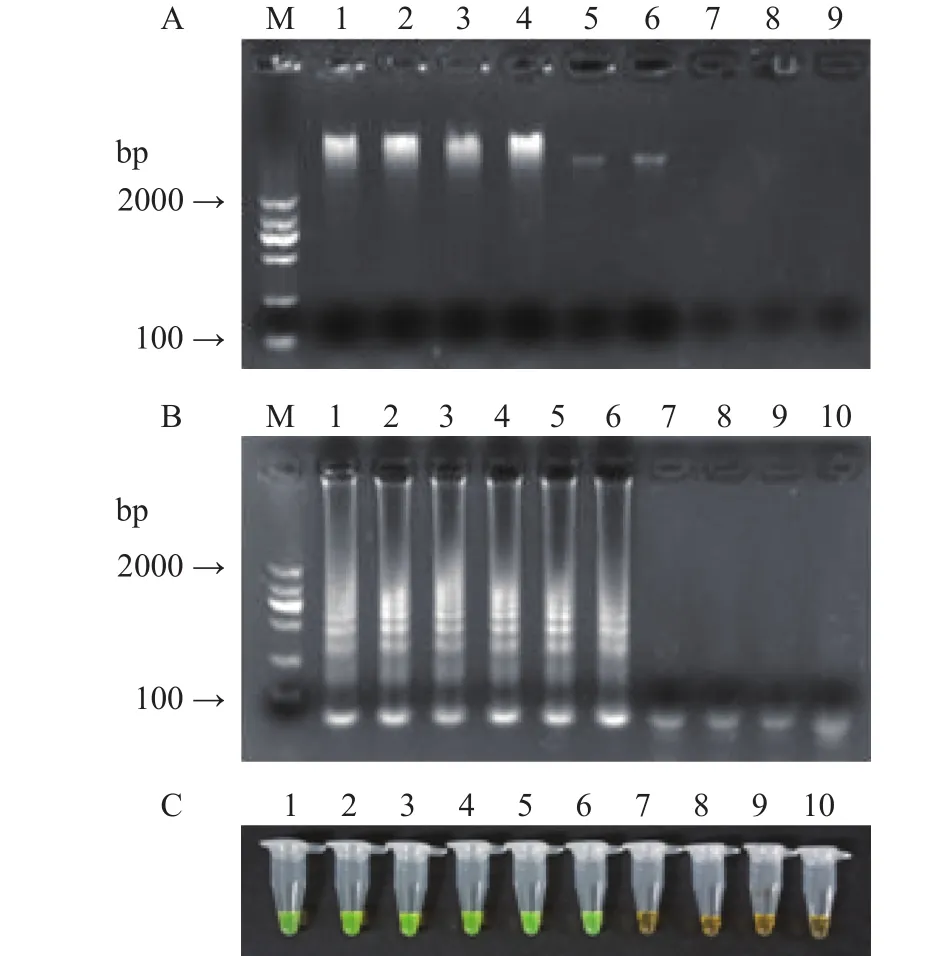
图6 增菌优化前LAMP方法检出限Fig.6 Detection limit of LAMP befor enrichment
2.4 增菌优化后LAMP方法的检出限
结果如图7所示,当菌液浓度为6.4×101CFU/mL时,通过6 h的前增菌,LAMP反应后可检测到梯形条带,SYBR Green I染色结果为绿色,表明发生了特异性扩增,即结果呈阳性。当菌液浓度为6.4 CFU/mL时,电泳未检测到梯形条带,SYBR Green I染色结果为橙色,即结果呈阴性,表明此菌液浓度下,没有发生LAMP扩增。因此,通过6 h的前增菌,本实验检测人工污染速冻肉糜类制品单增李斯特菌的检出限为6.4×101CFU/g,比增菌前降低了三个数量级。
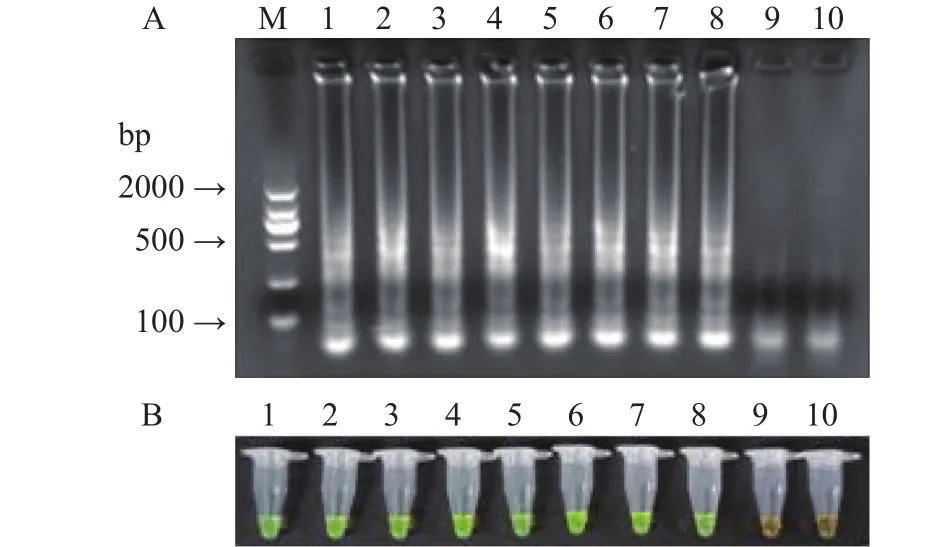
图7 增菌优化后LAMP方法检出限Fig.7 Detection limit of LAMP after enrichment
2.5 人工污染速冻肉糜类盲样检测结果
检测结果如表5所示。国标的检测结果中有10份阳性样品,20份阴性样品。以国标为标准,LAMP 方法检测结果与其一致,无假阳性,无漏检情况,准确度为100%。
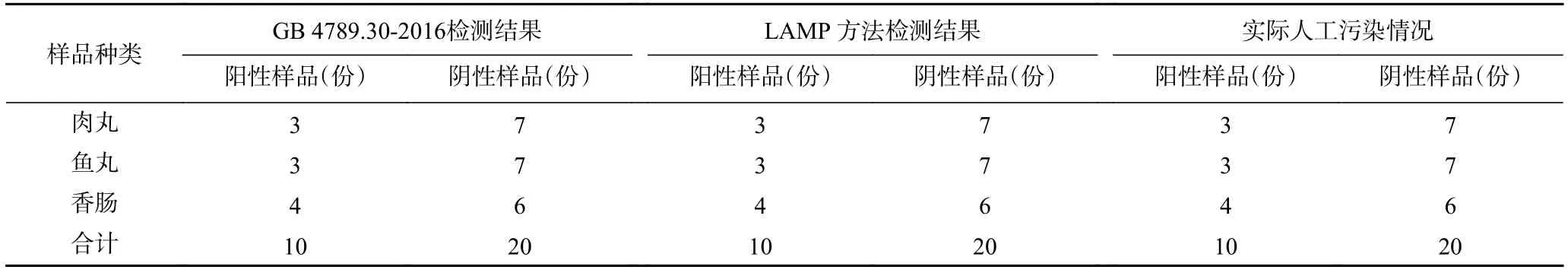
表5 人工污染样品检测结果统计Table 5 Detection results of artificially contaminated samples
2.6 企业生产线样本检测结果
检测结果如表6所示。25份样品同时用国标法和LAMP方法检测,两种方法的检测结果相一致。企业生产线质量监管较为严格,此次采集样本检测结果均为阴性。据文献报道,速冻肉糜类制品在加工过程中交叉污染可能更为常见[31-32]。
表6 生产线样本单增李斯特菌检出情况Table 6 Listeria monocytogenes detection in production line samples
3 结论
本研究比较了四种增菌培养基对单增李斯特菌的增菌效果。以OD600nm和平板计数活菌数为指标,结果显示Half Fraser的增菌效果最好,从6.4×101CFU/mL增菌至9.4×104CFU/mL,用时6 h。增菌优化后,LAMP检测速冻肉糜类制品中单增李斯特菌的检出限为 6.4×101CFU/g,比增菌前降低了三个数量级。将LAMP方法应用于人工污染速冻肉糜类盲样样品和企业生产线样本检测,同时与国标法对比,本方法与国标法检测结果一致。
本研究基于LAMP方法,结合6 h的前增菌,可将检测时间缩短至8 h,无需专业设备,根据颜色的变化即可判断检测结果,直观简便,适合基层对食品中单增李斯特菌的现场快速检测。目前由于技术本身的限制,LAMP方法的检出限略高于实时荧光定量PCR技术,为了更好的检测样品中可能存在的少量细菌,在实际样品处理时,可以延长增菌时间以降低 LAMP 方法的检出限。总之,LAMP技术将有望成为食源性致病菌检测的有效方法,为产品检测及安全追溯提供依据。
