基于内源性磷脂-乳清分离蛋白交互作用的磷虾油乳液稳定性研究
2021-12-16赵电波秦晓鹏詹海杰段子强邓乾春相启森朱莹莹
赵电波,秦晓鹏,詹海杰,段子强,禹 晓,邓乾春,相启森,朱莹莹
(1.郑州轻工业大学食品与生物工程学院,食品生产与安全河南省协同创新中心,河南省冷链食品质量安全控制重点实验室,河南郑州 450001;2.中国农业科学院油料作物研究所,油料脂质化学与营养湖北省重点实验室,湖北武汉 430062)
全球饮食报告显示,2017年全球约有1/5人口的过早死亡是由饮食结构问题所导致。其中,长链n-3多不饱和脂肪酸(long chain n-3 polyunsaturated fatty acids,LC n-3PUFAs)摄入不足几乎波及全球195个国家和地区。我国现状尤为严峻,每日二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)摄入量约 50 mg,仅为推荐标准的20%,这尤为不利于n-3 PUFAs通过强化营养、调节代谢紊乱干预多种慢性疾病的发生发展[1]。
与植物来源的α-亚麻酸相比,海产品来源的EPA和DHA营养和健康功效更为显著[2]。与富含甘油三酯型EPA和DHA的鱼油相比,南极磷虾油来源的磷脂型EPA和DHA更容易富集在机体组织中,从而表现出更高的生物活性[3-4]。因内源性磷脂和虾青素的存在,南极磷虾油的氧化稳定性相对优于鱼油。然而,即使是商业南极磷虾油,仍含有2%~13%游离脂肪酸,主要来源于磷脂型EPA和DHA的脂解反应,从而加剧甘油三酯的脂质过氧化,降低南极磷虾油的生物活性[5]。目前市售南极磷虾油主要是纯油体系或软胶囊,摄入形式较为单一。因此,通过改变南极磷虾油的摄入形式,并进一步强化其生物利用率,增加其健康食品体系中的应用范围,将是有效重构我国居民膳食脂肪摄入平衡的关键。纳米乳液载运体系能够一定程度上实现负载的活性脂质的靶向消化、吸收和代谢转化轨迹,正逐步用于提高亚麻籽油、鱼油中n-3PUFAs的生物利用率[6-8]。研究发现,胃液低pH及较高含量的血红素铁、H2O2、活性氮等物质构成了促EPA和DHA氧化的微环境,小肠段由脂解反应介导的游离脂肪酸的释放、界面解吸附和胶束化过程中可能加剧EPA和DHA氧化[9-10]。对于磷虾油而言,引入特定蛋白类乳化剂,利用其形成致密的粘弹性界面膜,构建具有较强物理稳定性的乳液体系,将是最大限度改善磷虾油氧化易感性和掩盖不良风味的关键[11]。
乳清分离蛋白(WPI)主要包括β-乳球蛋白(67.6%~74.8%)、α-乳白蛋白(8.3%~17.5%)、牛血清白蛋白(7.2%~10.9%)和免疫球蛋白(5.9%~7.5%)。因富含半胱氨酸等含巯基氨基酸,WPI具有一定的抗氧化活性[12]。此外,WPI本身具有较好的乳化活性和乳化稳定性,且能够与壳聚糖、亚麻籽胶多糖等基于非共价或共价交互作用负载亚麻籽油、百里香油、花青素等活性组分[13-15]。已有研究表明,葵花籽油磷脂与WPI复合,能够影响乳清蛋白二级结构,诱导疏水位点暴露,进一步提高乳清蛋白的乳化活性[16]。在磷虾油中,内源性甘油三酯和磷脂共存,将如何与WPI交互作用影响乳液稳定性,仍待进一步研究。基于此,本研究拟利用磷虾油内源性磷脂的自乳化潜力,并引入WPI,探究内源性磷脂-WPI交互作用对磷虾油乳液理化特性、微观结构、物理稳定性、环境胁迫响应性的影响规律和作用机理,旨在构建具有较强物理稳定性的磷虾油乳液体系,以应用到乳饮料、调味酱、肉糜等流体、半流体和固体食品体系中。
1 材料与方法
1.1 材料与仪器
南极磷虾油 青岛南极维康生物科技有限公司;WPI Davisco Food 公司;溴化钾(光谱纯) 上海国药试剂集团;ANS(8-苯胺-1萘磺酸) 索莱宝生物科技有限公司;无水乙醇、正己烷 分析纯,天津市科密欧化学试剂有限公司;磷酸二氢钾、磷酸氢二钾 分析纯,天津市大茂化学试剂厂。
XHF-D高速分散器 宁波新芝生物科技股份有限公司;P901酸度计测定仪 上海佑科仪器仪表有限公司;Nano-ZS90激光粒度仪 英国马尔文仪器公司;Discovery型旋转流变仪 美国TA公司;Turbiscan多重光散射仪 法国Formulaction公司;Quorum PP3010T冷冻传输装置 英国Quorum公司;Regulus 8100电镜 日本日立(Hitachi)公司;Vertex70傅里叶变换红外光谱仪 德国布鲁克公司;自动界面张力仪K100 德国Kruss仪器有限公司。
1.2 实验方法
1.2.1 磷虾油乳液制备
1.2.1.1 自乳化型磷虾油乳液的制备 参考Uluata等[17]的方法,稍加修改,将磷虾油与0.05 mol/L,pH=6.8的磷酸盐缓冲液(PBS)分别以质量比5:95、10:90、15:85、20:80和 25:75混合后置于 50 mL离心管中,用高速分散器以10000 r/min均质3 min,借助内源性磷脂的乳化特性,获得南极磷虾油自乳化型O/W乳液。
1.2.1.2 内源性磷脂-WPI稳定的磷虾油乳液制备在1.2.1.1基础上,将磷虾油与不同质量分数的WPI溶液(0、0.25%、0.5%、0.75%和1.0%)分别以质量比25:75混合后置于50 mL离心管中,用高速分散器以10000 r/min均质3 min,获得内源性磷脂和WPI稳定的磷虾油乳液。
1.2.2 磷虾油乳液的理化稳定性分析
1.2.2.1 平均粒径和Zeta电位测定 将磷虾油乳液用0.05 mol/L PBS稀释100倍后,在室温下用激光粒度仪测定平均粒径与Zeta电位。
1.2.2.2 形貌观察 参考Dapueto等[18]的方法,稍加修改,利用冷场扫描电镜(Cryo-SEM)观察磷虾油乳液微观形态,测试条件为:升华温度,-90 ℃;升华时间,10 min;喷金,5 mA,60 s;拍摄电压为 3 kV。
1.2.2.3 物理稳定性 采用多重光散射仪测定磷虾油乳液的物理稳定性。具体测试条件为:上样量18 mL;扫描频率,1 次/25 s;扫描时间,30 min。
1.2.2.4 剪切流变特性分析 参考Tang等[19]的方法,稍加修改,采用旋转流变仪对磷虾油乳液进行表观粘度测定,测试条件为:夹具直径,40 mm;夹缝间隙,0.5 mm;测试温度,25 ℃;剪切速率,0.01~100 s-1。
1.2.2.5 模拟巴氏杀菌和pH迁移处理 模拟巴氏杀菌条件:65 ℃,30 min 和 85 ℃,15 s,并以未处理样品作为对照。具体测定过程为,在水浴锅到达指定温度后,放置磷虾油乳液,用温度计测量乳液中心温度,达到条件温度后计时,温度处理结束后测量其物理稳定性。
pH迁移:用0.5 mol/L的NaOH溶液和0.5 mol/L的HCl溶液调节蛋白溶液的pH,与磷虾油混合均质后,测定不同pH条件下磷虾油乳液的物理稳定性。
1.2.3 内源性磷脂-WPI交互作用评价
1.2.3.1 磷虾油磷脂分离 参考赵鑫鹏[20]的方法,采用正己烷/乙醇/水三相溶剂提取分离工艺,多次正己烷提取乙醇相萃取液,直至正己烷相接近无色,最后将乙醇相萃取液脱溶后获得橙黄色膏状物,即为磷虾油磷脂。
1.2.3.2 磷虾油磷脂-WPI分散液制备 将0.5 g WPI溶于40 mL去离子水,配成WPI溶液,再按乳清蛋白与磷虾油磷脂质量比 1:0.1,1:0.2,1:0.5,1:1加入磷虾油磷脂,25 ℃、500 r/min磁力搅拌过夜,配制磷虾油磷脂-WPI分散液。
1.2.3.3 磷虾油磷脂对WPI内源性荧光特性的影响参考Chen等[16]的方法,采用荧光分光光度计分析磷虾油磷脂对WPI内源性荧光特性的影响。将制得的分散液稀释100倍,与 0.008 mol/L的 ANSPBS溶液按50:1混合,室温下漩涡,孵育30 min。测试条件为,激发波长350 nm,扫描波长380~600 nm,缝宽为2.5 nm。
1.2.3.4 磷虾油磷脂对WPI二级结构的影响 圆二色谱分析:将不同质量比的磷虾油磷脂-WPI分散液注入1 mm石英小杯,设置远紫外光谱范围为180~260 nm,测试温度为25 ℃,扫描速度为120 nm/min,响应时间为0.5 s,分辨率为0.5 mm,带宽为1 nm。
红外光谱分析:将磷虾油磷脂-WPI分散液冷冻干燥后,取2 mg粉末样品与溴化钾(1:100)在玛瑙研钵里充分研磨混合均匀后压片,利用傅里叶变换红外光谱仪在4000~400 cm-1区内进行扫描分析,分辨率为4 cm-1。
1.2.3.5 磷虾油磷脂对WPI界面活性的影响 参考O'Sullivan等[21]的方法,稍加修改。将装有14 g分散液的玻璃皿放入仪器中,调整铂金板浸入液面3 mm深度,缓慢加入40 g亚麻籽油,使其在分散液与油相之间形成界面,并设置WPI和磷虾油磷脂对照组。测试条件为:测定温度,25 ℃;测定频率:1次/60 s;测定时间:3600 s。
1.3 数据处理
结果均以平均值±标准差表示(n=3)。采用Origin9.5软件绘图,SPSS21.0软件进行数据统计分析,样品间差异性通过Duncan法比较(P<0.05)。
2 结果与分析
2.1 载油量对磷虾油乳液平均粒径、Zeta电位和物理稳定性的影响
图1为载油量对磷虾油乳液平均粒径和Zeta电位的影响。由图1A可知,在5%载油量条件下,磷虾油乳液平均粒径为166 nm;随着载油量增加至25%时,磷虾油乳液的平均粒径降低78.97%(P<0.05)。这主要归因于磷虾油中除了含有12%~30%甘油三酯外,还含有具有表面活性的磷脂(19%~81%)以及少量甘油二酯、游离脂肪酸等[22]。因此,在不添加任何乳化剂情况下,磷虾油能够借助高速剪切形成分散性较好的乳液体系[23]。如图1B所示,在5%载油量条件下,磷虾油乳液的初始Zeta电位值为-46.6 mV,表明依赖内源性磷脂形成的脂滴之间具有较强的静电斥力。随着载油量逐渐增加至25%,磷虾油乳液体Zeta电位绝对值呈现先逐步降低后趋于稳定的趋势,最低值为27.23。磷虾油中除了含有磷脂酰胆碱、溶血磷脂酰胆碱、磷脂酰乙醇胺外,还含有少量的溶血磷脂酰丝氨酸等[24]。因此,在中性pH条件下,磷虾油乳液的Zeta电位值主要依赖于溶血磷脂酰丝氨酸等在脂滴表面的吸附量。
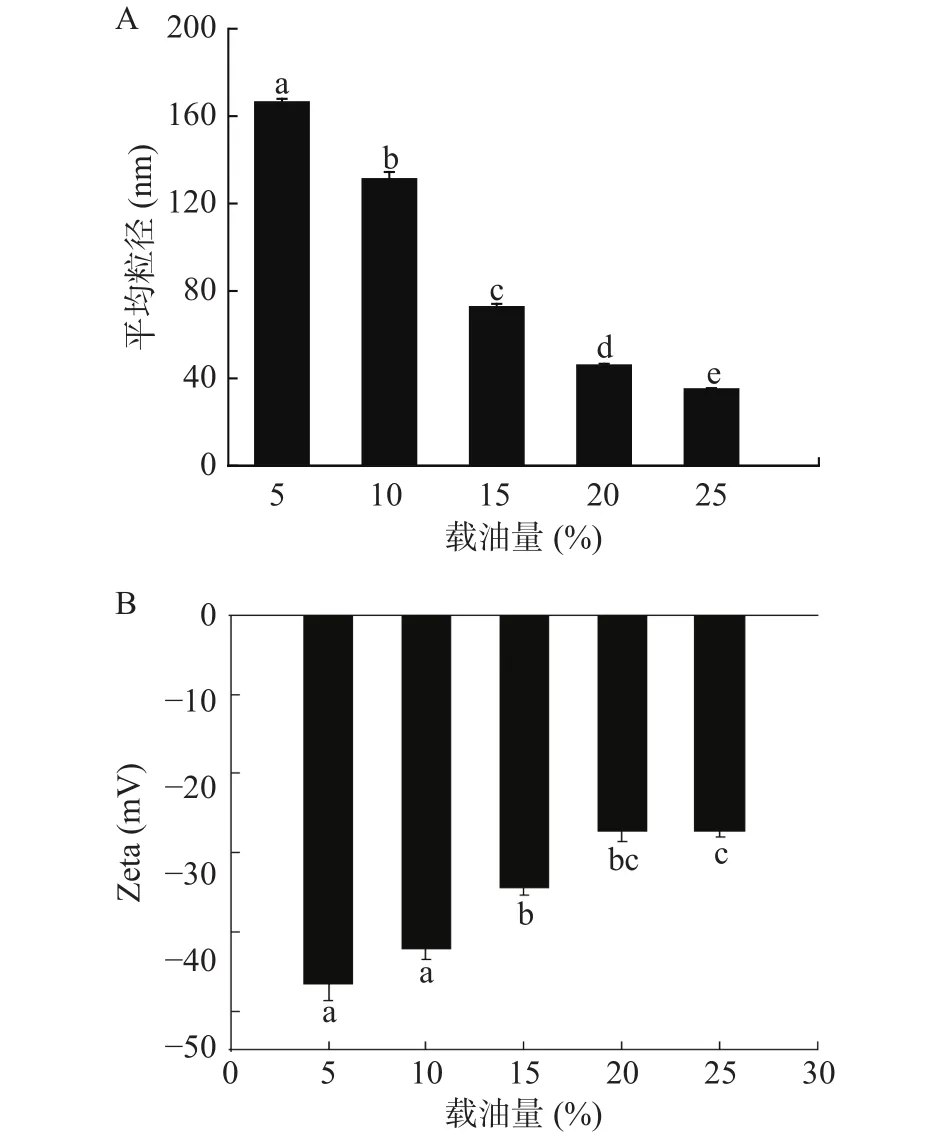
图1 载油量对磷虾油乳液平均粒径(A)和Zeta电位(B)的影响Fig.1 Effect of oil loading on the mean particle size(A)and Zeta potential(B)of krill oil emulsion
通过Tubiscan-easysoft软件计算乳液的稳定性动力学指数(Turbiscan stability index,TSI)。TSI值越小,表明该乳液体系越趋于稳定。图2为载油量对磷虾油乳液物理稳定性的影响。如图2A所示,当载油量为5%时,磷虾油乳液的TSI值最小;当载油量逐步增加至20%时,磷虾油乳液的TSI值以及其增长速率均呈现逐步增加的趋势;当载油量进一步增加至25%时,磷虾油乳液TSI值和增长速率的增加幅度最为明显,体系趋于不稳定。图2B为载油量为5%和25%时,磷虾油乳液的背射光图谱。其中,当载油量为5%时,乳液的背射光图谱整体平稳,表现出较好的物理稳定性;载油量增加到25%时,曲线右侧发生上移,表明乳液中脂滴上浮,稳定性变差。上述研究表明,高载油量能够提供更多的内源性磷脂用于分散和乳化磷虾油,但同时也增加了脂滴之间碰撞频率与聚结速率,这与姜如雪等[25]的研究结果基本一致,乳液体系中较高的载油量会引起油滴碰撞使得乳液趋于形成多重乳液,并在贮存过程中破裂,这两种现象可能导致乳液失稳。因此,在较高载油量条件下,无法单纯依赖内源性磷脂获得兼具乳化活性和稳定性较强的磷虾油乳液。
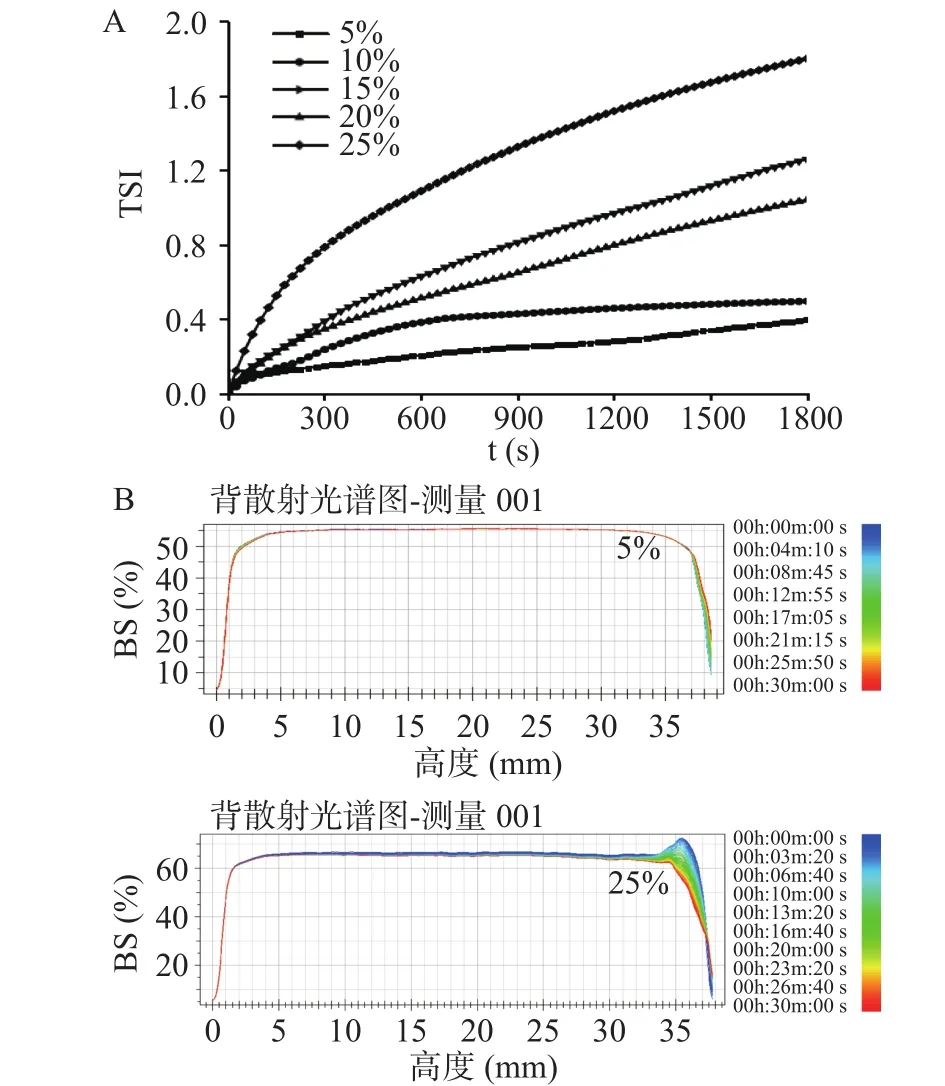
图2 载油量对南极磷虾油乳液物理稳定性的影响Fig.2 Effect of oil loading on the physical stability of krill oil emulsion
2.2 WPI含量对磷虾油乳液平均粒径、Zeta电位和物理稳定性的影响
图3为WPI含量对25%载油量的磷虾油乳液平均粒径、Zeta电位和物理稳定性的影响。由图3A可知,低含量WPI(0%~0.25%)添加对磷虾油乳液平均粒径无明显影响,为29.29~30.61 nm;进一步增加WPI添加量(0.5%~1.0%),磷虾油乳液平均粒径增加38.5%~84.0%(P<0.05),但与蛋白含量非正相关关系。在WPI添加量为0.5%时,达到最大值53.89 nm。由于磷虾油中内源性磷脂含量较高,且载油量高达25%,因此发挥乳化作用时小分子的磷脂占主导作用。在形成界面膜时,小分子磷脂会优先吸附到油水界面,而大分子乳化剂乳清蛋白通过疏水作用基团与小分子磷脂交互作用,并随着WPI含量的增加,与磷脂之间的界面竞争性吸附增强[16],并可能同时参与多个小分子内源性磷脂稳定的脂滴界面的形成,从而使磷虾油乳液粒径增大[26-27]。
由图3B可知,随着WPI含量的增加(0~1.0%),磷虾油乳液Zeta电位绝对值先逐渐增加后趋于稳定。在WPI添加量为0.5%时,zeta电位绝对值增加 31.40%(P<0.05),达到最大值 19.25,表明中性pH条件下,脂滴之间静电斥力因WPI的添加而逐步增强。由图3C~图3D可知,低浓度WPI(0~0.5%)能够明显的降低磷虾油乳液的TSI值,且随着WPI含量的增加降低程度增大,这使得背射光图谱中部曲线更平坦,脂滴上浮和絮凝现象得到明显改善。进一步增加WPI浓度(0.75%~1.0%),磷虾油乳液TSI值增长速率无明显变化,表明添加量在0.5%时,WPI稳定磷虾油乳液的潜力达到最大值。
2.3 WPI含量对磷虾油乳液微观结构的影响
图4为WPI含量对磷虾油乳液微观结构的影响。由图4可知,磷虾油中内源性磷脂,作为小分子乳化剂直接参与了脂滴的形成,平均粒径在纳米级范围内,进一步证实了图3A的结果。为考虑到超高压均质或微射流对WPI结构和乳化特性的影响[28],本研究采用高速剪切方式制备乳液。作为大分子乳化剂,WPI并没有直接参与单个脂滴界面膜的形成。相反地,由单纯内源性磷脂稳定的脂滴被束缚在WPI与部分内源性磷脂交互作用形成框架结构中。随着WPI含量的增加,WPI与内源性磷脂交互作用增强,被束缚在框架中的脂滴数量明显增加,同时游离在空间网络结构外的脂滴数量逐步减少。
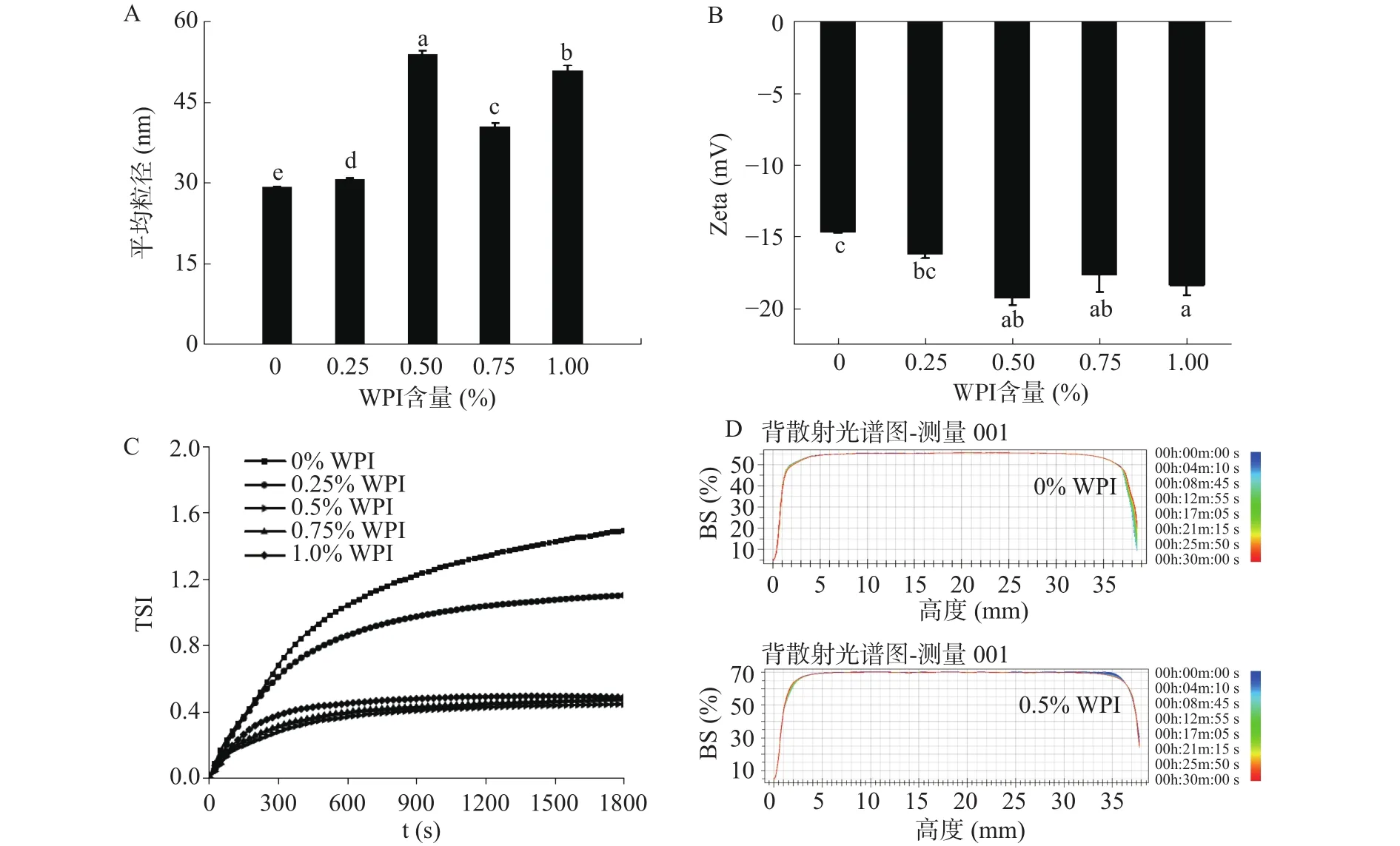
图3 WPI含量对磷虾油乳液平均粒径(A)、Zeta电位(B)和物理稳定性(C~D)的影响Fig.3 Effect of WPI on the mean particle size(A), Zeta potential(B)and physical stability(C~D) of krill oil emulsion
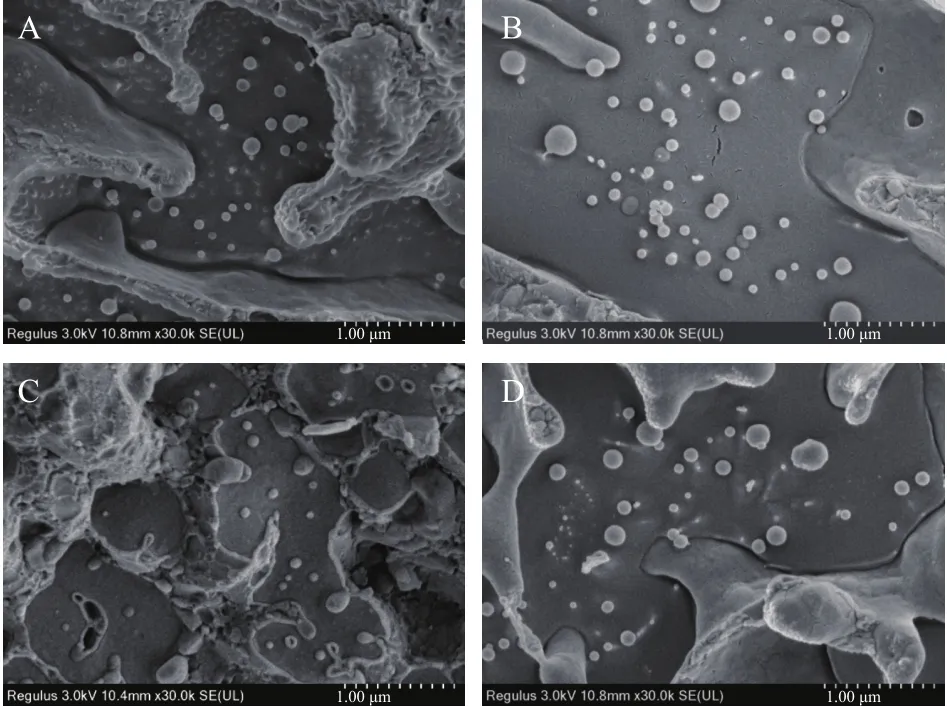
图4 WPI含量对磷虾油乳液微观结构的影响Fig.4 Effect of WPI on the microstructure of krill oil emulsion
2.4 WPI稳定磷虾油乳液的作用机理
2.4.1 WPI对磷虾油乳液剪切流变特性的影响以及磷虾油磷脂-WPI分散液的界面活性 图5为WPI对磷虾油乳液剪切流变特性的影响。由图5可知,WPI主要影响磷虾油乳液在低剪切速率(0.01~10 s-1)条件下的表观粘度值。其中,未添加WPI的磷虾油乳液表观粘度值较低,剪切变稀;随着WPI含量增加至1.0%,磷虾油乳液的表观粘度值在剪切速率0.01~1 s-1范围内逐步增加,也表现出剪切变稀的趋势。图6为磷虾油磷脂-WPI分散液的界面活性。由图6可知,磷虾油磷脂-WPI分散液的初始界面压力值明显低于单一内源性磷脂和WPI,表现出协同效应。当分散液中磷虾油磷脂与WPI质量比从0.1:1增加至0.25:1时,分散液的界面张力值无明显降低,这一现象可能是由于小分子磷脂加入虽然降低了界面张力,但是由于竞争吸附存在,使得油水界面表面负荷的蛋白减少,从而部分抵消了两者的协同效应[27];当磷虾油磷脂与WPI质量比分别增加至0.5:1和1:1时,分散液的界面张力值明显降低,且表现出剂量依赖关系。值得注意的是,磷虾油磷脂并未明显改变分散体系中WPI的界面吸附动力学规律。上述研究表明,WPI对磷虾油乳液稳定性的正向调控效应,与增加乳液体系粘度、限制脂滴在连续相的运动有关[29]。同时,磷虾油磷脂与WPI交互作用进一步强化了分散相参与脂滴界面形成的能力。
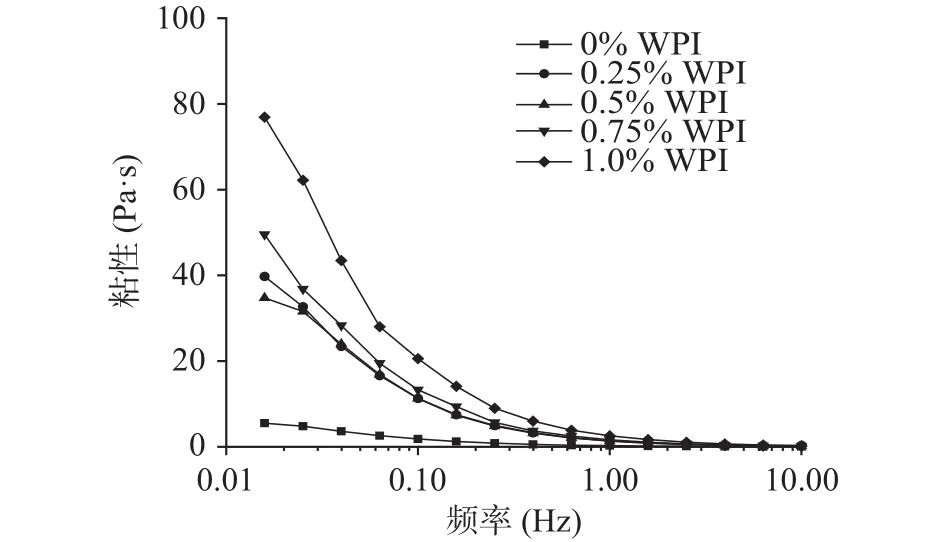
图5 WPI对磷虾油乳液剪切流变特性的影响Fig.5 Effect of WPI on the shear rheological properties of krill oil emulsions
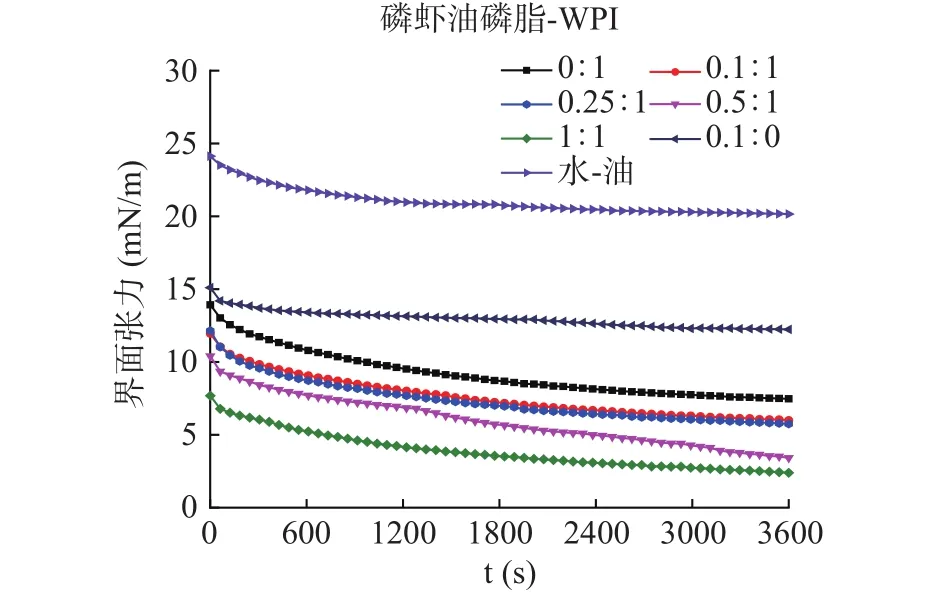
图6 磷虾油磷脂对WPI界面活性的影响Fig.6 Effect of krill oil phospholipids on the interfacial activity of WPI
2.4.2 磷虾油磷脂对WPI表面疏水特性和二级结构的影响 图7为磷虾油磷脂对WPI表面疏水特性和二级结构的影响。由图7A可知,当磷虾油磷脂和WPI质量比增加至0~0.2:1时,WPI的最大荧光强度(FImax)明显增加;当质量比达到0.2~0.5:1时,WPI的最大荧光强度(FImax)值无明显变化;当质量比进一步增加至1:1时,WPI的FImax值明显增强。事实上,WPI的荧光强度与暴露于极性环境中的苯丙氨酸(Phe)、酪氨酸(Tyr)及色氨酸(Trp)残基有关[30]。上述研究表明,分散体系中适宜浓度磷虾油磷脂的存在能够明显增加WPI增加疏水位点的暴露,即诱导位于疏水核心中Phe、Tyr和Trp转移到极性外环境中,提高其稳定磷虾油乳液的潜力。
磷虾油磷脂对WPI疏水特性的影响可能伴随着二级结构的改变。由图7B可知,WPI在3400~3200 cm-1内存在N-H或O-H的特征吸收峰;酰胺I谱带(1700~1600 cm-1)与肽基的C=O伸缩振动有关,酰胺Ⅱ谱带(1600~1500 cm-1)与 N-H 键弯曲和C-N键伸缩振动有关。随着分散体系中磷虾油磷脂与WPI比例从0:1增加至1:1,WPI酰胺Ⅰ带(1649.1~1651.0 cm-1)和酰胺Ⅱ带(1537.0~1545.0 cm-1)波段均向较大波长移动,表明磷虾油磷脂能够使WPI氢键减弱,从而影响其疏水特性。
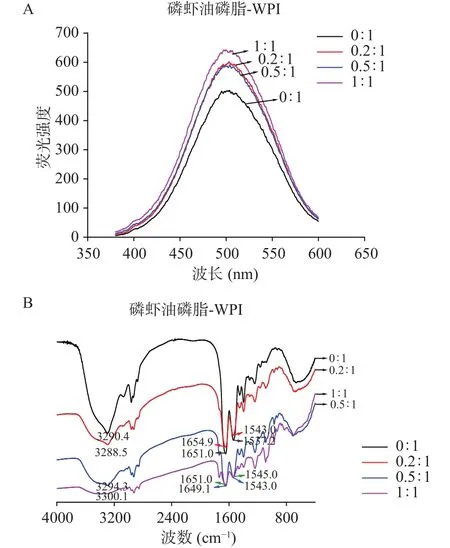
图7 磷虾油磷脂对WPI荧光特性(A)和红外光谱特性(B)的影响Fig.7 Effect of krill oil phospholipids on the fluorescence properties(A) and infrared spectrum (B) of WPI
表1为通过圆二色谱分析磷虾油磷脂对WPI二级结构的影响。由表1可知,单一WPI体系中α-螺旋、β-折叠、β-转角和无规卷曲结构含量分别为20.27%、30.23%、17.17%和32.33%,而磷虾油磷脂的添加能够不同程度地影响WPI二级结构。其中,当磷虾油磷脂与WPI质量比为0.1:1时,WPI中α-螺旋和β-折叠结构含量无明显变化;当质量比增加至 0.2:1 时,WPI中α-螺旋增加了 1.47%(P<0.05),β-折叠结构含量增加了 0.88%(P<0.05);当质量比进一步增加至0.25~1:1时,WPI的α-螺旋结构含量则降低了 1.60%(P<0.05),而β-折叠结构含量则呈现先增加后降低趋势。α-螺旋结构含量与WPI疏水特性呈负相关关系。上述实验结果表明,磷虾油磷脂与WPI质量比在0.1~0.2:1范围时,WPI有序性增强,分散体系亲水性提升。然而,从整体来看,分散体系中WPI的α-螺旋结构含量降低而β-折叠和无规卷曲结构含量增加则说明了WPI无序性增加,结构更加松散,疏水性增强[31]。有研究表明[32],这一现象是由于液晶状态下的阴离子磷脂,通过其疏水作用可以改变乳清蛋白的二级结构。
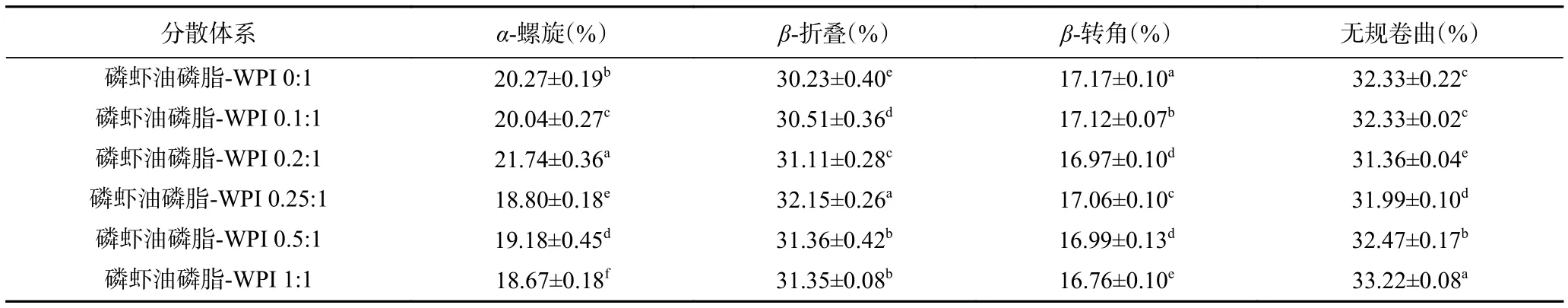
表1 磷虾油磷脂对WPI二级结构的影响Table 1 Effect of krill oil phospholipids on the secondary structure of WPI
2.5 模拟巴氏杀菌处理和pH迁移对磷虾油乳液流变特性和稳定性的影响
图8为模拟巴氏杀菌和pH迁移对磷虾油乳液流变特性和稳定性的影响。由图8A可知,与未处理组相比,磷虾油乳液分别经65 ℃处理30 min和85 ℃处理15 s后均表现出表观粘度值增加的趋势。由图8C所示,与对照组相比,65 ℃处理30 min和85 ℃处理15 s同样增加了磷虾油乳液的物理稳定性,而后者的正向调控作用最为明显。图8E中,与未处理的磷虾油乳液相比,处理组的背射光图谱曲线变化更小,说明乳液内部更为稳定。已有研究表明,这主要归因于磷虾油乳液被加热到70~90 ℃过程中,作为乳化剂的WPI可能经历了天然蛋白分子结构伸展变性、部分变性蛋白凝聚和弱凝胶形成,一定程度上限制了脂滴运动,表现出增强的磷虾油乳液稳定性[30]。
如图8B所示,在pH=4时,磷虾油乳液在低剪切速率0.01~0.1 s-1范围内,表观粘度值为41.80 Pa.s,当pH向强酸性迁移时磷虾油乳液表观粘度值显著减少,在向弱酸性、中性弱碱性迁移时磷虾油乳液的表观粘度值明显增加之后趋于稳定;当pH进一步增加至9时,磷虾油乳液的表观粘度值则呈现先显著增加后趋于稳定的趋势。由图8D可知,在pH4时,磷虾油乳液稳定性最差,可能是因为接近于WPI等电点,导致其乳化活性降低。当pH向强酸性、尤其是向弱酸性、中性和弱碱性迁移时,磷虾油乳液稳定性依次增强。图8F为磷虾油乳液pH为2、6、9时的背射光图谱,三者曲线整体都较为平坦,表现出较高的物理稳定性,pH2时,曲线中部有部分波动可能是由于强酸性条件下磷虾油乳液中的静电作用使乳液中部发生了轻微的聚合。上述结果显示,基于内源性磷脂-WPI交互作用构建的磷虾油乳液在胃消化阶段的酸性pH条件下具有相对稳定性,可以最大限度地改善磷虾油在该阶段的氧化易感性,并可能实现磷虾油经小肠段消化吸收的靶向性。
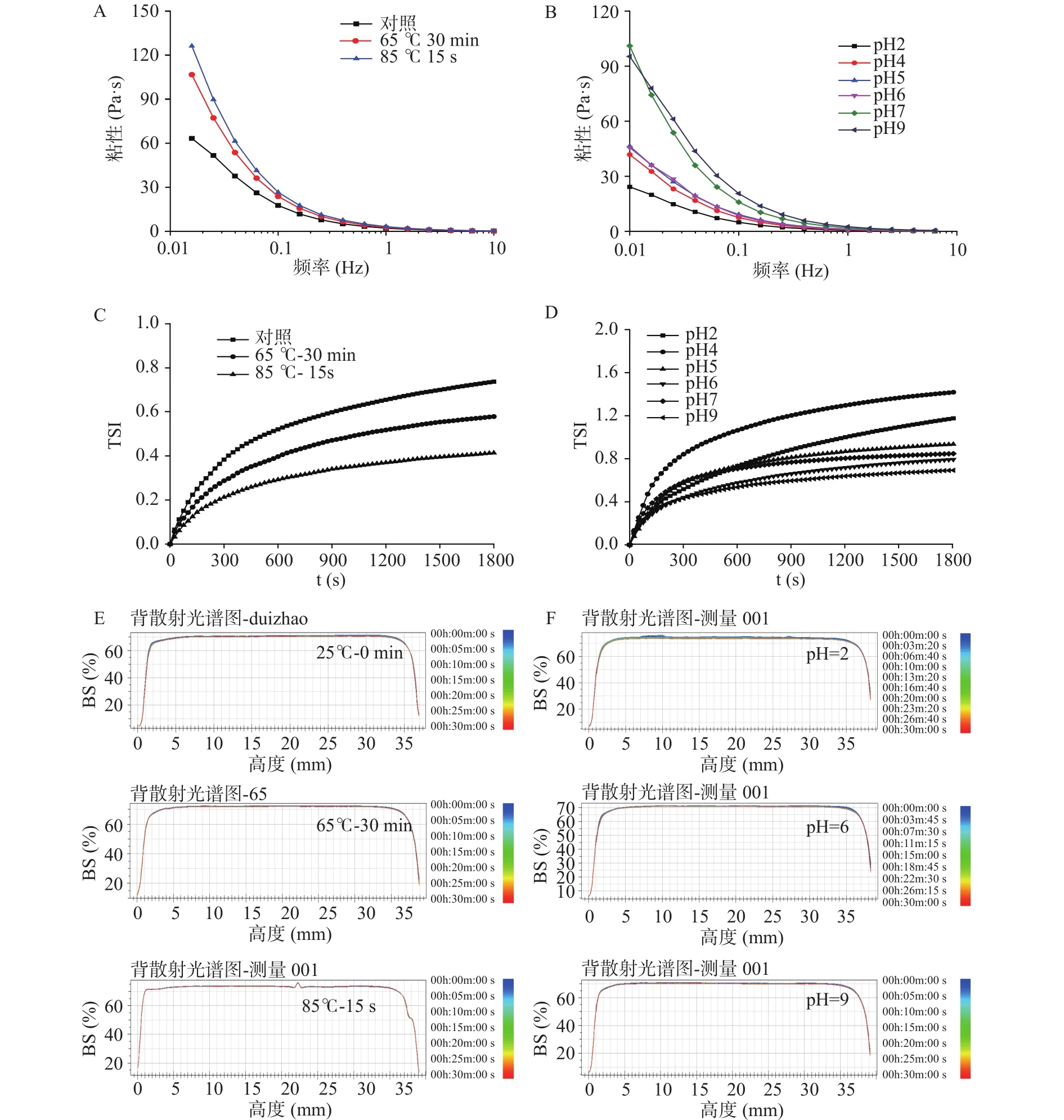
图8 模拟巴氏杀菌和pH迁移对磷虾油乳液流变特性(A,B)和稳定性(C,E,D,F)的影响Fig.8 Effects of pH migration on the rheological properties(A, B) and physical stability(C, E, D, F) of krill oil emulsions
3 结论
本研究在构建磷虾油乳液基础上,探究了内源性磷脂-WPI交互作用对磷虾油乳液物理稳定性的影响规律和作用机理,研究发现,随着载油量从5%增加至25%,磷虾油乳液平均粒径逐渐减小,然而Zeta电位绝对值逐渐降低,TSI值增大,乳液趋于不稳定。WPI使磷虾油乳液平均粒径增加4.5%~84.0%,Zeta电位绝对值增加10.6%~31.4%,TSI降低26.2%~70.3%,乳液稳定性增加。进一步研究发现,WPI能够通过增加磷虾油乳液的表观粘度,并基于与内源性磷脂交互作用改变WPI自身的二级结构、界面活性和表面疏水特性,从而对磷虾油乳液稳定性实现了正向调控。环境胁迫稳定性分析表明,模拟巴氏杀菌热处理提高了磷虾油乳液的物理稳定性,且向弱碱性pH迁移过程中(pH6~9)表现出较强的物理稳定性乳液。综上所述,内源性磷脂-WPI交互作用对构建高物理稳定性磷虾油乳液和拓宽其在健康食品体系中的应用提供了可能。
