治疗前炎症指标构建模型预测卵巢癌患者术后生存
2021-12-16顾正田康佳丽
李 希,林 敏,马 犇,顾正田,康佳丽
(广州市第一人民医院妇产科,广东广州 510180)
卵巢癌(ovarian cancer,OC)是女性生殖系统最常见的恶性肿瘤之一,致死率位居妇科恶性肿瘤第一位[1-2]。由于解剖位置特殊、病情进展迅速,卵巢癌早期病变不易被发现。多数卵巢癌患者在首诊或首次治疗时已属晚期[3],难以施行肿瘤根治性手术。化疗可以缓解病情,但患者常出现耐药后进展,预后较差。因此,寻找有效的早期诊断和预后指标,早期干预并给予精准的个体化治疗,对提高卵巢癌患者的治疗效能、避免不良反应、改善患者临床预后有重要临床意义[4-5]。系统性炎症反应在恶性肿瘤的发生发展中起重要促进作用,越来越多的证据表明系统性炎症反应标志物如中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)和血小板/淋巴细胞比值(platelet/lymphocyte ratio,PLR)等对治疗效果有重要预测价值,并与患者预后直接相关[6-8]。但既往研究中预测指标单一,缺少综合各炎性指标的预后模型。本研究旨在利用治疗前炎性指标等构建列线图模型,预测卵巢癌患者生存情况,为其选择恰当的治疗方式提供一定参考。
1 材料与方法
1.1 研究对象
本研究纳入2013年1月至2018年12月在广州市第一人民医院就诊的145例卵巢癌患者至研究组,同期60例良性卵巢肿瘤患者至对照组。按照随访截止日期时患者的生存情况,研究组分为术后生存亚组48例,死亡亚组97例。纳入标准:①良性卵巢肿瘤患者未合并急性或慢性感染,无自身免疫性疾病、血液系统疾病;②卵巢癌患者的组织病理学证实为上皮性卵巢癌(epithelial ovarian cancer,EOC);③EOC患者经诊断后接受标准手术治疗,并根据病理分级和分期行相应的术后化疗;④治疗前1周内有完整的血常规检测结果。排除标准:①排除术前输血、资料不全等患者;②近1个月内使用过激素或造血因子治疗的患者;③合并血液病、血栓性疾病、严重肝肾损伤、其他恶性肿瘤、感染性疾病、免疫性疾病等影响外周血炎症指标的患者。
本研究获得广州市第一人民医院伦理委员会批准(批件号:K-2021-066-01),所有患者均签署知情同意书。
1.2 研究变量
年龄、治疗前血常规中性粒细胞计数、淋巴细胞计数、血小板计数、单核细胞计数。并将外周血NLR定义为中性粒细胞与淋巴细胞计数比值;外周血PLR定义为血小板计数与淋巴细胞计数比值;单核细胞与淋巴细胞计数比值为(monocyte to lym⁃phocyte ratio,MLR);中性粒细胞计数与白蛋白比值为(neutrophil to albumin ratio,NAR)[9-10]。治疗前外周血白蛋白以及癌抗原125水平(cancer antigen 125,CA125),肿瘤病理类型、组织分化程度、腹水、FIGO分期、总体生存(overall survival,OS)等。
1.3 随 访
随访方式主要为我院定期门诊随访以及电话随访,生存结局为任何原因导致的死亡,生存期为患者术后开始至因任何原因引起死亡的时间。截止随访时间为2020年12月31日,随访时间为3~63个月,中位随访时间28个月。
1.4 统计方法
采用SPSS 25.0统计软件分析,以ROC曲线分析确定各指标的最佳截断值(cutoff values);连续变量以均值±标准差或者中位数(四分位数间距)[me⁃dian(IQR)]进行描述,分类变量以频数和百分比进行统计描述。连续变量采用t检验和U检验进行比较,分类变量采用卡方检验或Fisher′s精确概率方法比较。生存分析采用Kaplan-Meier方法,生存曲线的比较采用Log-rank检验;采用Cox回归模型分析可能影响生存时间的因素;应用R软件建立列线图预测模型,并验证拟合度。P<0.05时表示有统计学差异。
2 结果
2.1 临床特征
本项研究入组145例卵巢癌患者,中位年龄是53(46~59)岁,功能状态评分(performance status,PS)评分以0-1分者居多,达111例(76.6%);其中病理类型为浆液性癌的患者有81例(55.9%),透明细胞癌24例(16.6%),粘液性癌20例(13.79%),子宫内膜样腺癌12例(8.28%),鳞状细胞癌4例(2.76%),未分化癌4例(2.86%);术前有大量腹水(大于500 mL)的患者有53例(36.55%);淋巴结转移66例(45.5%);术后生存患者48例(33.1%),死亡患者97例(66.9%)。
2.2 卵巢癌患者治疗前炎症指标高于卵巢良性肿瘤患者
卵巢癌患者组的NLR、PLR、MLR、NAR均高于卵巢良性肿瘤组,差异具有统计学差异(P<0.05;表1)。
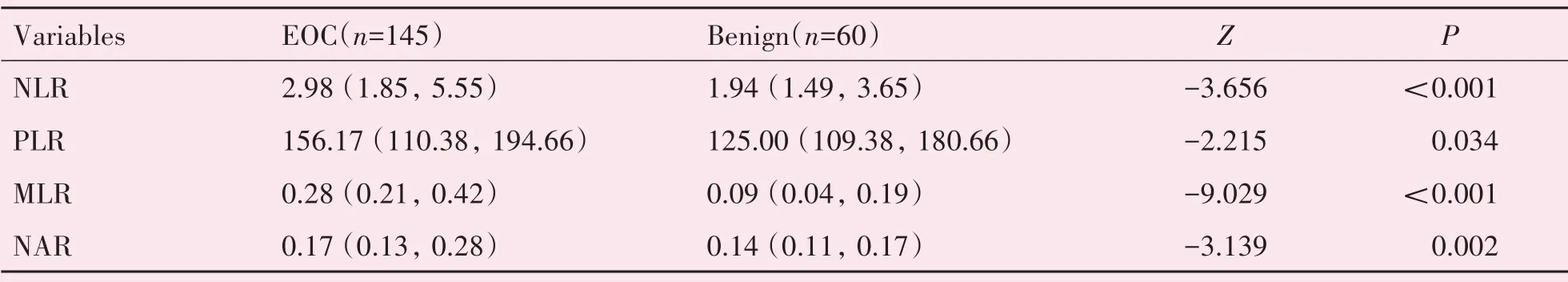
表1 卵巢癌组与卵巢良性肿瘤组术前外周血炎症指标水平对比Table 1 Comparison of parameters between ovarian cancer group and control group[median(IQR)]
2.3 治疗前炎性指标和基线资料与卵巢癌术后死亡风险的关系
根据随访截止日期时患者的生存情况,将患者分成生存亚组(48例)和死亡亚组(97例),生存亚组与死亡亚组患者年龄、FIGO分期、治疗前血清白蛋白水平、PLR、NLR、MLR、NAR等指标的差异有统计学意义(P<0.05),而外周血CA125水平、PS评分、伴随疾病(冠心病、糖尿病、高血压)、白细胞计数、淋巴细胞计数、中性粒细胞计数等方面差异无统计学意义(表2)。
表2 患者的临床特征与随访截止时生存状态的关系Table 2 The relationship between clinical characteristics and survival status at the end of follow-up [n(%),median(IQR),()]
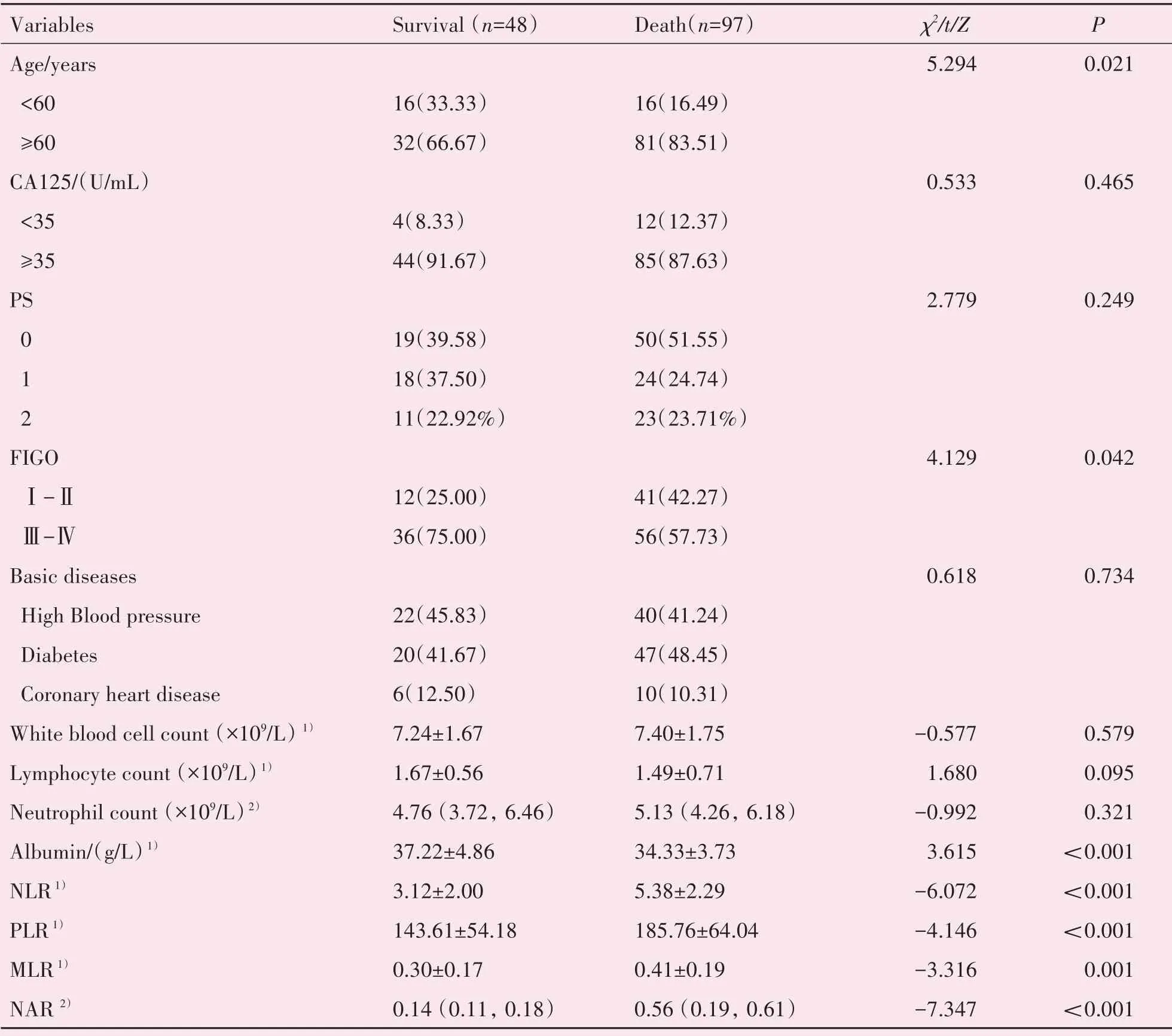
表2 患者的临床特征与随访截止时生存状态的关系Table 2 The relationship between clinical characteristics and survival status at the end of follow-up [n(%),median(IQR),()]
1)showed by ,compared by t-test;2)showed by median(IQR),compared by U test.The rest are compared byχ2.
2.4 治疗前炎症指标对卵巢癌死亡风险诊断效能
分别以NLR、PLR、MLR和NAR数值作为检验变量,以5年是否生存为状态标量绘制ROC曲线(图1),四种指标预测卵巢癌规范治疗后5年生存期的效能分析见表3。
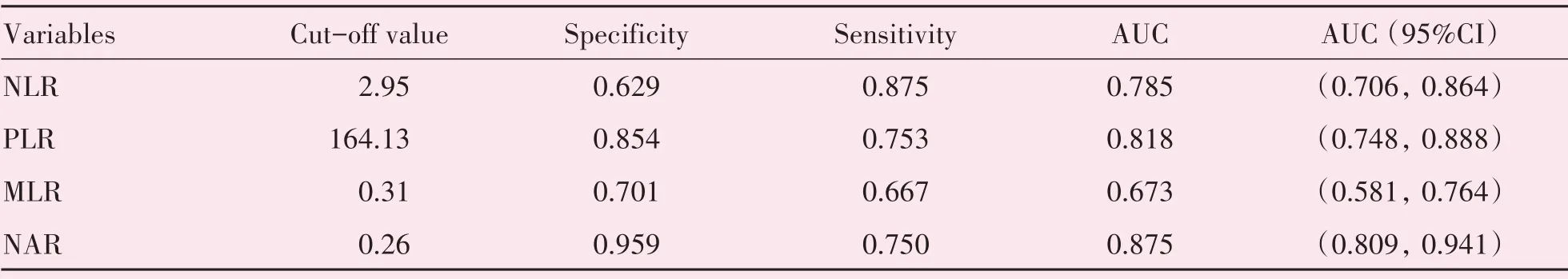
表3 卵巢癌患者治疗前炎性指标预测术后5年生存期的效能分析Table 3 The efficacy of pre-treatment inflammatory markers in predicting 5-year OS of patients with ovarian cancer
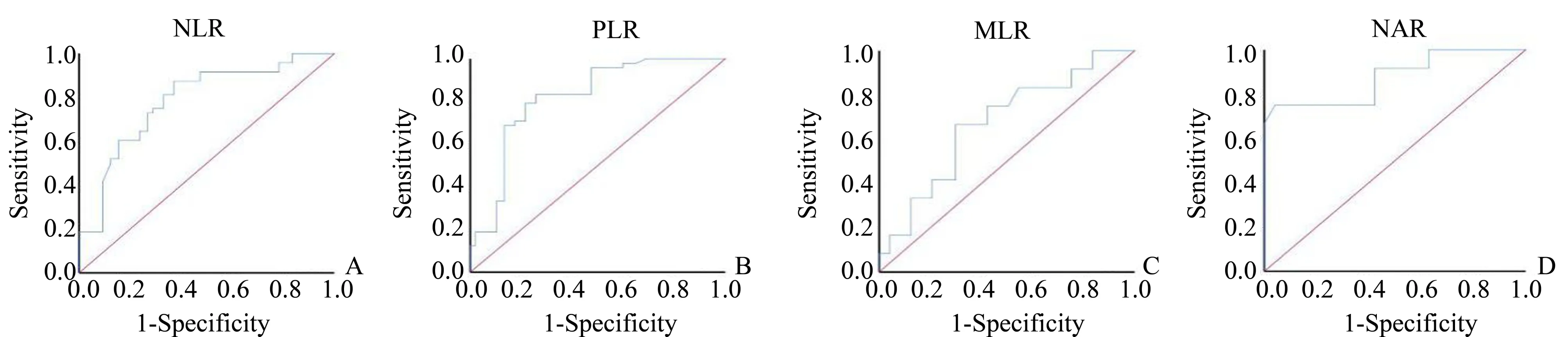
图1 治疗前炎性指标预测卵巢癌患者5年生存的ROC曲线分析Fig.1 ROC curve of pre-treatment inflammatory markers in predicting 5-year OS of patients with ovarian cancer
2.5 卵巢癌患者预后影响因素
单因素分析显示年龄、病理分型、腹水、淋巴结转移、FIGO分期、NLR、PLR、MLR、NAR与卵巢癌患者术后5年生存率显著相关(P<0.05),多因素分析显示病理分型、腹水、淋巴结转移、NLR、PLR、NAR是卵巢癌患者5年生存的独立影响因素(表4),其中NLR、PLR、NAR对卵巢癌患者术后5年生存率的预测曲线如图2。
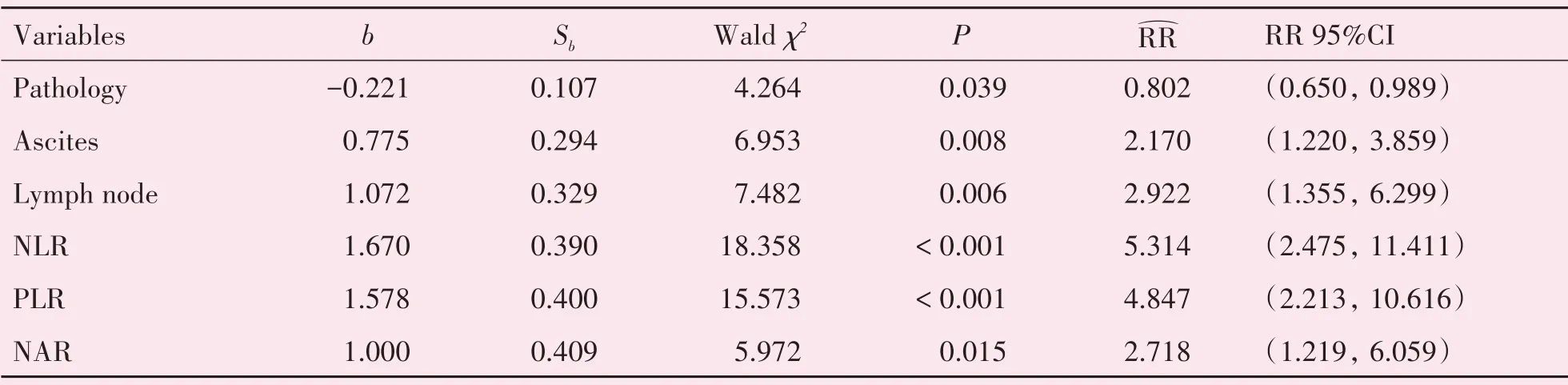
表4 影响卵巢癌患者术后5年生存的Cox多因素回归分析Table 4 Cox multivariate regression analysis of independent influencing factors for patients with ovarian cancer
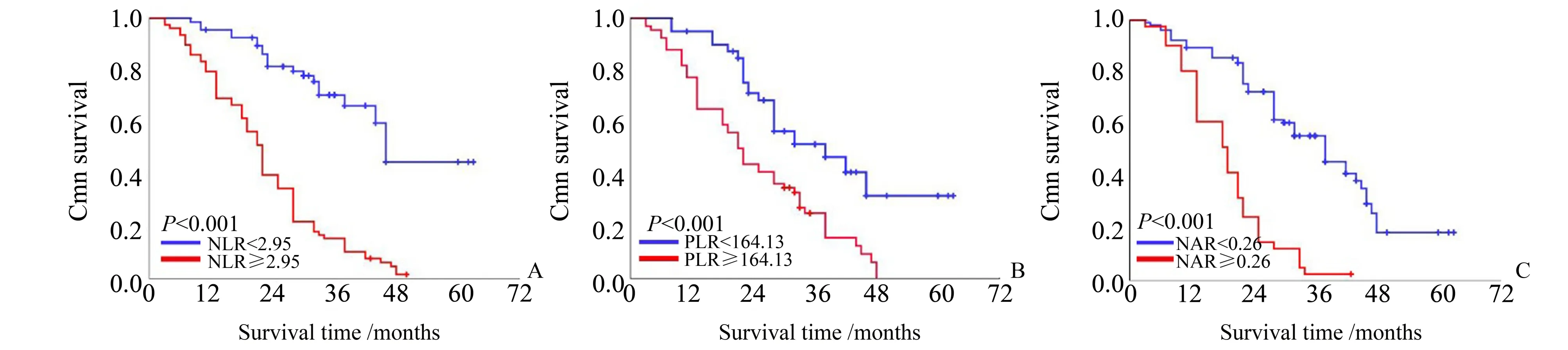
图2 治疗前炎性指标水平与卵巢癌患者术后总生存的关系Fig.2 Relationship between pre-treatment inflammatory markers and OS
2.6 列线图预测模型建立与评价
基于Cox多因素分析结果建立卵巢癌预后的列线图预测模型,每个预测指标刻度线数值与评分刻度值相对应,各项指标评分相加,所得总评分则对应患者术后5年生存率。同时内部验证列线图预测模型,列线图预测术后生存模型的C-index为0.865,95%CI(0.792,0.921),校准预测曲线和理想曲线拟合良好(图3)。
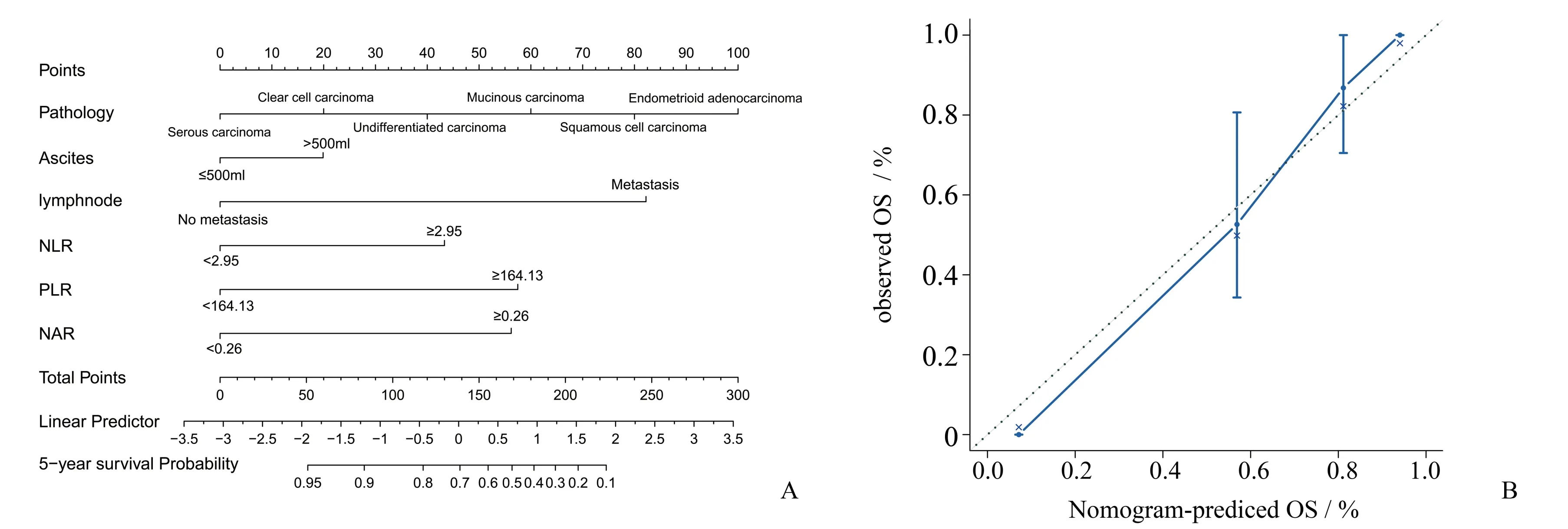
图3 预测卵巢癌术后生存的列线图模型及校准曲线Fig.3 The nomogram model and calibration curve for predicting postoperative survival of ovarian cancer
3 讨论
近年来,越来越多的证据[11-12]显示一些血液系统指标与肿瘤生物学功能密切相关,而慢性炎症与恶性肿瘤发生发展之间的关系也越来越引起人们的关注。Sun等[13]的研究显示NLR、PLR等炎症指标与食管癌的浸润、复发、转移显著相关,Ji等[6]的进一步研究显示术前炎性指标与肝癌患者的预后显著相关。为了明确治疗前炎性指标与卵巢癌的关系,我们首先探讨了卵巢癌患者NLR、PLR、LMR、NAR与卵巢良性肿瘤患者之间的差异,发现卵巢癌患者各指标均高于卵巢良性肿瘤患者,提示其与恶性肿瘤的进展相关。
既往研究[14-17]显示单核细胞可以促进肿瘤发生和肿瘤血管的生成,还可以抑制体内的抗肿瘤免疫反应,其分泌的促炎症细胞因子,如肿瘤坏死因子α(TNF-α)、白介素-1(IL-1)等与肿瘤患者预后不良相关,而淋巴细胞是参与免疫监督的一类重要细胞,它可以迁移至肿瘤微环境中形成肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL),诱导肿瘤细胞凋亡,从而抑制肿瘤的生长及转移。因此,单核细胞增加和淋巴细胞数量减少的患者即MLR含量增加时可能提示抑制肿瘤进展的能力降低,体现了肿瘤的进展情况;当NLR比值升高时提示机体内淋巴细胞数量减少、中性粒细胞数量增多,说明机体炎性反应增加,而淋巴细胞介导的抗肿瘤反应下降,进而体内免疫失衡,增加了肿瘤恶化和转移的风险;当患者营养较差、血清白蛋白水平较低时也即NAR比值增高时则进一步促进了肿瘤增殖和转移。血小板释放血小板衍生生长因子、VEGF和蛋白酶,促进肿瘤细胞的生长,增加血管通透性,使得肿瘤细胞容易穿透血管发生转移,同时血小板分泌P选择素导致炎性细胞与内皮细胞发生粘附,因此PLR与肿瘤的形成、转移和预后均密切相关。为了进一步探讨各炎症指标对卵巢癌死亡风险的诊断效能,我们利用ROC曲线进行分析,结果显示NAR的预测效能最高。单因素分析显示NLR、PLR、LMR、NAR的含量与患者死亡存在相关性,最终多因素分析发现NLR、PLR、NAR是影响卵巢癌患者预后的独立危险因素。
FIGO分期通常需要结合手术和病理检测结果才能对患者进行预后评估,而NLR、PLR、NAR检测简单易得,结果客观不易受人为因素干扰,同时检查创伤小、经济成本低,临床易推广应用。本研究将Cox多因素分析得出的结果为参照,建立卵巢癌患者术后5年生存情况列线图预测模型,列线图预测术后生存模型的C-index为0.865(95%CI:0.792-0.921),校准预测曲线和理想曲线拟合良好,说明本研究模型构建的科学性和合理性。然而本研究仅基于单中心样本建立风险评估模型,尚不能确定推广到广泛卵巢癌患者人群中的预测效果,因而仍需大样本、多中心的临床评估,以进一步验证本文数据和结果的可靠性和准确性。
综上,治疗前外周血的NLR、PLR、NAR值是卵巢癌患者预后的独立危险因素,以此为基础构建的列线图模型具有预测卵巢癌患者术后生存情况的潜在价值。
