三阴性乳腺癌细胞脂肪非典型钙黏蛋白4表达下调的生物学作用及机制
2021-12-15蒲卢兰谢少利李金穗苏小涵谭巧高砚春邓世山侯令密
蒲卢兰,谢少利,李金穗,苏小涵,谭巧,高砚春,邓世山,侯令密,3
[1.川北医学院附属医院甲状腺乳腺外科、乳腺癌生物靶向研究室、院士(专家)工作站,四川南充637000;2.川北医学院解剖学教研室,四川南充637000;3.四川大学华西医院营山医院甲状腺乳腺外科,四川南充637000]
三阴性乳腺癌(triple negative breast cancer,TNBC)是一种雌孕激素受体及HER-2 表达均呈阴性且恶性程度极高的乳腺肿瘤,因为缺乏特异性的治疗靶标,临床预后极差,寻找TNBC 早期诊断和治疗的靶点尤其重要[1-2]。课题组前期研究发现脂肪非典型钙黏蛋白4(FAT4)在TNBC 组织中呈低表达,FAT4 的低表达与TNBC 患者的恶性生物学特征(淋巴结转移、组织学分级等)及不良预后密切相关[3-4]。但是FAT4 影响TNBC 的具体机制尚不明确。相关研究表明FAT4 作为Hippo 信号通路的上游因子,能够诱导该通路的磷酸化影响肿瘤细胞的功能表型[5-8]。为进一步研究FAT4 对TNBC恶性生物学行为的影响,探讨FAT4 在TNBC 中的作用机制。本研究通过细胞学模型检测降低FAT4表达水平后TNBC 细胞系生物学行为(增殖与凋亡、迁徙与侵袭)的改变,并检测细胞EMT 表型及通路下游蛋白YAP 的表达及磷酸化改变,初步探讨其相关性与机理,旨在为FAT4 调节TNBC 增殖与凋亡、侵袭与转移的机制提供进一步的理论依据。
1 材料与方法
1.1 实验材料
人正常乳腺上皮细胞系MCF-10A 及TNBC 细胞系BT-549、MDA-MB-231、MDA-MB-468、MDA-MB-436 均购于中国科学院细胞总库;川北医学院分子免疫研究所提供转染所需大肠杆菌DH5α 菌;慢病毒载体介导的FAT4 沉默体系及对照,由上海吉凯基因化学技术有限公司负责构建及包装。
1.2 主要仪器设备
细胞培养箱:德国HERAEUS 公司;冷冻离心机:美国THERMO 公司;-80 ℃冰箱:英国ABCAM公司;流式细胞仪:美国BD 公司;PCR 仪:美国BIO-RAD 公司;超纯水器:中国四川卓越水处理设备有限公司;普通显微镜:日本OLYMPUS 公司。
1.3 主要实验试剂
胎牛血清:美国GIBCO 公司;RPMI-1640 培养基/胰蛋白酶:美国HYCLONE 公司;青/链霉素:美国 INVITROGEN 公司; shRNA-FAT4/shRNANegative Control:中国上海吉凯基因化学技术有限公司;DEPC:美国SIGMA 公司;CHAPS:美国AMRESCO 公司;Western blot 电泳液/转膜液/洗涤液:中国碧天云公司;Annexin V-FITC/PI 试剂盒:中国凯基生物公司;CCK-8 试剂盒:中国凯基生物公司;Transwell 试剂盒:美国MILLIPORE 公司;抗FAT4 抗体(Western blot)/抗β-actin 多克隆抗体/抗GAPDH 抗体:英国ABCAM 公司。
1.4 实验方法
1.4.1 细胞培养 将RPMI-1640 培养液中加入10%胎牛血清、1×105IU/L 链霉素、1×105IU/L 青霉素,制成培养液。正常人乳腺细胞株MCF-10A 及TNBC细 胞 株 BT-549、 MDA-MB-231、 MDA-MB-468、MDA-MB-436 在恒温细胞培养箱中培养(37 ℃,5%CO2)。
1.4.2 检测FAT4 在TNBC 细胞株中的表达水平 按照GIBCO 公司RNA 提取试剂盒操作说明提取细胞总RNA;BIO-RAD 公司蛋白质提取试剂盒操作说明书提取总蛋白;qRT-PCR 技术及Western blot 技术检测各细胞系中FAT4 的mRNA 及蛋白质的相对表达量。
1.4.3 构建及鉴定FAT4 低表达细胞系 FAT4-
shRNA 干扰序列(FAT4-shRNA1/2/3) 及阴性对照序列由上海吉凯基因化学有限公司设计合成。选择pGPU6/GFP/Neo 质粒作为载体包装shRNA,通过转染感受态大肠杆菌扩增质粒。293T 细胞接种到6 孔板进行转染实验。BT-549、MDA-MB-436 细胞系进行感染,提取细胞总RNA;qRT-PCR 检测各组细胞FAT4 mRNA 的相对表达情况;提取细胞总蛋白;Western blot 检测各组细胞FAT4 蛋白的相对表达情况(一抗:抗FAT4 抗体,1∶1 000,ab130076,Abcam;二抗:碱性磷酸酶标记羊抗兔IgG,1∶2 000,A0239,碧天云)。筛选出最有效的干扰片段进行后续实验,将TNBC 分别转染FAT4-shRNA (FAT4敲低组)和阴性对照序列(阴性对照组),以未转染的TNBC 作为空白对照组。
1.4.4 细胞增殖实验(CCK-8 实验) 将2×103/孔的细胞悬液加入96 孔板培养;将培养板分别培养细胞24、48、72 h 后每孔加入CCK8 试剂10 μL;孵育1 h(37 ℃,5%CO2);根据酶标仪测定吸光值分析细胞生长情况。
1.4.5 细胞凋亡实验 取转染72 h 后细胞,无血清培养基饥饿8 h,吸取500 μL 结合缓冲液重悬细胞后加入5 μL Annexin V-FITC 和5 μL PI;设置流式细胞仪工作程序(激发波长Ex=488 nm;发射波长Em=530 nm);Annexin V-FITC 的绿色荧光通过FITC通道(FL1)检测;PI 红色荧光通过PI 通道(FL3)检测,Flowjo v10 软件进行数据的统计与分析。
1.4.6 细胞迁徙实验 将小室放入24 孔板,在上室加入基质胶,将小室的下室面均匀涂抹纤维蛋白(10 mg/L),更换无血清培养基让细胞饥饿培养8 h;在Transwell 小室的上层小室中加入200 μL 细胞悬液,下层小室加入含10%的胎牛血清RPMI-1640 培养基;37℃培养箱孵育4 h;4%多聚甲醛固定,0.1%结晶紫染色微孔膜下面细胞;显微镜下选取3 个视野计数(200×),重复3 次取平均值。
1.4.7 Western blot 实验 按比例制备SDS-PAGE 胶,50 μg 蛋白样品加入上样孔槽中,转膜,TBST 液将PVDF 膜浸泡,平衡,封闭,一抗孵育(一抗:抗E-cadherin 抗体,1∶2 000,ab133597,Abcam;抗N-cadherin 抗体,1∶2 000,ab76057,Abcam),二抗孵育(碱性磷酸酶标记羊抗兔IgG,1∶2 000,A0239,碧天云),PVDF 膜置于暗室,用BICP/NBT phosphatase Substrate (KPL,美国) 避光显色;扫描并保存图像。
1.5 统计学处理
实验中涉及的所有需要进行统计学处理的实验数据,均采用SPSS 26.0 for Windows 统计软件进行分析,部分图片由GraphPad Prism 9 输出。计量资料用均数±标准差(±s)表示,组间比较用方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 FAT4在TNBC细胞系中的表达
以正常乳腺上皮细胞系MCF-10A 中FAT4 mRNA 表达量为参照,4 种TNBC 细胞系中FAT4 mRNA 相对表达量分别为BT-549:0.7012±0.044、MDA-MB-231:0.2899±0.035、MDA-MB-468:0.346±0.065、MDA-MB-436:0.5484±0.028,FAT4 mRNA 在各组细胞中表达有明显差异(F=169.842,P=0.000);相对于正常细胞系MCF-10A,各组的相对表达水平降低(均P<0.05)。在4 种TNBC 细胞系中,BT-549 和MDA-MB-436 细胞系中相对表达量较高(图1A)。以MCF-10A 中FAT4 蛋白表达量为参照,TNBC 细胞系中FAT4 蛋白相对表达量分别为BT-549: 0.7225±0.071、 MDA-MB-231: 0.4225±0.039、MDA-MB-468:0.4194±0.056、MDA-MB-436:0.6975±0.063;FAT4 蛋白在各组细胞中表达有明显差异(F=96.707,P=0.000);相对于正常细胞系MCF-10A,各组的相对表达水平降低(均P<0.05)。在4 种TNBC 细胞系中,BT-549 和MDA-MB-436 细胞系中相对表达量较高(图1B)。遂选取BT-549 和MDA-MB-436 细胞系进行后续实验。

图1 FAT4 mRNA及蛋白在各细胞系中的表达A:qRT-PCR检测FAT4 mRNA相对表达量;B:Western blot检测FAT4蛋白相对表达量Figure 1 Expressions of FAT4 mRNA and protein in cells of each cell lineA:Relative expression levels of FAT4 mRNA determined by qRT-PCR;B:Relative expression levels of FAT4 protein determined by Western blot
2.2 下调FAT4 表达对TNBC 细胞系的增殖能力的影响
在BT-549 细胞系中,转染24、48、72 h 各组细胞OD 值:空白对照组分别为0.322±0.032、0.467±0.042、0.563±0.063;阴性对照组分别为0.341±0.043、0.493±0.053、0.586±0.084;FAT4 敲低组分别为0.492±0.053、0.675±0.084、0.782±0.065。3 个时间点各组间OD 值差异均有统计学意义(F=22.38,P=0.000;F=16.538,P=0.000;F=14.294,P=0.001);其中,FAT4 敲低组在3 个时间的OD 值均明显高于空白对照组与阴性对照(均P<0.05),而后两组在3 个时间点的OD 值差异均无统计学意义(均P>0.05)。在MDA-MB-436 细胞系中,24、48、72 h 各组细胞OD 值:空白对照组分别为0.333±0.076、0.396±0.086、0.505±0.048;阴性对照组分别为0.374±0.042、0.432±0.046、0.532±0.104;FAT4 敲低组分别为0.457±0.046、0.556±0.093、0.798±0.096。3 个时间点各组间OD 值差异均有统计学意义(F=6.308,P=0.013;F=5.801,P=0.017;F=5.801,P=0.017)。其中,FAT4 敲低组在3 个时间的OD 值均明显高于空白对照组与阴性对照(均P<0.05),而后两组在3 个时间点的OD 值差异均无统计学意义(均P>0.05)(图2)。

图2 下调FAT4对BT-549和MDA-MB-436细胞系的增殖能力的影响Figure 2 Effect of down-regulation of FAT4 on the proliferation of BT-549 and MDA-MB-436 cell lines
2.3 下调FAT4表达对TNBC细胞系凋亡的影响
流式细胞仪检测结果显示,在BT-549 细胞中的凋亡率分别为:空白对照组(15.16±0.62)%、阴性对照组(17.24±0.27)% 、 FAT4 敲低组(7.0±0.94)%,FAT4 敲低组的凋亡率明显低于空白对照组与阴性对照组(均P<0.05),而后两组的细胞凋亡率差异无统计学意义(P>0.05);在MDAMB-436 细胞中的凋亡率分别为:空白对照组(18.31±0.55)%、阴性对照组(20.27±0.47)%、FAT4 敲低组(8.90±0.48)%,FAT4 敲低组的凋亡率明显低于空白对照组与阴性对照组(均P<0.05),而后两组的细胞凋亡率差异无统计学意义(P>0.05)(图3)。

图3 下调FAT4对BT-549和MDA-MB-436细胞系凋亡的影响Figure 3 Effect of down-regulation of FAT4 on apoptosis of BT-549 and MDA-MB-436 cell lines
2.4 下调FAT4 对TNBC 细胞系迁移和侵袭能力的影响
Transwell 小室实验结果发现,降低FAT4 表达水平后,在BT-549 细胞系中,各组穿室细胞数分别为:空白对照组(39±6) 个、阴性对照组(44±5) 个、FAT4 敲低组(59±10) 个,各组间差异有统计学意义(F=9.617,P=0.003)。其中,FAT4 敲低组的穿室细胞数明显多于空白对照组与阴性对照组(均P<0.05),而后两组的穿室细胞数差异无统计学意义(P>0.05)。在MDA-MB-436 细胞系中,各组穿室细胞数分别为:空白对照组(36±7)个、阴性对照组(42±9)个、FAT4 敲低组(62±9) 个,各组间差异有统计学意义(F=13.942,P=0.001)。其中,FAT4 敲低组的穿室细胞数明显多于空白对照组与阴性对照组(均P<0.05),而后两组的穿室细胞数差异无统计学意义(P>0.05)(图4)。
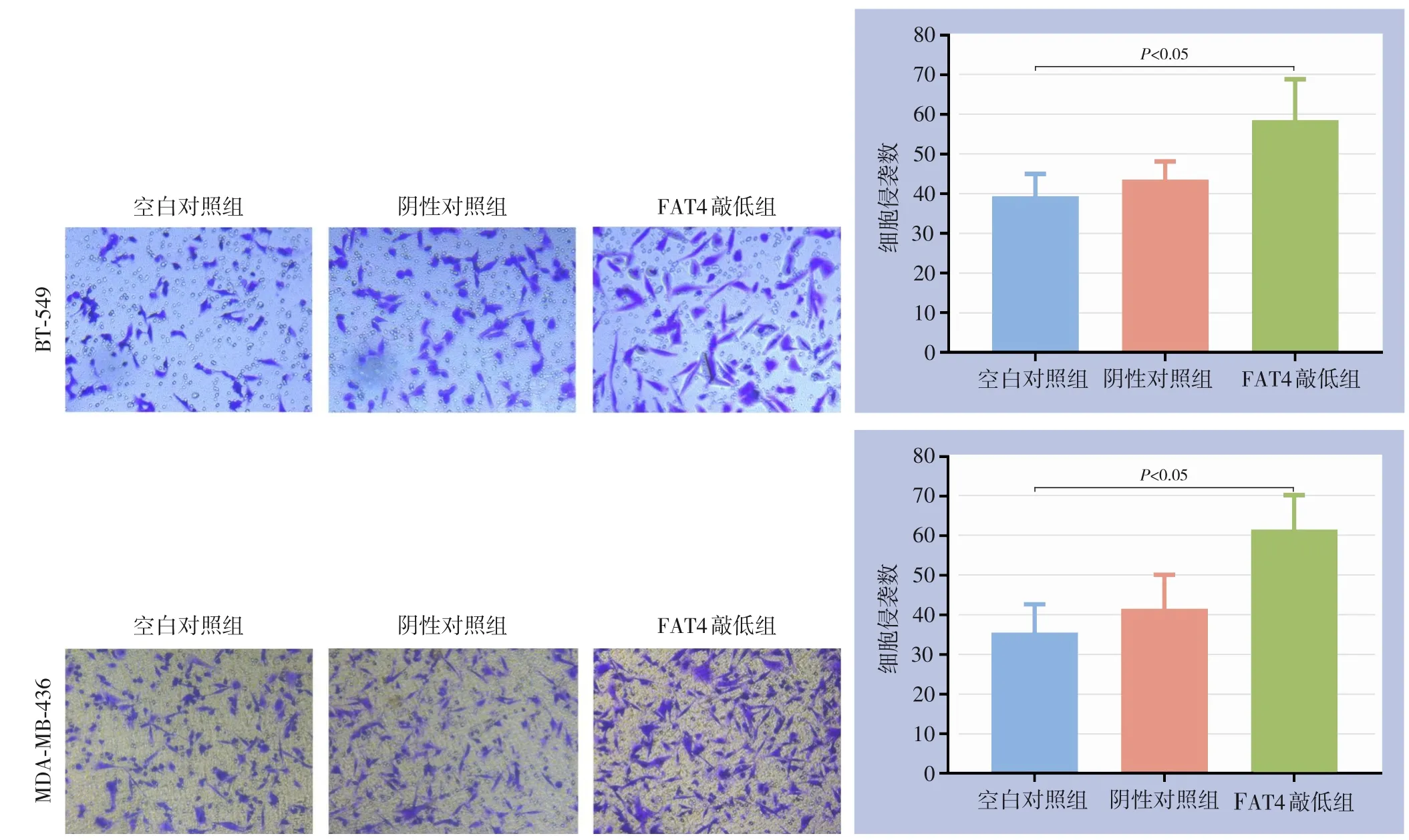
图4 下调FAT4对BT-549和MDA-MB-436细胞系迁移和侵袭能力的影响Figure 4 Effect of down-regulation of FAT4 on migration/invasion abilities of BT-549 and MDA-MB-436 cell lines
2.5 下调FAT4 表达水平对TNBC 细胞系Hippo 信号通路的影响
在BT-549 细胞系中,以空白对照组为参照,阴性对照组、FAT4 敲低组中YAP 蛋白相对表达量为0.954±0.062、 0.942±0.04; 磷酸化YAP (p-YAP) 蛋白相对表达量为0.963±0.079、0.263±0.088; E-cadherin 相对表达量为0.972±0.025、0.234±0.032; N-cadherin 相对表达量为0.982±0.044、1.796±0.092。各组间YAP 蛋白表达无明显差异(F=2.636,P=0.112 5);各组间p-YAP 蛋白表达有明显差异(F=143.537,P=0.000), 其中,FAT4 敲低组p-YAP 蛋白表达量明显低于阴性对照组与空白对照组(均P<0.05),而后两组间差异无统计学意义(P>0.05); 各组间E-cadherin 与N-cadherin 表达量均有明显差异(F=394.452,P=0.000;F=212.208,P=0.000),其中,FAT4 敲低组的E-cadherin 表达量较阴性对照组与空白对照组明显降低,而N-cadherin 表达量较阴性对照组与空白对照组明显升高(均P<0.05),而阴性对照组与空白对照组间E-cadherin 与N-cadherin 表达量差异均无统计学意义(均P>0.05)。在MDA-MB-436 细胞系中,以空白对照组为参照,阴性对照组、FAT4 敲低组中YAP 蛋白相对表达量为0.961±0.035、0.972±0.029;p-YAP 蛋白相对表达量为0.964±0.031、 0.275±0.032; E-cadherin 相对表达量为0.948±0.046、0.194±0.056;N-cadherin 相对表达量为0.963±0.049、2.181±0.193。各组间YAP 蛋白表达无明显差异(F=2.397,P=0.133);各组间p-YAP蛋白表达有明显差异(F=400.352,P=0.000),其中,FAT4 敲低组p-YAP 蛋白表达量明显低于阴性对照组与空白对照组(均P<0.05),而后两组间差异无统计学意义(P>0.05);各组间E-cadherin 与Ncadherin 表达量均有明显差异(F=390.204,P=0.000;F=160.888,P=0.000),其中,FAT4 敲低组的E-cadherin 表达量较阴性对照组与空白对照组明显降低,而N-cadherin 表达量较阴性对照组与空白对照组明显升高(均P<0.05),而阴性对照组与空白对照组间E-cadherin 与N-cadherin 表达量差异均无统计学意义(均P>0.05)(图5)。

图5 下调FAT4对TNBC细胞系Hippo信号通路和EMT表型的影响Figure 5 Effect of down-regulation of FAT4 on Hippo signaling pathway and EMT phenotype in TNBC cell lines
3 讨论
TNBC 作为一种恶性程度极高的乳腺癌亚型,受到科研与临床的高度重视[9-11]。尽管国际上开展了大量的针对性临床试验,但其治疗现状一直未得到较好的改善[9,12-13]。目前迫切需要寻找有效诊断TNBC 的特异性治疗靶点,临床策略提供新径。
本研究筛选了FAT4 相对稳定高表达的TNBC细胞系BT-549 和MDA-MB-436 进行细胞功能验证实验。CCK-8 实验发现降低FAT4 表达后,BT-549 和MDA-MB-436 细胞系的增殖能力显著加强。细胞的增殖能力作为肿瘤细胞的一个特异性标志,与肿瘤的恶性程度直接相关[14-15]。Ragni 等[16]通过对小鼠心肌细胞的体内模型研究发现,FAT4 可能通过Hippo 通路调节下游YAP 核转位促进心肌细胞的增殖能力,FAT4 突变的小鼠因FAT4 低表达导致心肌细胞增殖能力增加而心肌更肥厚。细胞凋亡是一个严格调控的生物学过程,在参与组织重塑、维持组织稳态平衡和促进损伤修复中起着重要作用[17]。凋亡的调节失衡可能与恶性肿瘤的发生有着极为紧密的联系[18-19]。Ma 等[20]通过流式细胞仪检测发现降低FAT4 表达能够减弱胃癌细胞的凋亡能力。本研究通过流式细胞术发现,降低FAT4 表达能够抑制细胞的凋亡能力,促进肿瘤细胞的恶性发展。Transwell 小室实验显示,FAT4 低表达后细胞侵袭转移能力显著加强,说明在TNBC 的恶性生物学进程上,FAT4 起到了重要的调节作用。Ma等[20]通过细胞学模型也发现FAT4 低表达后胃癌细胞侵袭转移能力增强,可能与细胞上皮间质转化有关,而上皮间质转换的表达能直接引起细胞侵袭转移能力的增强。
Western blot 检测上皮细胞和间充质细胞表面标志物的变化,结果发现FAT4 敲低组中TNBC 细胞的上皮细胞表面分子E-cadherin 表达显著降低,间质细胞表面分子N-cadherin 表达显著增高。说明FAT4 的低表达在一定程度上促进了EMT 的生物学进程。而EMT 作为一个特殊生理环境下的生物学状态,在许多肿瘤的远处转移中均被实验证明EMT 的存在[21-25]。能够引起EMT 表型的变化,无疑是FAT4 影响TNBC 细胞侵袭与转移最直接的证据。Zhou 等[26]建立小鼠转移性乳腺癌模型,通过对原发肿瘤、循环血液和转移灶中的肿瘤细胞进行提取分析,结果显示乳腺癌转移的病理生理过程是由癌细胞的动态EMT 所介导的,阻断EMT 可能成为防治乳腺癌转移的新策略。Cai 等[27]发现敲除FAT4 后胃癌细胞增殖和转移能力增强,且FAT4 通过对Wnt/β-catenin 信号通路调控来抑制肿瘤的EMT。FAT4 在TNBC 中也很可能参与EMT 的诱导发生,但目前相关具体机制与报道甚少。
FAT4 在Hippo 信号通路中发挥上游促发因子的作用,该通路的作用靶点主要是下游蛋白YAP,Hippo 通路的激活能够引起YAP 蛋白的第127 位丝氨酸残基磷酸化,使YAP 与14-3-3 蛋白结合停留在细胞质;而阻断该通路可降低YAP 磷酸化水平,未磷酸化的YAP 能够顺利进入细胞核与转录因子TEAD 结合,诱导细胞增殖与肿瘤产生[21-22,28-30]。因此YAP 的磷酸化对能够降低细胞增殖、迁移的能力。该结果表明,FAT4 的表达水平与下游YAP 的表达水平没有显著的相关性,但是YAP 的磷酸化水平却显著降低,说明FAT4 影响下游靶点YAP 的磷酸化水平,可能通过该信号通路,调控TNBC 细胞生物学行为的变化。Li 等[31]在鼻咽癌顺铂耐药细胞中发现了EMT 特性加强,细胞增殖和迁徙能力增强,而通过消耗Hippo 信号通路下游逆转EMT 表型,且恢复耐药细胞的治疗敏感性。但是Hippo 信号通路在TNBC 中的研究目前报道较少,该通路的验证,能为TNBC 的基础研究拓展思路,为后期临床转归和甚至药物靶点设计指明了方向。
本研究发现,降低FAT4 表达水平后TNBC 细胞系BT-549 和MDA-MB-436 细胞增殖能力增强、凋亡能力减弱、侵袭迁移能力增强。FAT4 可能通过Hippo 信号通路诱导TNBC 细胞EMT 的发生,影响肿瘤细胞侵袭迁移能力。说明FAT4 可能对TNBC发生发展有重要影响,有可能成为早期诊断和治疗的候选基因。
