致对虾肝胰腺坏死病副溶血弧菌荧光定量PCR 检测方法的建立
2021-12-15陈平亚张亮亮吴少荣黄纪徽王绥家吴山楠
陈平亚,张亮亮,吴少荣,黄纪徽,王绥家,吴山楠
(海口海关技术中心,海南 海口 570311)
【研究意义】对虾急性肝胰腺坏死病(Acute Hepatopancreatic Necrosis Disease,AHPND)是一种细菌性病害,通常在放苗35 d 左右暴发,病死率高,曾造成我国海南、广东、福建和广西对虾养殖场大面积发病。该病一般在高温干旱季节的高盐、高碱养殖池中具有较高的发病几 率[1]。斑节对虾(Penaeus monodon)、凡纳滨对虾(Litopenaeus vannamei)和中国对虾(Fenneropenaeus chinensis)都是 AHPND 的易感种群[2]。患病对虾出现空肠空胃或肠断节,肝胰腺萎缩或肿大、呈红褐色或发白,甲壳变软等症状,死亡率极高。AHPND 的组织学病理特征是肝胰腺上皮细胞脱落,由于血细胞活动形成黑色素沉积,在该病晚期肝胰腺内的黑点更加明显,并有大量血细胞聚集[3-4]。AHPND 病原菌是一种携带PVA1 毒素质粒的嗜盐海洋性副溶血性弧菌(Vibrio parahaemolyticus,VpAHPND)。嗜盐海洋性副溶血性弧菌与已知的副溶血性弧菌分离株的基因不同,这种新菌株携带一个或多个染色体外PVA1 质粒。并非所有副溶血弧菌都表现出AHPND 致病性[5],PVA1 质粒携带编码毒素蛋白的基因却能够导致AHPND。因此依据PVA1 质粒设计特异性引物和探针对嗜盐海洋性副溶血性弧菌的检测十分必要。
【前人研究进展】对VpAHPND全基因组测序发现,其携带了约 69 kb 大小的毒力质粒,包含一组共轭转移基因和两个质粒启动基因,是一种自传递的质粒[6-7]。毒力质粒具备质粒解离后致死系统,可防止质粒在后代细胞中发生丢失,这种毒性质粒可通过接合传播,并可在受体中永久遗传[8]。基因敲除或自然缺乏Pir毒素基因,可使菌株明显丧失致病能力,因此推断Pir 毒素可能是AHPND 的主要致病因子。该质粒能编码表达转座酶、类病毒蛋白PirA、pirB等毒素蛋白质,pirB毒素主要决定副溶血弧菌的毒力,PirA致病力相对较弱[9]。AHPND 质粒携带株的质粒拷贝数在很低的情况下分泌的毒素对对虾的致病性很高,说明毒素蛋白的分泌不取决于该质粒的拷贝数[10]。具有pirB基因但缺失PirA基因的突变菌不会引起AHPND 病害,但对对虾仍有40%的致病性[11-12]。
【本研究切入点】本研究针对pirB基因设计特异性引物和探针,对AHPND 进行检测。由于甲壳动物缺乏特异性免疫机制,AHPND 缺乏有效的防治措施[13],因此及早检测和诊断水产动物是否被感染,并采取相应措施防止该病毒继续扩散,是水产养殖减少损失的有效途径。【拟解决的关键问题】AHPND 的常规 PCR 检测方法是以pirAvp毒力基因为靶基因来检测VpAHPND,通过检测pirA毒力基因拷贝数实现对VpAHPND的定量检测,从而分析病原菌的侵染途径,但pirA毒力基因的分子检测结果阳性强度低,本试验以pirB毒力基因为靶基因建立实时荧光PCR 方法,以期有效检测VpAHPND。
1 材料与方法
1.1 试验材料
供试菌株由海口海关技术中心动物实验室分离保存,包括VpAHPND-HK190423 株、单增李斯特菌Listeria monocytogenes、粪 肠球菌Enterococcus faecalis、金黄色葡萄球菌Staphylococcus aureus、福氏志贺氏菌Shigella flexneri、副溶血性弧菌Vibrio parahaemolyticus、大肠埃希氏菌Escherichia coli、阪崎肠杆菌Enterobacter sakazakii、伤寒沙门氏菌Salmonella enteritidis、溶藻弧菌Vibrio alginolyticus、河流弧菌Vibrio fluvialis、创伤弧菌Vibrio vulnificus、哈氏弧菌Vibrio harveyi等。对虾样品从海口市周边对虾养殖场采集,包括45 份凡纳滨对虾、57 份斑节对虾和42 份中国对虾。
试验主要试剂:Taq酶、dNTP 等试剂购自TaKaRa(大连)公司;细菌基因组DNA 提取试剂盒、质粒提取试剂盒和胶回收试剂盒购自生工生物工程(上海)股份有限公司;感受态细胞DH5α、Pmd18-T-Simple Vector、限制性内切酶和T4 连接酶购自大连宝生物公司;3%APW 培养基、TCBS、营养琼脂购于北京陆桥技术公司。试验主要仪器:ABI ViiATM7 实时定量 PCR 仪、北京六一DYY-6C 型电泳仪、英国UVItec 公司凝胶成像系统。
1.2 试验方法
1.2.1pirB基因特异性引物、探针设计 从GenBank 上获得VpAHPND菌株pirB基因序列,应用Oligo6.0 软件设计引物和探针。引物pirBF:5'-TTCATATTCACCTGCTGTTGG-3',pirBR:5'-ACGATTTCGACGTTCCCCAA-3';TaqMan 探针:5'-FAM-ACTATATTGCTACAGGTACGG AAGATGA-TAMRA-3'。引物和探针由生工生物工程(上海)股份有限公司合成。
1.2.2 巢式PCR扩增 质粒AP4-1引物:F1:5'-ATGAGTAACAATATAAAACATGAAAC-3';R1:5'-ACGATTTCGACGTTCCCCAA-3'。质粒AP4-2引物:F2:5'-TTGAGAATACGGGACGTGG G-3';R2:5'-GTTAGTCATGTGAGCACCTTC-3'。反应体系为:10×PCR buffer 2.0 μL,AP4-1上下游引物(10 μmol/L)各2 μL,dNTP(10 mmol/L)4 μL,TaqDNA聚合酶 1.0 μL,模板DNA 4 μL,加ddH2O补至25 μL。扩增程序为:94 ℃ 3 min;95 ℃ 30 s、56 ℃ 30 s、71 ℃ 90 s,35个循环;72 ℃ 4 min。取第一步的PCR产物,进行第二步nested-PCR。反应体系为:10×PCR buffer 3.0 μL,AP4-2上下游引物(10 μmol/L)各1 μL,dNTP(10 mmol/L)4 μL,TaqDNA聚合酶0.5 μL,第一步PCR产物 4 μL,加ddH2O补至25 μL。扩增程序为:95 ℃ 3 min;95 ℃ 30 s、56℃30 s、72 ℃ 90 s,30个循环;72 ℃ 2 min。
1.2.3pirB基因标准质粒构建 根据pirB基因序列,设计特异性引物克隆pirB基因。采用 Primer 6.0引物设计软件,设计带酶切位点的特异性引 物,F:5'-CGGGATCCATGACTAACGAATACG TTGTAAC-3'(下划线部分为BamHⅠ酶切位点),R:5'-CCGCTCGAGCTACTTTTCTGTACCAAATTC ATCG-3'(下划线部分为XohⅠ酶切位点)。以提取的VpAHPND菌株 DNA 为模板,使用上述引物进行PCR 扩增,反应体系(25 μL):2 ×PremixTaq12.5 μL,上、下游引物各1.0 μL(10 μmol/L),模板2.0 μL,ddH2O 8.5 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 5 min。将含有目的基因片段的PCR 产物和载体用BamH Ⅰ和XohⅠ酶切,T4 连接酶连接到pMD18-T 载体中制备重组质粒,转化到感受态大肠埃希菌DH5α,涂在含有氨苄青霉素钠的LB琼脂平板上,挑单个独立菌落接种至LB培养基中,摇床震荡培养14 h。经质粒提取试剂盒回收、纯化,送生工生物工程(上海)股份有限公司测序。将测序结果正确的重组质粒作为阳性外参对照。质粒拷贝数按照公式计算:拷贝数(拷贝/μL)=质粒浓度(g/μL)× 6.02 × 1023/质粒分子量,质粒分子量=碱基对平均分子量(660)×重组质粒总长度(2692+1172),测得拷贝数为2.3×107拷贝/μL。
1.2.4pirB基因实时荧光PCR 反应条件优化以2.3×107拷贝/μL 标准品DNA 为模板,在56~65 ℃范围内,以1 ℃梯度进行荧光定量PCR扩增,以获得最低循环数(Ct)值和较高的相对荧光强度增加值(ΔRn)时的退火温度。采用引物不同终浓度(0.1~0.6 μmol/L)与探针不同终浓度(0.10~0.50 μmol/L)组合进行荧光定量PCR,以获得最低的Ct 值和较高的ΔRn 时的引物和探针浓度组合。反应体系补充ddH2O 至25 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s、57 ℃ 30 s、72 ℃ 30 s,30 个循环;72 ℃ 5 min。选取ΔRn 值最大且所用引物和探针浓度最小为反应体系。
1.2.5 荧光定量PCR 的特异性、灵敏度、重复性试验 以VpAHPND菌株、单增李斯特菌、粪肠球菌、金黄色葡萄球菌、福氏志贺氏菌、副溶血性弧菌、大肠埃希氏菌、阪崎肠杆菌、伤寒沙门氏菌、溶藻弧菌、河流弧菌、创伤弧菌、哈氏弧菌等病原体作为阴性对照菌株,并用ddH2O 作为无模板空白对照验证荧光PCR 法检测副溶血性弧菌pirB基因的特异性。
对已知拷贝数含有目的扩增片段的PMD18-pirB重组质粒进行10 倍梯度稀释,以各梯度质粒为模板进行荧光PCR 检测,确定该方法对靶基因的最低检出限。
设计4 组样品,分别取108、107、106、105浓度的VpAHPND菌株PMD18-pirB重组质粒进行PCR 试验,每组4 次组内重复,测Ct 值求其平均值和标准差S,计算各组变异系数CV,以检测的Ct 值变异系数(标准偏差/重复值的平均数)初步评估该方法的重复性。
1.3 对虾样品荧光RT-PCR 方法的应用
分别取3 种对虾0.5 g 鳃和肝胰腺组织于1.5 mL 离心管中,加入0.5 mL 灭菌生理盐水后研磨匀浆,按照基因组DNA 快速提取试剂盒按说明书提取总DNA 作为模板。用建立的TaqMan 探针荧光定量PCR 进行检测,同时采用世界动物卫生组织(OIE)推荐的套式PCR 法检测样品,检测结果与荧光探针法进行比较。
2 结果与分析
2.1 克隆载体的构建
以VpAHPND菌株提取的DNA 为模板,经PCR获得的目的片段用1%琼脂糖凝胶电泳检测,获得pirB基因的特异性条带(1 172 bp,图1)。回收纯化扩增PCR 产物并与pMD18-T 克隆载体连接获得重组克隆质粒pMD18-T-pirB,目的基因和重组克隆质粒同时用BamH Ⅰ和XohⅠ进行酶切、T4 连接酶连接后转化到感受态细胞DH5α中进行扩增,筛选阳性克隆子pMD18-T-pirB,并对阳性克隆载体进行双酶切验证,经BamH Ⅰ/XohⅠ双酶切鉴定,有一条大小约1 200 bp的片段,与目的片段大小一致,另一条大小约2 600 bp 的载体片段,与克隆载体pMD18-T 大小一致(图2)。
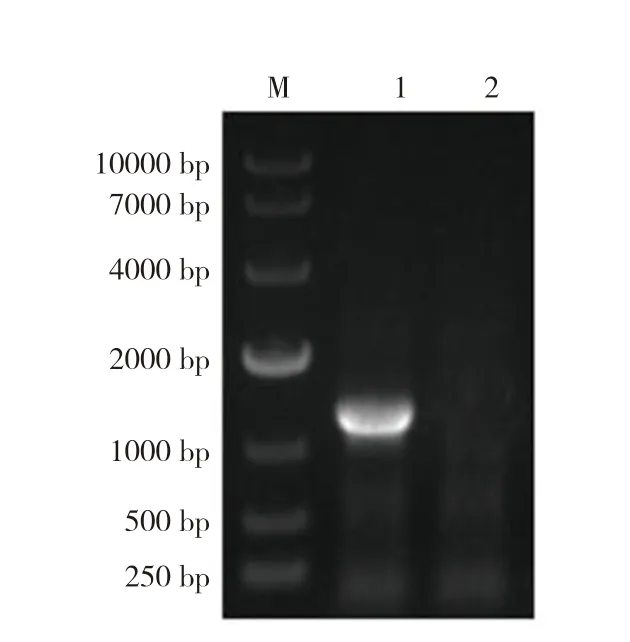
图1 pirB 基因扩增产物Fig.1 PCR amplification products of pirB gene
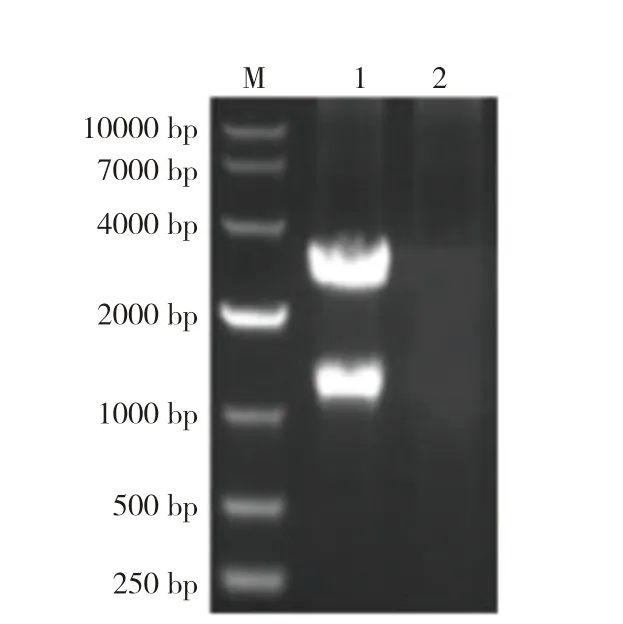
图2 pMD18-T-pirB 质粒酶切鉴定Fig.2 Identification of pMD18-T-pirB plasmid
2.2 荧光定量PCR 反应条件的优化
引物和探针浓度筛选试验结果表明,采用0.5 μmol/L 引物和0.2 μmol/L 探针进行检测,获得的Ct 值最小且荧光增加值较大,因此确定引物和探针的最佳浓度分别为0.5、0.2 μmol/L。对荧光定量PCR 反应体系中其余各组分浓度进行优化,最终确定优化后的副溶血性弧菌pirB荧光PCR 反应体系(25 μL)为:Probe qPCR Mix 10 μL,上、下游引物各1.0 μL,探针1.0 μL,模板2 μL,用灭菌ddH2O 补足至25 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s、57 ℃ 30 s、72 ℃ 30 s,30 个循环;72 ℃ 5 min。在每次延伸结束时收集荧光信号。
2.3 荧光定量PCR 特异性分析
用所建立的RT-PCR 检测方法对VpAHPND菌株、单增李斯特菌、粪肠球菌、金黄色葡萄球菌、福氏志贺氏菌、副溶血性弧菌、大肠埃希氏菌、阪崎肠杆菌、伤寒沙门氏菌、溶藻弧菌、河流弧菌、创伤弧菌、哈氏弧菌等病原菌进行检测,结果显示只有VpAHPND菌株出现典型的扩增曲线,而其他对照菌株和空白对照均未出现扩增曲线。说明建立的荧光定量PCR 法对VpAHPND的检测具有很强的特异性(图3)。

图3 TaqMan PCR 方法特异性分析Fig.3 Specific analysis of TaqMan PCR method
2.4 pMD18-T-pirB 质粒RT-PCR 灵敏度分析
用ddH2O将2.3×107拷贝/μL的pMD18-TpirB质粒作10倍系列稀释,取各个稀释度作荧光PCR检测确定其最低检出限,结果显示在pMD18-T-pirB质粒拷贝数为2.3×101时,Ct值为34.27,表明该检测方法至少能检测到2.3个质粒拷贝数(图4)。为保证检测结果的准确性,在实际检测中以 Ct值 35为界限,若检测样品的Ct值≤35,且有扩增曲线,则判为VpAHPND阳性;Ct值>35,且有扩增曲线,则重复1次,如结果一致判为VpAHPND阳性;Ct 值>35,重复结果未出现扩增曲线,判为VpAHPND阴性。

图4 TaqMan PCR 方法灵敏性分析Fig.4 Sensitivity analysis of TaqMan PCR method
2.5 pMD18-T-pirB 质粒RT-PCR 重复性分析
对样品进行组间重复性试验,组内重复性分析分别选取108、107、106、105/μL 浓度的pMD18-T-pirB质粒,按照程序进行PCR 试验,结果见图5。根据4 次组内重复计算其平均值和标准差,变异系数CV介于0.45 %~0.69 %之间(表1),组内重复性良好,稳定性强。
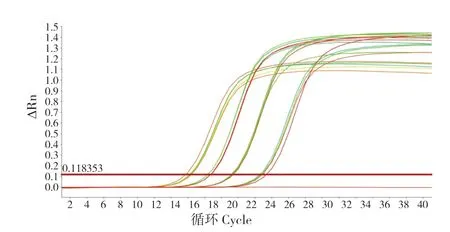
图5 荧光定量PCR 组间重复试验分析Fig.5 Intra repeatability test analysis of real-time PCR

表1 荧光定量PCR 组间重复试验分析Table 1 Intra repeatability test analysis of real-time PCR
2.6 荧光定量PCR 方法的应用
应用建立的RT-PCR 方法对采集的45 份凡纳滨对虾、57 份斑节对虾和42 份中国对虾样品进行VpAHPND检测,分别检出阳性样品19、7、6 份,阳性率分别为24.4%、12.3%、14.2%。检测结果与OIE 推荐的套式PCR 法检测结果一致,说明该方法检测实际样本具有较高可靠性。
3 讨论
通过基因组测序发现,一些非副溶血性弧菌属的AHPND 致病原被确定携带PVA1 质粒,如哈维氏弧菌(Vibrio harveyi)、欧文斯氏弧菌(Vibrio owensii)和坎贝氏弧菌(Vibrio campbellii)[14-15],说明这些毒力基因能够被传播到不同的弧菌种类中,并且质粒基因的结构表明pirA和pirB基因的缺失或获得可通过水平基因转移的转位或同源重组而发生流动,因此AHPND 可能不仅可由副溶血弧菌引起,也能由携带 PVA1 质粒的其他弧菌属引起[16],因此根据PVA1 质粒设计特异性引物和探针减少了检测结果出现假阴性的概率。
试验取病虾肝胰腺组织在3%APW 培养肉汤中增菌后,提取DNA 后扩增不出阳性条带,而直接取病虾肝胰腺组织提取DNA 后,能够扩增出阳性条带。副溶血弧菌广泛存在于环境中,推测可能是样品中的其他副溶血弧菌在增菌过程中逐渐取代了VpAHPND菌株成为优势菌株,致使毒素基因很难再被检测到[17]。本试验在对病虾临床样品的VpAHPND检测时选择直接对肝胰腺组织提取DNA 作为模板。对本试验扩增的所有阳性片段经过测序,所得序列有98.7%同源性,因此这些菌株可能都起源于一个单一克隆。应用建立的RTPCR 方法对采集的45 份凡纳滨对虾、57 份斑节对虾和42 份中国对虾样品进行VpAHPND检测,检出阳性样品32 份,检测结果与OIE 推荐的套式PCR 法检测结果一致。
开展AHPND 诊断,最精确的采样部位是肠道等器官[18],但发病前鳃可能有更灵敏的病原菌检出,发病高死亡率期间,肝胰腺是最灵敏的可检测组织,而在发病后期,除了肝胰腺和肠道外,也可选择肌肉组织作为样本[19]。本试验针对虾鳃、肝胰腺、肠胃等不同部位取样进行检测,鉴别在水体传播AHPND 过程中不同部位的感染过程。
AHPND 的常规PCR 检测方法是以pirA毒力基因为靶基因来检测VpAHPND,通过检测pirA毒力基因拷贝数实现对VpAHPND的定量检测[20],从而分析病原菌的侵染途径,但pirA毒力基因的分子检测结果阳性强度低,本试验以pirB毒力基因为靶基因建立实时荧光PCR 方法,结果表明该方法能有效检测VpAHPND。
4 结论
本试验针对对虾急性肝胰腺坏死病病原菌副溶血性弧菌建立了PCR 扩增方法,根据其质粒保守序列设计了特异性引物及探针,优化了PCR 反应的退火温度、引物及探针浓度等参数,能够有效检测目标基因。当pirB基因标准质粒浓度范围为 2.3×101~2.3×107拷贝/μL 时,标准曲线具有良好的线性关系。该方法灵敏度高,最低检测限为2.3 拷贝/μL;特异性强,与对虾其他病原菌无交叉反应;重复性好,重复试验变异系数为0.45%~0.69%。可在1 h 内完成对虾样品的实时荧光定量检测,临床检测结果与世界动物卫生组织推荐的套式PCR 法检测结果一致,可用于临床对虾样品的VpAHPND检测。及早检测和诊断水产动物是否感染急性肝胰腺坏死病并采取相应措施防止该病菌扩散,有利于水产养殖疾病的提前预警,是水产养殖减少损失的有效途径。
