Wiskott-Aldrich综合征蛋白家族成员3对非小细胞肺癌侵袭转移的影响及机制研究
2021-12-14白峻峰公孙鑫支亚男王壮壮
崔 凯,白峻峰,公孙鑫,支亚男,王壮壮,姜 琨,贾 明
(1.西安国际医学中心医院胸腔外科,陕西 西安 710100;2.陕西省中医药研究院, 陕西 西安 710003)
肺癌是全世界病死率最高的癌症,侵袭转移是导致其临床治疗失败和预后差的主要原因[1-5]。因此,研究肺癌侵袭转移分子机制具有十分重要的临床意义。Wiskott-Aldrich综合征蛋白家族成员3(Wiskott-Aldrich syndrome protein family member 3,WASF3-AS1)是近年来发现的肿瘤抑制因子,已被证实在各种类型的人类癌症中具有预后评估价值,然而其在非小细胞肺癌(Non-small cell lung cancer,NSCLC)中的表达以及对肿瘤发生、发展的影响与机制目前尚不明确[6-9]。因此,本研究观察WASF3-AS1在NSCLC中的表达及对其侵袭转移的影响并分析其机制。
1 材料与方法
1.1 主要材料 26例临床不同病理分期NSCLC患者的癌组织及癌旁组织。NSCLC细胞系NCI-H1975细胞和正常肺支气管上皮细胞系HBE细胞购自中科院上海细胞库。
1.2 主要试剂 WASF3-AS1抗体(ab13365)、赖氨酸特异性组蛋白去甲基化酶1(LSD1)抗体(ab25667)、组蛋白去乙酰化酶6(HDAC6)抗体(ab86657)、蛋白酪氨酸磷酸酶(PTEN)抗体(ab12655)、蛋白激酶B (AKT)抗体(ab2546)、磷酸化AKT(p-AKT)抗体(ab2587)、E-钙黏蛋白(E-ca)抗体(ab43235)、N-钙黏蛋白(N-ca)抗体(ab47643)和磷酸甘油醛脱氢酶(GAPDH)抗体(ab10897)均购自Abcam。
1.3 实验方法
1.3.1 细胞培养及转染:取对数生长期的细胞以每孔6×105个细胞接种于6孔板继续培养过夜后转染WASF3-AS1慢病毒载体:取5 μl WASF3-AS1-pc-DNA3.1(+)和Lipofectamine 2000与50 μl Opti-MEM混匀室温静置5 min,将小干扰RNA(siRNA)混合液缓慢加入Lipofectamine 2000混合液中室温避光静置20 min。分别取上述混合液200 μl加入6孔板,37 ℃、5% CO2条件下转染8 h,更换完全DMEM培养基继续培养24 h或48 h,进行后续相关检测,同时设立阴性对照组。
1.3.2 实时荧光定量PCR(qRT-PCR)检测mRNA表达:采用组织研磨机将临床NSCLC患者癌组织及癌旁组织样本匀浆后加入TRIzol提取总RNA,反转录获得总cDNA。反应严格按照Takara公司试剂盒进行操作。基因相对表达量以2-ΔΔCT计算。检测临床组织及细胞中WASF3-AS1、LSD1、HDAC6、PTEN、AKT、E-ca和N-ca mRNA表达水平。PCR引物序列如下:WASF3-AS1正向为5’-TGATAACTGAGCCA-
AAGTGGTGATG-3’,反向为5’-TGGCGTATGATAGCGGCAAG-3’;LSD1正向为5’-TACCGTCAAG-
CTCTTGGCA-3’,反向为5’-AGCCAAGAGCTTGACGGTA-3’;HDAC6正向为5’-TCCATTTTACTTTCCTACCAT-3’,反向为5’-ATGGTAGGAAAGTAAAATGGA-3’;PTEN正向为5’-ACGACACAGGAGAGTTTGAC-3’,反向为5’-GTCAAACTCTCCTGTGTCGT-3’;AKT正向为5’-TCGGTCTGACCTCCCCGACC-3’,反向为5’-GGTCGGGGAGGTCAGACCGA-3’;E-ca正向为5’-TACCGTCAAGCTCTTGGCA-3’,反向为5’-TGCCAAGAGCTTGACGGTA-3’;N-ca正向为5’-TCCATTTTACTTTCCTACC-3’,反向为5’-GGTAGGAAAGTAAAATGGA-3’;GAPDH正向为5’-GCACCGTCAAGGCTGAGAAC-3’,反向为5’-TGGTGAAGACGCCAGTGGA-3’。
1.3.3 CCK8细胞增殖实验:取对数生长期转染WASF3-AS1-pc-DNA3.1(+)的NCI-H1975细胞,消化重悬细胞后于96孔板内每孔接种1×104个细胞,于37 ℃、5% CO2孵箱中培养。分别于细胞接种后1、2、3、4、5 d同一时间点每孔加入10 μl CCK8溶液于37 ℃、5% CO2孵箱中继续孵育1~4 h。采用酶联免疫检测仪与450 nm处读取光密度(OD)值并绘制细胞生长曲线。
1.3.4 划痕细胞迁移实验:取对数生长期转染WASF3-AS1-pc-DNA3.1(+)的NCI-H1975细胞,消化重悬细胞后于6孔板内每孔接种5×105个细胞,置于37 ℃、5% CO2孵箱中培养。次日,待细胞铺满培养孔底部约90%时开始划痕并标记,弃上清并用PBS缓冲液清洗3次,更换基础高糖DMEM培养基于37 ℃、5% CO2孵箱中培养。划痕后0、12 、24 h时分别拍照记录细胞划痕愈合情况。
1.3.5 Transwell侵袭实验:4 ℃冰箱过夜融化细胞基质胶(Matrigel)后用预冷的无血清DMEM培养基以1∶9稀释,每孔加上述稀释液40 μl,于37 ℃、5% CO2孵箱中孵育5 h。弃残余液体,每孔加60 μl基础DMEM培养基水化基底膜,30 min后弃培养液。取对数生长期转染WASF3-AS1-pc-DNA3.1(+)的NCI-H1975细胞,消化重悬细胞后于6孔板内每孔接种5×104个细胞于24孔培养板内Transwell小室上室,下室加600 μl含完全DMEM培养基,于37 ℃、5% CO2孵箱中培养。待细胞侵袭20 h后取出培养板,弃上清,PBS清洗后分别加600 μl 4%多聚甲醛溶液和0.1%结晶紫染液室温固定和染色15 min,PBS清洗后用棉签轻轻擦去Transwell小室上室未迁移和侵袭细胞。倒置相差显微镜下随机选择5个视野观察被染成紫色的穿过膜的细胞并拍照记录细胞迁移和侵袭情况,采集图像后采用Image J软件计数,采用Graph Pad计算分析。33%冰乙酸溶液脱色后采用酶联免疫检测仪于570 nm处读取OD值,计算细胞相对迁移和侵袭率。
1.3.6 Western blot检测蛋白表达:取对数生长期转染WASF3-AS1-pc-DNA3.1(+)的NCI-H1975细胞,消化离心后采用100 μl PIPA裂解液和0.15 μl PMSF裂解液室温裂解细胞5 min,4 ℃ 12000 r/min离心10 min,吸取上清。BCA法测定蛋白浓度,计算30 μg蛋白上样体积,并进行SDS-PAGE蛋白凝胶电泳,ECL发光仪检测并记录蛋白表达量。
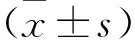
2 结 果
2.1 不同组织、细胞中mRNA表达比较 见图1。qRT-PCR检测结果显示,NSCLC患者癌组织和NCI-H1975细胞中WASF3-AS1、LSD1、HDAC6、PTEN和E-ca mRNA表达分别较癌旁组织和HBE细胞明显降低,而AKT和N-ca mRNA表达分别较癌旁组织和HBE细胞明显增加(均P<0.05)。
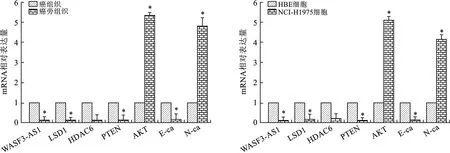
注:图A中,与癌旁组织比较,*P<0.01;图B中,与HBE细胞比较,*P<0.01
2.2 WASF3-AS1-pc-DNA3.1(+)转染效率验证 qRT-PCR检测结果显示,肺癌NCI-H1975细胞转染WASF3-AS1-pc-DNA3.1(+)表达上调4.73倍(P<0.05)。
2.3 两组细胞增殖能力比较 见图2。CCK8细胞增殖实验结果显示,与对照组比较,WASF3-AS1过表达的NCI-H1975细胞增殖能力明显增强(P<0.05)。
2.4 两组细胞迁移能力比较 见图3。划痕实验结果显示,与对照组比较,WASF3-AS1过表达的NCI-H1975细胞划痕愈合能力明显增强(P<0.05),提示WASF3-AS1可抑制NCI-H1975细胞的迁移。
2.5 两组细胞侵袭能力比较 见图4。侵袭实验结果显示,与对照组比较,WASF3-AS1过表达的NCI-H1975细胞侵袭能力明显增强(P<0.05),提示WASF3-AS1可抑制NCI-H1975细胞侵袭。

注:与对照组比较,*P<0.05,#P<0.01
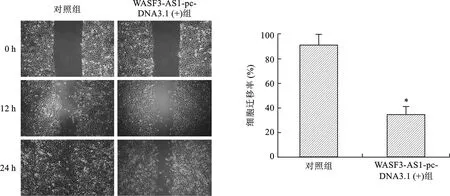
注:左图为不同时间点细胞划痕愈合情况;右图中,与对照组比较,*P<0.01

注:左图为两组细胞侵袭实验结果(结晶紫染色,×400);右图中,与对照组比较,*P<0.01
2.6 两组细胞LSD1、HDAC6、PTEN、p-AKT和上皮间充质转换(EMT)标志分子蛋白表达水平比较 见图5。Western blot结果显示,与对照组比较,WASF3-AS1过表达可显著上调LSD1、HDAC6和PTEN,并抑制p-AKT及肺癌EMT激活(均P<0.05),提示WASF3-AS1通过募集LSD1和HDAC6可抑制PTEN/AKT信号活化介导的上皮间充质转化和转移。

注:左图为各蛋白电泳图;右图中,与对照组比较,*P<0.01
3 讨 论
肺癌是全球范围内发病率和病死率较高的恶性肿瘤,多数肺癌患者即使经过手术及放、化疗等联合治疗,其术后总体5年生存率仍较低,且近年来肿瘤的发病率和病死率逐渐增加,也越来越趋于年轻化发展[10-11]。NSCLC是临床肺癌患者临床常见类型[12]。近年来,随着基于细胞和分子特征的精准基因靶向治疗医学的快速发展,NSCLC的治疗手段及患者预后得到一定改善。然而较高的侵袭转移率及术后复发率是导致肺癌患者临床治疗失败和高病死率的主要原因[13-14]。因此,阐明诱发NSCLC侵袭转移的靶分子及其作用机制具有重要意义。
WASF3是近年来发现的肿瘤抑制因子,能够抑制乳腺癌、宫颈癌、肝癌、前列腺癌以及膀胱癌多种实体肿瘤的恶性演变[15]。肿瘤侵袭转移是由多因素参与调控的复杂过程,在恶性胶质瘤细胞中,WASF表达缺失能够诱导内源性神经干细胞的增殖和转移,与患者临床病理分期及不良预后呈负相关[16-17]。此外,研究[18]表明WASF3在乳腺癌和前列腺癌细胞中表达降低甚至缺失,上调WASF3的表达能够明显抑制上述肿瘤细胞的转移能力。上述研究结果表明WASF3作为抑癌基因抑制肿瘤的发生、发展。本研究qRT-PCR结果显示,NSCLC患者癌组织和NCI-H1975细胞中WASF3-AS1、LSD1、HDAC6和E-ca表达较癌旁组织和HBE细胞明显增加,而AKT和N-ca表达较癌旁组织和HBE细胞明显降低,表明WASF3-AS1募集的LSD1和HDAC6表达能够抑制NSCLC的EMT。此外,为进一步验证WASF3-AS1对NSCLC细胞侵袭和转移能力的影响,本研究中通过慢病毒转染法构建了WASF3-AS1过表达NCI-H1975细胞系,CCK8细胞增殖实验、划痕迁移实验以及Transwell侵袭实验均证实WASF3-AS1过表达能明显抑制NCI-H1975细胞的增殖、迁移和侵袭能力。
PTEN/AKT信号通路活化可促进肿瘤细胞的生长和转移[19-20]。PTEN是该通路主要因子之一,通过抑制磷脂酰肌醇3-激酶(PI3K)的功能并对抗AKT的活化,进而抑制多种恶性肿瘤如脑胶质瘤、胃癌及黑色素瘤等的发生与发展。此外,PI3K的核心功能在于介导组织细胞凋亡,肿瘤细胞内活化的PI3K可激活细胞信号转导并与PI3K蛋白相互作用转位至细胞核或细胞浆,进而调控细胞活性并抑制细胞凋亡。本研究结果显示,NSCLC患者癌组织和NCI-H1975细胞中PTEN的表达降低甚至缺失,进而促进其介导的PI3K/AKT致癌信号通路活化,最终促进肿瘤转移。进一步研究结果证实,WASF3-AS1过表达能够明显上调NCI-H1975细胞中PTEN及上皮细胞标志蛋白E-ca的表达,降低活化的p-AKT和间质细胞标志蛋白N-ca的表达,进而抑制肿瘤转移和EMT。
综上所述,WASF3-AS1对于抑制NSCLC侵袭转移以及患者术后复发具有重要作用,可能通过LSD1和HDAC6到靶基因PTEN启动子区,上调PTEN表达,进而介导下游PI3K/AKT致癌信号通路失活,发挥抗NSCLC细胞转移作用。
