基于类芬顿反应的锌掺杂碳量子点荧光探针测定过氧化氢和胆固醇
2021-12-14孙雪花郝都婷
孙雪花,强 瑜,郝都婷,田 锐
(延安大学化学与化工学院 延安市绿色合成材料与化学安全检测重点实验室,陕西 延安 716000)
1 引 言
碳量子点(Carbon quantum dots,CQDs)是一种新型零维碳纳米材料,表面含有丰富的含氧官能团,作为电子受体和电子给予体,在光电子学[1-2]、催化发光[3]以及传感器[4-6]领域具有广泛应用。近年来,为了改变CQDs表面结构单一、内部电子传递性能较差的问题,多采用表面功能化和杂原子掺杂的策略。但使用聚合物或有机小分子的表面功能化不能在特定分析中占据功能化位置[7],而杂原子掺杂易于操作是改善CQDs的发光特性和电子结构的更有利的方法。随之金属掺杂CQDs渐有出现,且能很好地提高CQDs的荧光量子产率。如Xu等[8]以锰掺杂首次成功合成了具有可逆切换蓝色荧光的高光稳定性Mn-CQDs,荧光量子产率高达54.4%。Yue等[9]采用水热法制备的钌掺杂的CQDs具有20.79%的较高发光效率和高效的活性氧(Reactive oxygen species,ROS)生成。这是由于金属不同的外层电子轨道能很好地调节CQDs的能带结构,作为CQDs的电子给体,促进电子转移,从而提高了CQDs的荧光量子产率。同时,研究还发现金属掺杂的CQDs除了实现荧光量子产率提高和荧光调制,还具有一些新的物理化学性质,如催化性能和弛豫性能。因此,合成并探究新型金属掺杂CQDs的性能还是很有必要的。
过氧化氢(Hydrogen peroxide,H2O2)是一种典型的ROS,作为细胞周期内的胞内信使,起着至关重要的作用[10]。细胞内H2O2的过量产生与多种疾病有关,如心血管疾病、阿尔兹海默病、神经退行性疾病和各种癌症。此外,人体中多种代谢物,如胆固醇、黄嘌呤、葡萄糖、乳糖、胆碱、L-赖氨酸、丙酮酸等,通过酶催化反应会生成H2O2,而胆固醇(Cholesterol)的过量摄入可能导致心肌缺血、冠状动脉粥样硬化等疾病,因此,开发一种有效的工具来检测H2O2并间接检测胆固醇是十分有必要的。目前,H2O2和胆固醇的检测方法有电解分析、高效液相色谱法和分光光度法等[11]。荧光分析法[12-13]由于响应快、简单、灵敏被认为是最有效的检测手段,已有基于模拟酶活性[14]检测H2O2和胆固醇含量的荧光分析法。但传统的有机染料和半导体量子点等多种荧光染料在荧光分析中存在细胞相溶性差、水溶性低的缺点,因此具有易于合成、水溶性高、细胞毒性低、发光性能优越等特点的CQDs备受关注。
本文以醋酸锌作为金属源,盐酸乙二胺为络合剂,柠檬酸为碳源,通过一步水热法合成了发射峰位于428 nm的Zn-CQDs,荧光量子产率达到34%。基于Cu2+与H2O2构成类芬顿体系产生羟基自由基进一步猝灭Zn-CQDs的荧光强度,构建了检测H2O2含量的Zn-CQDs-Cu2+传感器。此外,胆固醇在胆固醇氧化酶作用下可产生H2O2,因而可间接检测胆固醇。这为参与H2O2生成反应的代谢物(胆固醇,黄嘌呤,葡萄糖等)的检测也提供了有效的方法。
2 实 验
2.1 主要仪器和试剂
UV-2550型紫外-可见吸收光谱仪(日本岛津);FLSP920型稳态瞬态荧光光谱仪(英国爱丁堡);LS-55型荧光分光光度计(美国珀金埃尔默);IR Prestige-21傅里叶变换红外光谱仪(日本岛津);ESCALAB 250XI 型 X 射线光电子能谱仪(美国赛默飞世尔科技);XRD-7000 X粉末衍射仪(日本岛津);Tecnai G2 F20 S-Twin 型高分辨透射电子显微镜(美国 FEI)。
胆固醇标准溶液:1.0×10-3moL/L,取0.019 g胆固醇标准品(上海麦克林生化科技有限公司)用无水乙醇溶解定容至50 mL容量瓶。用时逐级稀释。胆固醇氧化酶:0.5 mg/mL。HEPES(北京索莱宝科技有限公司)缓冲溶液:pH=7.60。过氧化氢、盐酸乙二胺、胆固醇氧化酶(上海麦克林生化科技有限公司)。试剂级别均为分析纯,实验用水为超纯水。
2.2 Zn-CQDs合成
准确称取0.66 g醋酸锌、0.63 g柠檬酸和0.40 g盐酸乙二胺置于烧杯中,加入30 mL水使其超声溶解,将其转移至50 mL的反应釜中,在180 ℃下反应6 h,冷却至室温后,将溶液以12 000 r/min的转速离心10 min,除去沉淀,用滤膜(0.22 μm)过滤,在4 ℃下冷藏保存备用。将滤液稀释100倍得Zn-CQDs工作液。表征中将所得到的滤液进行真空冷冻干燥得到Zn-CQDs固体样品进行测试。
2.3 过氧化氢荧光探针建立
于10 mL比色管中,加入HEPES缓冲溶液1.00 mL、稀释100倍的Zn-CQDs溶液160 μL、0.1 mol/L Cu2+标准溶液2.50 mL、适量的H2O2溶液。在50 ℃下孵育40 min后,于λex=340 nm和λem=428 nm 处测定体系的荧光强度F以及试剂空白溶液的荧光强度F0,狭缝宽度均为5 nm。
2.4 胆固醇荧光探针建立
在2.3同样体系Zn-CQDs-Cu2+中加入100 μL胆固醇氧化酶、适量胆固醇标准溶液,于50 ℃下孵育40 min后,在λex=340 nm和λem=428 nm 下测定体系的荧光强度F以及试剂空白溶液的荧光强度F0,狭缝宽度均为5 nm。
3 结果与讨论
3.1 Zn-CQDs结构表征
3.1.1 透射电镜
通过高分辨率透射电镜分析合成的Zn-CQDs的尺寸和形貌。由图1(a)可看出Zn-CQDs呈现球形,粒径均一,尺寸规则,单分散性能较好。插图中清晰的晶格条纹间距为0.32 nm。从图1(b)看出Zn-CQDs尺寸主要分布在1.0~3.0 nm范围内,平均尺寸为2 nm左右,颗粒度较小。
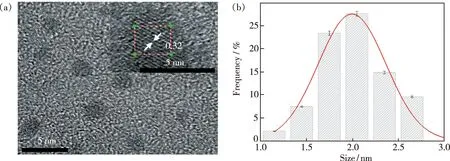
图1 Zn-CQDs的透射电镜图(插图为高分辨透射电镜图)(a)及粒径分布图(b)Fig.1 TEM image of Zn-CQDs(inset is high-resolution TEM image)(a)and the particle size distribution images of Zn-CQDs(b)
3.1.2 X 射线粉末衍射
粉末衍射能很好地确定物质的晶体结构以及结晶度,如图2所示。Zn-CQDs的X射线粉末衍射图分别在2θ=27.54°、2θ=51.15° 两处有明显的衍射峰,归为碳的特征衍射峰,表明所制备的Zn-CQDs具有良好的结晶度。
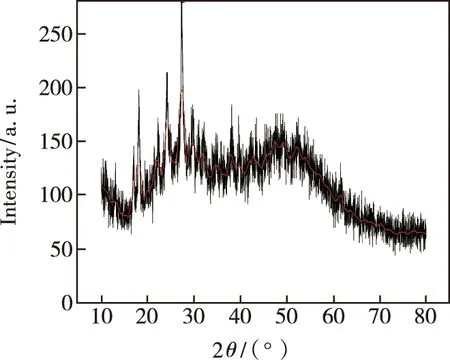
图2 Zn-CQDs的X射线粉末衍射图Fig.2 XRD spectrum of Zn-CQDs
3.1.3 红外光谱
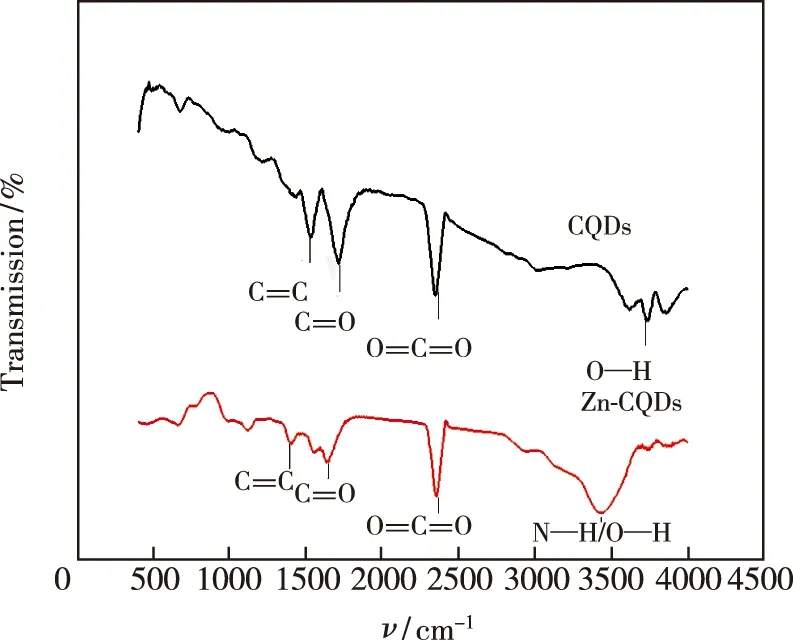
图 3 Zn-CQDs及CQDs的红外光谱Fig.3 FT-IR spectra of Zn-CQDs and CQDs
3.1.4 X射线电子能谱
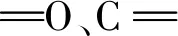
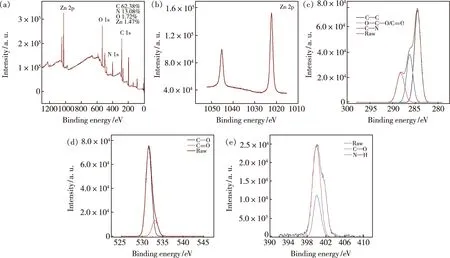
图4 Zn-CQDs 的XPS全谱(a)、Zn 2p 谱(b)、C 1s谱(c)、O 1s 谱(d)及N 1s(e)。Fig.4 (a)XPS spectrum of Zn-CQDs full spectrum.(b)Zn 2p spectrum.(c)C 1s spectra.(d)O 1s spectra.(e)N 1s spectra.
3.1.5 Zn-CQDs的光学性能

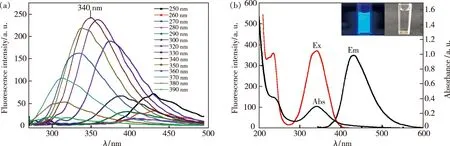
图5 (a)不同激发波长下Zn-CQDs的荧光光谱;(b)Zn-CQDs紫外吸收和荧光光谱(插图:在紫外线和自然光下的照片)。Fig.5 (a)Fluorescence spectra of Zn-CQDs at different excitated wavelength.(b)UV-Vis absorption spectrum and the fluorescence spectra of Zn-CDs(Insets:photographs under UV light and natural light).
3.1.6 荧光量子产率
以硫酸奎宁为参比物[15],在340 nm相同激发波长下,检测待测物(u)与参比物(s)的荧光强度和该波长激发光的吸光度,利用公式(1)计算得到Zn-CQDs的荧光量子产率(Yu)为34%,未掺杂CQDs荧光量子产率为2.6%(表1)。说明金属掺杂大大提高了碳量子点的荧光量子产率。
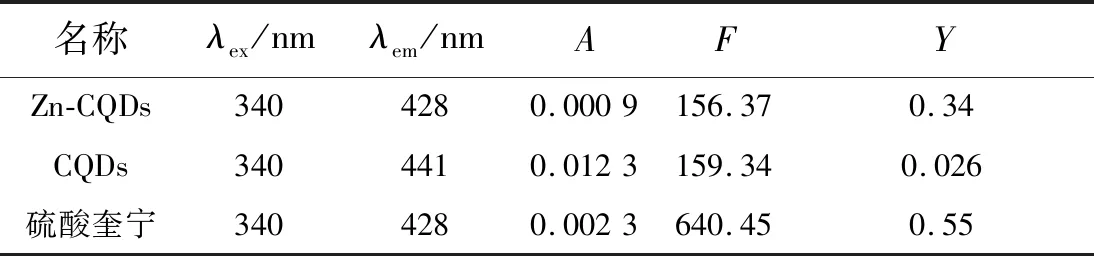
表1 Zn-CQDs荧光量子产率Tab.1 Fluorescence quantum yield of Zn-CQDs
(1)
其中,Y表示物质的荧光量子产率,F表示物质的荧光强度,A表示物质的吸光度。
3.2 H2O2测定体系构建
基于Cu2+与H2O2的类芬顿反应产生的高活性·OH有效猝灭Zn-CQDs荧光而建立了测定H2O2和生成H2O2的代谢物(如胆固醇,黄嘌呤,葡萄糖等)的体系。如图6(a)所示,发现相同浓度的Zn-CQDs与未掺杂CQDs都在最大激发波长340 nm激发下于428 nm处有强发射,但Zn-CQDs的激发与发射强度更强。H2O2本身对Zn-CQDs与CQDs荧光几乎没有作用,Cu2+对Zn-CQDs荧光有一定的猝灭作用[16],对未掺杂CQDs也具有猝灭效果。但当加入H2O2后,Zn-CQDs-Cu2+-H2O2体系的猝灭效果明显大于CQDs-Cu2+-H2O2体系。由图6(b)发现,Cu2+加入前后Zn-CQDs紫外吸收光谱并无变化,说明Cu2+与Zn-CQDs表面的—OH、—COOH、—NH等基团发生电荷转移仅改变了Zn-CQDs激发态的能量,产生动态猝灭作用。但当同时加入Cu2+与H2O2后,Zn-CQDs的荧光显著降低(图6(a)),推断是Cu2+与H2O2发生芬顿反应产生高活性的·OH所致。由于亚甲基蓝(MB)分子中有一个中间价态的硫原子对·OH有高度亲和性[17],因此发现当加入1.00 mL 1.0×10-4mol/L亚甲基蓝于体系中时,原MB在664 nm的最大吸收有明显降低(图6(b)曲线6),体系的荧光强度恢复10%(图6(a)中曲线6),极可能是Cu2+和H2O2产生的·OH被亚甲基蓝捕获,导致体系荧光有一定恢复,然而亚甲基蓝对Zn-CQDs本身有抑制作用导致恢复能力较弱。由此推理得出该反应机理如图7。
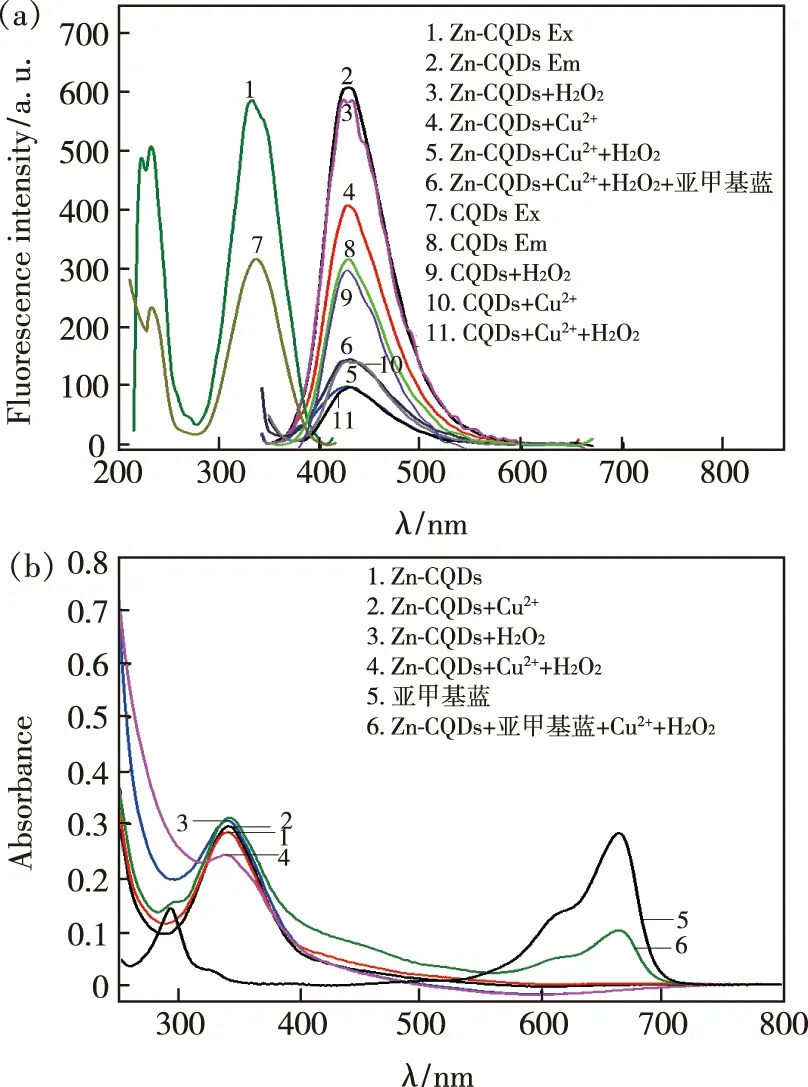
图6 不同Zn-CQDs体系的荧光光谱(a)与紫外-可见吸收光谱(b)Fig.6 Fluorescence(a)and UV-visible absorption(b)for different Zn-CQDs systems
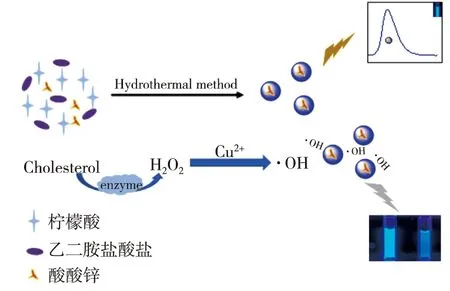
图7 体系反应机理图Fig.7 System reaction mechanism diagram
采用FLSP920稳态瞬态荧光光谱仪测定 Zn-CQDs、Zn-CQDs+Cu2+体系和 Zn-CQDs+Cu2++H2O2体系的荧光衰减曲线(图8)和加权平均荧光寿命(表2)。其平均荧光寿命分别为8.20,15.13,6.80 ns。Zn-CQDs和Zn-CQDs+Cu2+荧光寿命比值τ1/τ2=0.54;Zn-CQDs+Cu2+体系和Zn-CQDs+Cu2++H2O2体系的荧光寿命比值τ2/τ3=2.23,说明Cu2+对 Zn-CQDs 的荧光猝灭以及 Cu2+/H2O2产生的·OH 对Zn-CQDs 的荧光猝灭过程都为动态猝灭。且根据文献[18]可知,Cu2+与H2O2发生类芬顿反应产生的·OH促使 Zn-CQDs 的荧光发生动态猝灭一致。
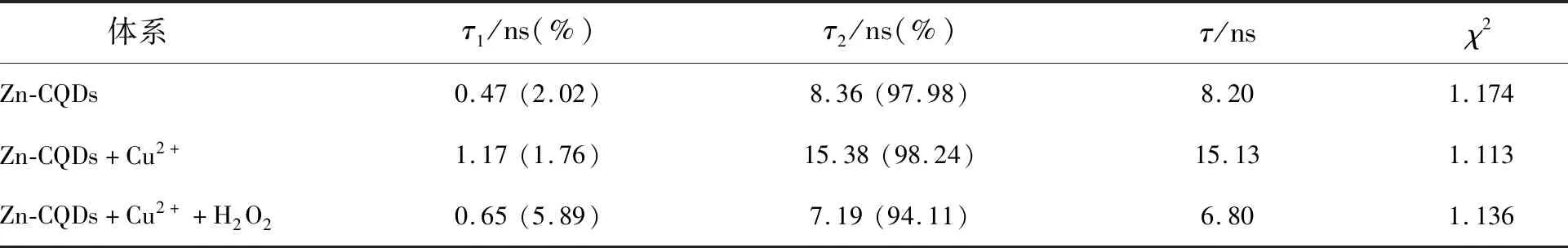
表2 荧光寿命对照表Tab.2 Fluorescence lifetime comparison table
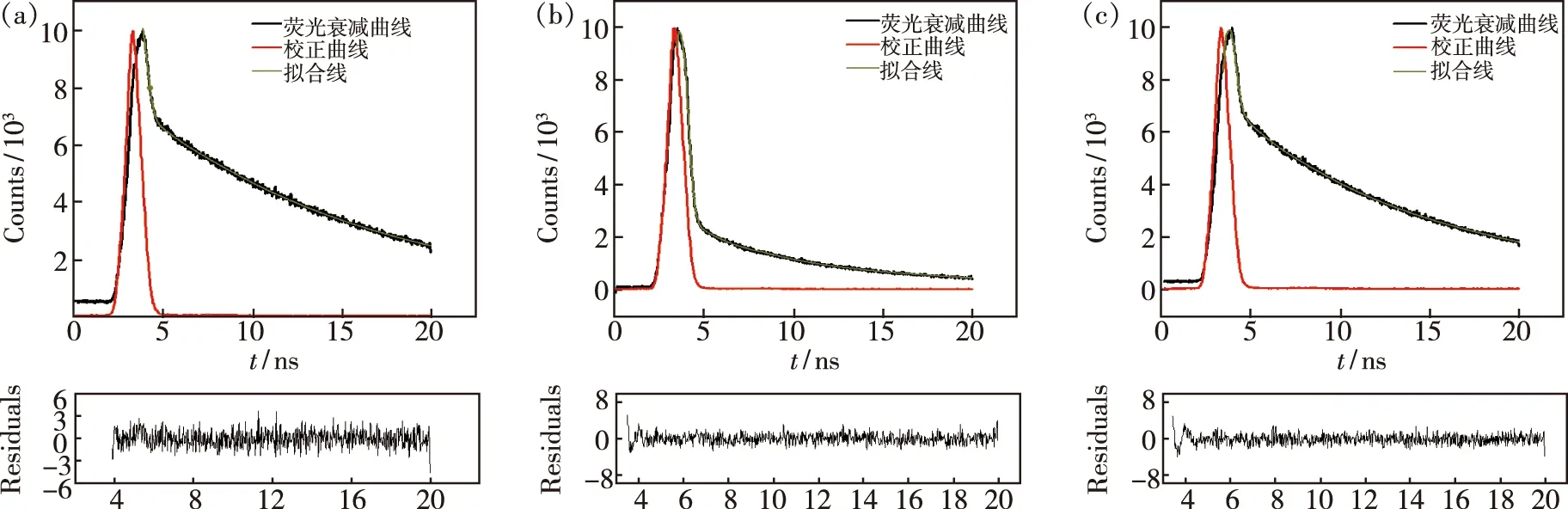
图8 Zn-CQDs(a)、Zn-CQDs+Cu2+(b)、Zn-CQDs+Cu2++H2O2(c)的荧光衰减曲线。Fig.8 Fluorescence decay curves of Zn-CQDs(a),Zn-CQDs+Cu2+(b),Zn-CQDs+Cu2++H2O2(c).
3.3 反应体系条件优化
3.3.1 pH优化
考察了酸碱度及缓冲种类(HEPES,巴比妥钠,Trics-HCl,BR,磷酸氢二钠-柠檬酸,PBS)对体系测定的影响。结果如图9所示,酸度在6.8~8.0之间时,体系的荧光猝灭性能最强。实验选择pH=7.60 HEPES缓冲溶液,由于Cu2+与H2O2作用对Zn-CQDs的猝灭达到最优状态。
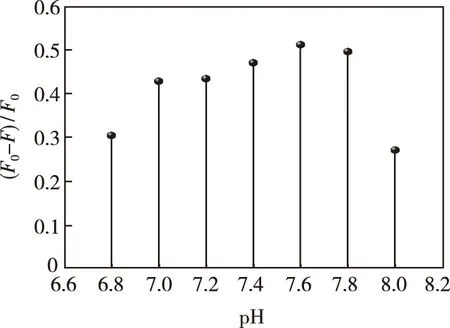
图9 pH值对Zn-CQDs-Cu2+体系荧光强度的影响Fig.9 Effect of the pH on the fluorescence intensity of the Zn-CQDs-Cu2+ system
3.3.2 Cu2+量的优化
体系加入不同体积0.01 mol/L Cu2+溶液,结果如图10所示。发现随着Cu2+用量的增加,体系荧光猝灭强度逐渐增大,在1.00~2.50 mL之间时达到最优。当Cu2+浓度太大时,催化产生羟基自由基的反应受到限制,体系荧光猝灭程度显著下降。体系选择加入0.01 mol/L Cu2+溶液2.50 mL。
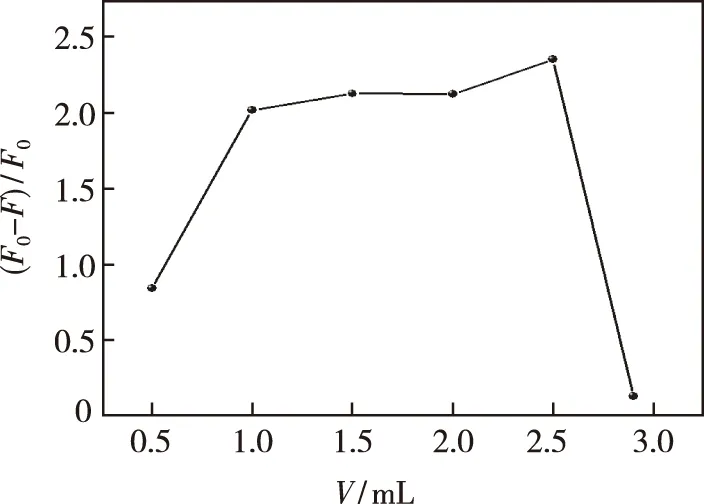
图10 Cu2+的量对Zn-CQDs-Cu2+体系荧光强度的影响Fig.10 Effect of the amount of Cu2+on the fluorescence intensity of the Zn-CQDs-Cu2+ system
3.3.3 Zn-CQDs的量优化
考察了稀释100倍的不同体积的Zn-CQDs对体系荧光强度的影响。从图11发现,随着Zn-CQDs的用量增加,体系荧光猝灭程度显著增强,在0.16 mL时达到最佳。随着Zn-CQDs浓度的持续增加,可能是Zn-CQDs自身出现团聚,导致体系荧光猝灭受到影响。故本实验选取0.16 mL为最佳用量。
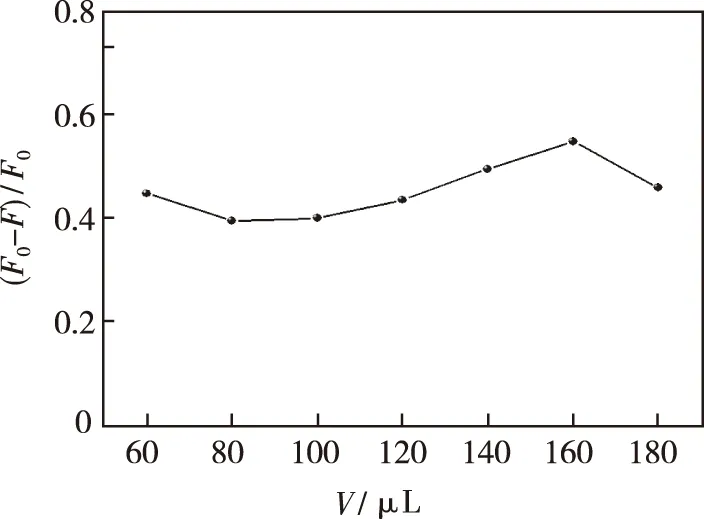
图11 Zn-CQDs的量对Zn-CQDs-Cu2+体系荧光强度的影响Fig.11 Effect of the amount of Zn-CQDs on the fluorescence intensity of the Zn-CQDs-Cu2+ system
3.3.4 反应时间及温度优化
反应时间及反应温度对体系的影响至关重要。本实验分别考察了不同反应时间(0~120 min)及不同反应温度(30~90 ℃)对体系的影响。如图12,可知体系在50 ℃ 孵化40 min后逐步趋于稳定。
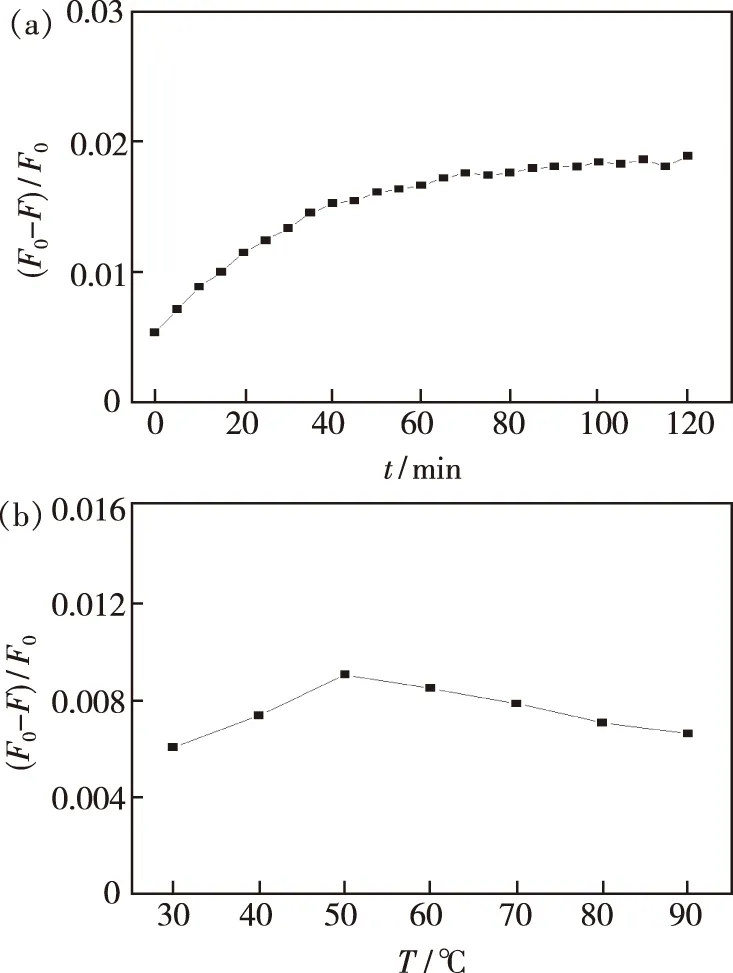
图12 Zn-CQDs-Cu2+体系反应时间(a)与反应温度(b)Fig.12 Response time(a)and temperature(b)of the Zn-CQDs-Cu2+ system
3.3.5 共存物质及干扰
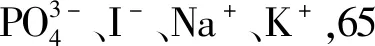
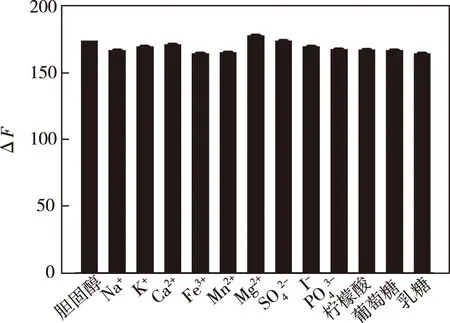
图13 干扰物质对Zn-CQDs-Cu2+体系的影响Fig.13 Influence of interfering substances on the Zn-CQDs-Cu2+ system
3.3.6 标准曲线
按照实验方法,在最佳实验条件下测定H2O2和胆固醇,结果如图14 所示。从图14(a)发现体系(F0-F)/F0与 H2O2浓度在 1.0×10-5~1.0×10-6mol/L 范围内呈良好的线性关系,图14(b)显示线性方程为(F0-F)/F0=1.26×104c+6.16×10-4,r为0.994 7,检出限(3S0/S)达到7.2×10-7mol/L;图14(c)中体系(F0-F)/F0与胆固醇浓度在3.0×10-5~9.0×10-7mol/L范围内呈良好的线性关系,图14(d)显示线性方程为(F0-F)/F0=1.38×104c+0.04,r为0.992 4,检出限为 6.8×10-7mol/L。
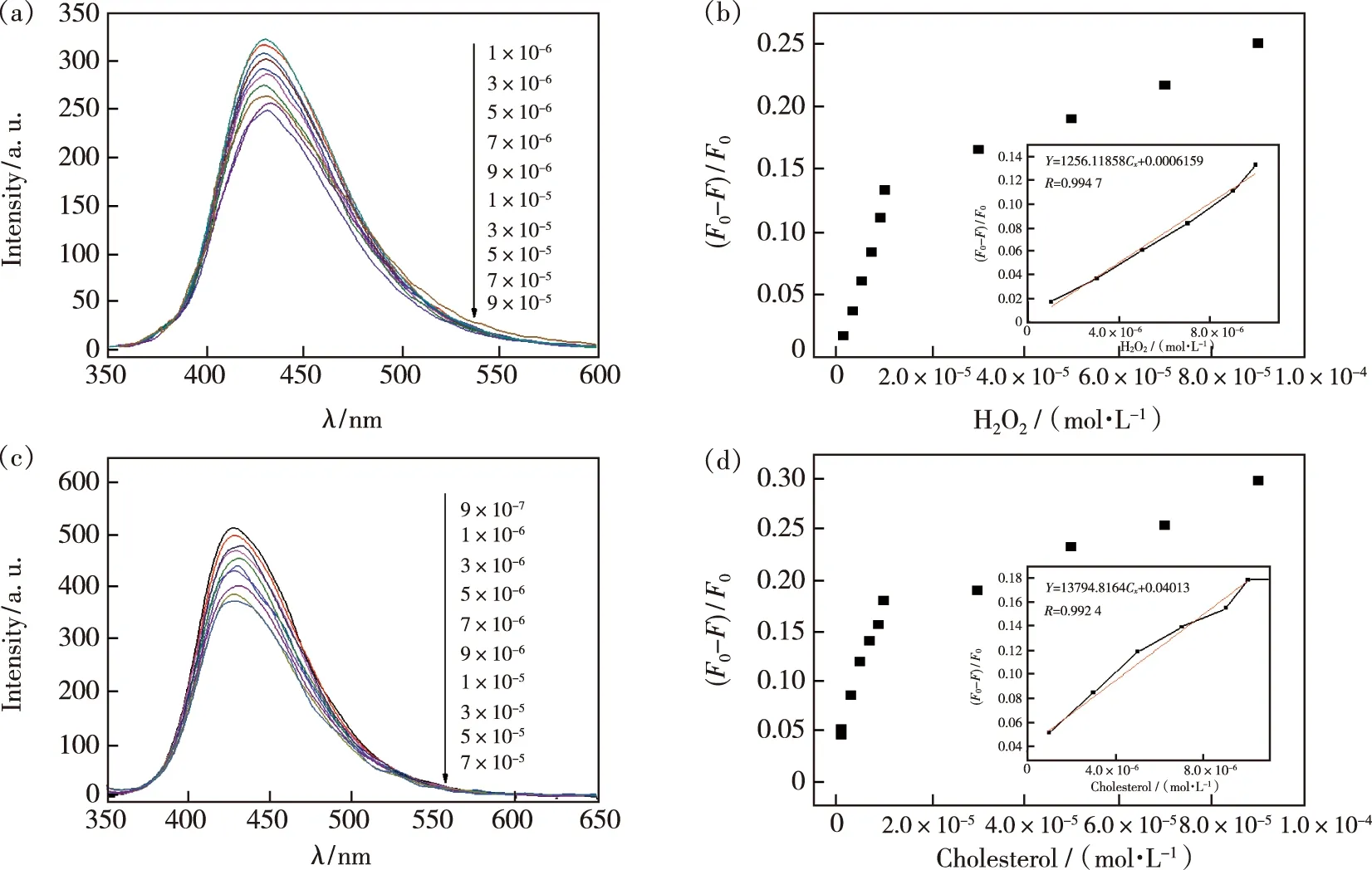
图14 H2O2浓度的荧光光谱(a)和线性关系(b);胆固醇浓度的荧光光谱(c)和线性关系(d)。Fig.14 Fluorescence spectra(a)and linear relationship(b)for H2O2 concentration.Fluorescence spectra(c)and linear relationship(d)for cholesterol concentration.
3.4 样品检测及回收率
为考察过氧化氢体系的实用性,以延河水为模拟水样经过滤处理之后,在最佳实验条件下进行测试并做加标回收实验。结果如表3所示,H2O2的回收率在98.55%~105.4%,表明该体系可用于实际样品的检测。

表3 延河水中过氧化氢的加标回收实验(n=3)Tab.3 Standard addition and recovery experiment of H2O2 in Yan He River samples(n=3)
将超市购买的伊利纯牛奶分别从3袋中取5.00 mL于离心管中,加入25 mL(乙腈∶水=84∶16)提取液,漩涡混匀1.0 min,振荡2~3次并超声提取20 min,取出于10 000 r/min离心机上离心5 min,分别取上清液10 μL在最佳实验条件下进行测试,并进行加标回收实验。结果如表4所示,该方法检测牛奶中胆固醇总含量平均值为15.03 mg/100 g,与刘等[19]采用CuNCs比色法检测牛奶中胆固醇含量平均值13.46 mg/100 g结果相近。该方法对实际样品的检测回收率为98.00%~103.0%,RSD≤3.8%,结果满意。与文献方法比较,如表5,在低浓度范围内灵敏度更高。
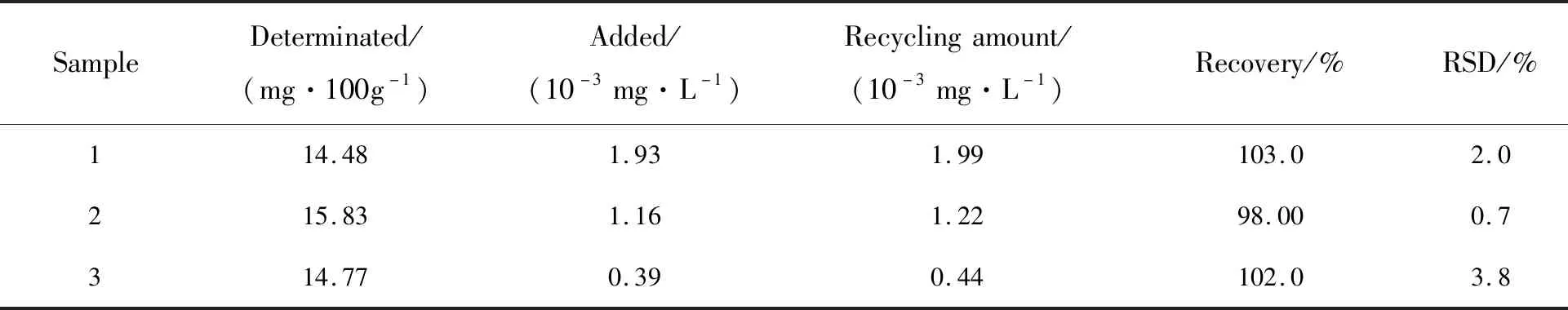
表4 牛奶样品中胆固醇的加标回收实验(n=3)Tab.4 Standard addition and recovery experiment of cholesterol in milk samples(n=3)
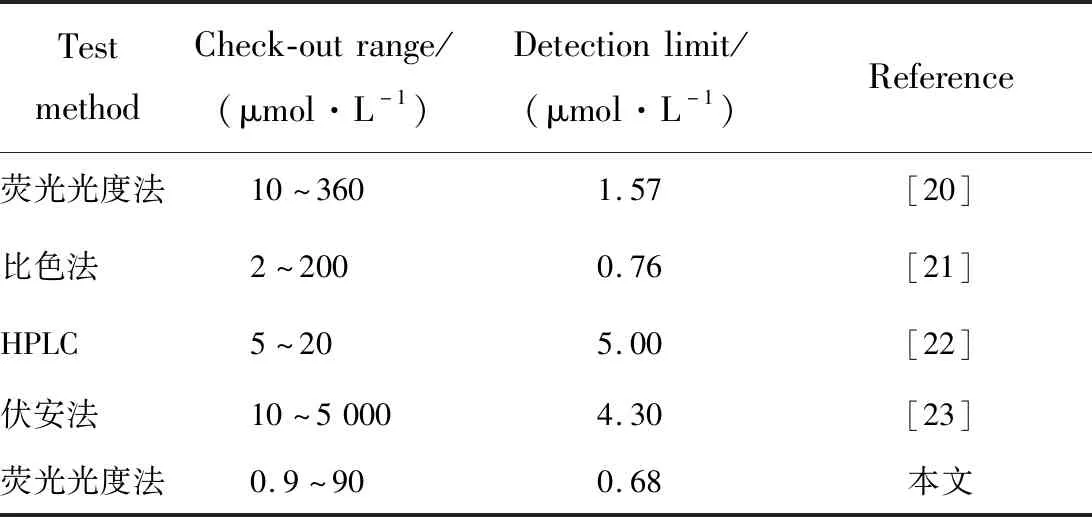
表5 不同牛奶中胆固醇检测方法的比较Tab.5 Comparison of cholesterol detection methods in different milk
4 结 论
本研究引入金属源,通过水热法一步合成了具有良好稳定性和高荧光强度的Zn-CQDs。基于Cu2+与H2O2构成类芬顿体系产生羟基自由基可进一步猝灭Zn-CQDs荧光强度,建立了类Fenton体系的Zn-CQDs荧光探针用于H2O2和有H2O2生成的反应代谢物的测定。该方法用于牛奶中胆固醇的测定,具有较好的实用价值。
