转录因子BvM14-GAI耐盐功能研究
2021-12-13马慧敏孙培琳马春泉
马慧敏,孙培琳,马春泉
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院/黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080)
0 引言
盐胁迫是一种主要的非生物胁迫,其中渗透胁迫和离子损伤被认为是造成植物伤害的2个主要因素[1]。甜菜(Beta vulgaris)是藜科二年生草本植物,原产于欧洲,从瑞典移栽到西班牙后开始大范围栽培,变异很大,被分为若干亚种、变种及变型,是除甘蔗以外主要糖的来源之一[2-3]。它具有耐盐、耐碱、耐旱、耐寒等特点,是一种适应性强、抗逆性强、经济价值高的作物[4]。甜菜M14品系是郭德栋利用二倍体栽培甜菜(B.vulgaris)和四倍体野生白花甜菜(B.corollifiora)杂交并回交后得到的带有白花甜菜第9号染色体的单体附加系,可以在500 mmol/L NaCl中存活,是挖掘优质耐盐基因资源的良好材料[5-6]。实验室前期已经克隆获得了盐胁迫转录组中上调表达基因BvM14-GAI的cDNA全长,并进行了生物信息学分析,亚细胞定位研究表明其定位在细胞核中[7]。
GAI蛋白属于植物特有的转录因子GRAS家族中DELLA亚家族[8]。GRAS家族是近年来发现的一种植物特异性的蛋白家族,DELLA虽然为转录因子GRAS家族,但不具有DNA结合域,通常与其他转录因子互作共同转录调控,在植物生长发育过程中发挥着重要作用[9-10]。DELLA通过与WRKY6相互作用,对黑暗诱导拟南芥叶片衰老和叶绿素降解负调控,从而抑制衰老相关基因的转录活性,参与植物黑暗诱导[11]。Serrano-Mislata等[12]揭示了DELLA通过直接上调潜在分生组织中的细胞周期抑制剂KRP2来限制拟南芥的分生组织大小,说明DELLA蛋白在控制茎的生长方面具有重要作用。Zhou等[13]在拟南芥响应低温胁迫的研究中发现,DELLA蛋白正向调控冷诱导基因CBF3参与到茉莉酸(JA)信号途径,两者共同作用延缓植物生长来提高拟南芥应答低温胁迫能力。
目前,许多植物的GAI基因已被克隆,但其功能研究主要集中在光响应机制领域,在响应非生物胁迫机制的研究报道较少。本研究在前期工作基础上,通过转化拟南芥开展BvM14-GAI基因的耐盐功能研究,对GAI基因响应非生物胁迫的功能进行拓展,以期阐明甜菜M14品系耐盐分子机制和培育耐盐作物品系。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 拟南芥哥伦比亚野生型,TAIR(http://www.arabidopsis.org/)网站购买拟南芥GAI基因突变株(AT1G71200)。
1.1.2 菌株及载体 大肠杆菌(Escherichia coli)DH5α菌株、根癌农杆菌(Agrobacterium tumefaciens)EHA105菌株、植物表达载体35S::pCAMBIA1300。
1.1.3 试剂及引物 主要试剂甜菜碱、超氧化物歧化酶、过氧化物酶测定试剂盒均购自苏州格锐思生物科技有限公司。引物包括35S::pCAMBIA1300-BvM14-GAI植物 表 达 载 体 引 物 (GAI-5-S:5'-ACGAATTCGAGCTCGATGAAGAGGGAACACCCC T-3',GAI-5-AS:5'-CTAGAGGATCCCCGGTCAACG ATGAGTTGGCGAGT-3')、半定量RT-PCR引物(GAI-6-S:5'-ATCCGAAAACGGGTCGTTGA-3',GAI-6-AS:5'-ATCCGAAAACGGGTCGTTGA-3')、拟南芥突变株筛选引物(GAI LP:5'-AAGCGATTCTCGAAGCTTTT C-3',GAI RP:5'-TGCCTATCCAATTTACCCTCC-3',LbA1:5'-TGGTTCACGTAGTGGGCCAT-3'),引物合成与测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 表达载体35S::pCAMBIA1300-BvM14-GAI的构建及转化农杆菌 以实验室前期所得质粒pMD18-TBvM14-GAI为模板,利用引物GAI-5-S、GAI-5-AS进行BvM14-GAI基因的扩增,PCR反应条件为:94℃4 min;94℃ 30 s,57℃ 30 s,72℃ 90 s,30个循环;72℃ 7 min;4℃保存。利用In-Fusion技术将带有BamHⅠ酶切位点的BvM14-GAI基因与酶切后的pCAMBIA1300载体进行重组,转化大肠杆菌DH5α菌株,提取质粒测序。碱裂解法提取重组质粒35S::pCAMBIA1300-BvM14-GAI,经冻融法转化农杆菌EHA105。
1.2.2 拟南芥异源表达植株及异源互补植株的获得 将BvM14-GAI序列在TAIR网站进行同源性比对,选择相似性最高且结构域DELLA和GRAS保守的拟南芥GAI基因突变株(AT1G71200)并购买。将购买的拟南芥突变株种子种植在1/2MS培养基上,待出芽后移入土壤(草炭土:蛭石=1:1)中培养,待拟南芥突变株长出3~5对叶片时提取基因组总DNA作为模板,利用突变株检测引物GAI LP、GAI RP和LBA 1,进行PCR扩增,筛选获得纯合突变植株。反应条件:94℃4 min;94℃ 30 s,54℃ 30 s,72℃ 90 s,35个循环;72℃ 7 min;4℃保存。
利用花序浸染法将BvM14-GAI基因转化拟南芥野生型植株(WT)和GAI基因突变株(KO),成熟后收取种子在含30 mg/L Hyg的1/2MS固体培养基上筛选,获得幼苗转移至土壤(草炭土:蛭石=1:1)培养至成苗。对转化后的拟南芥植株进行基因组PCR和RT-PCR的检测,筛选确定阳性拟南芥植株。提取转化植株基因组DNA为模板,利用基因特异引物GAI-5-S和GAI-5-AS进行PCR扩增,反应条件94℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 90 s,30个循环;72℃ 7 min;4℃保存。
采用RNA提取试剂盒提取转化植株总RNA,反转录合成cDNA第一链,以反转录cDNA第一链为模板,GAI-6-S和GAI-6-AS为引物进行RT-PCR扩增,利用18S rRNA基因作为内参基因,反应条件:94℃4 min;94℃ 30 s,57℃ 30 s,72℃ 90 s,30 个循环 ;72℃ 7 min;4℃保存。直至获得T3代BvM14-GAI拟南芥异源表达和异源互补植株纯合株系。
1.2.3 T3代阳性拟南芥异源表达植株和异源互补植株的表型观察及测定 分别将野生型拟南芥(WT)、GAI基因突变株(KO)、BvM14-GAI基因异源表达植株(OX)和BvM14-GAI基因异源互补植株(CO)4种植株种子种植在1/2MS固体培养基上培养7天,转移至含有150 mmol/L NaCl的1/2MS固体培养基上继续培养14天,进行表型观察,以0 mmol/L NaCl处理为对照,并测定植株根长、鲜重和干重,每次测定进行3次生物学重复。
1.2.4 K+、Na+和甜菜碱含量测定 将1.2.3中0 mmol/L NaCl处理下的4种植株(WT、KO、OX、CO)转移至土壤(草炭土:蛭石=1:1)长日照(16 h光/8 h暗)下正常培养,待植株生长至4~6对叶片时,用150 mmol/L NaCl溶液浇灌胁迫处理,每天处理1次,共3次。取处理前后的拟南芥叶片进行K+、Na+含量测定,每次测定进行3次生物学重复,计算K+/Na+比。
取处理前后的拟南芥叶片烘干后过60目筛的样品约0.02 g,加1 mL 80%甲醇溶液,置于60℃提取30 min,不断震荡,然后12000 r/min,25℃离心15 min,取上清液进行甜菜碱含量测定,每次测定进行3次生物学重复,测定方法参考苏州格锐思生物科技有限公司的甜菜碱(betaine)含量试剂盒说明书。
1.2.5 SOD、POD含量测定 取1.2.4中150 mmol/L NaCl胁迫前后拟南芥植株叶片,测定SOD、POD含量,进行3次生物学重复。测定方法参考苏州格锐思生物科技有限公司的超氧化物歧化酶(SOD)-WST法-分光法-96样说明书、过氧化物酶(POD)-WST法-分光法-96样说明书。
1.3 数据处理
对原始数据进行标准化处理,采用Excel软件对数据进行绘图,用GraphPad Prime 6软件进行方差分析,差异显著性阈值为P<0.05。
2 结果与分析
2.1 构建pCAMBIA1300-BvM14-GAI植物表达载体及转化农杆菌
根据1.2.1方法,随机选取5个重组阳性菌落进行PCR验证,结果如图1所示,均扩增出与目的基因大小一致的条带。提取质粒进行测序,结果显示pCAMBIA1300-BvM14-GAI表达载体构建成功,进一步转化农杆菌EHA105用于浸染拟南芥。

图1 35S::pCAMBIA1300-BvM14-GAI重组质粒特异引物PCR产物1%琼脂糖凝胶电泳图
2.2 T3代BvM14-GAI基因拟南芥异源表达植株及异源互补植株的获得
随机选取12株拟南芥GAI基因突变株提取基因组DNA,并利用TAIR网站提供的突变株检测引物对拟南芥GAI基因突变株进行三引物PCR鉴定,结果图2所示,以野生型为对照,编号1、2、3、4、7、8、10、11的8个株系为拟南芥GAI基因突变株纯合系,选取拟南芥GAI基因突变株纯合系进行后续实验。

图2 拟南芥GAI基因突变株纯合子筛选PCR筛选结果
参照1.2.2中的方法,对于浸染后获得的拟南芥异源表达和异源互补植株,成熟后收取种子在含30 mg/L Hyg的1/2MS固体培养基上筛选(图3),获得幼苗转移至土壤(草炭土:蛭石=1:1)培养至成苗,采用抗生素Hyg抗性筛选联合基因组PCR及RT-PCR检测T3代拟南芥植株。T3代拟南芥植株基因组PCR检测如图4所示,均含有目的条带,说明BvM14-GAI基因已成功转入拟南芥野生型和GAI基因突变株。RT-PCR转录水平检测如图5所示,参比WT和KO植株,OX和CO植株中均能检测到BvM14-GAI基因条带,说明该基因成功转录。获得的T3代BvM14-GAI基因拟南芥异源表达植株(OX)和BvM14-GAI基因异源互补植株(CO)纯合系,用于后续实验。
图3 BvM14-GAI基因异源表达及异源互补阳性拟南芥植株的抗性筛选(Hyg 30 mg/L)结果

图4 BvM14-GAI基因拟南芥异源表达植株及异源互补植株的PCR检测结果

图5 BvM14-GAI基因拟南芥异源表达植株及异源互补植株的RT-PCR检测结果
2.3 BvM14-GAI基因拟南芥异源表达植株及异源互补植株盐胁迫前后的表型观察及测定
按1.2.3的方法对植株进行观察及根长、鲜重、干重的测定,结果如图6~7所示,0 mmol/L NaCl处理时,以WT、KO植株为对照,OX与CO植株根长显著短于对照,表明BvM14-GAI基因对生长起负调控作用,为生长负调控因子。150 mmol/L NaCl处理后,OX与CO植株根长、鲜重、干重与对照组的差异均不显著。

图6 BvM14-GAI基因拟南芥异源表达及异源互补植株盐胁迫前后的表型及根长测定结果

图7 BvM14-GAI基因拟南芥异源表达及异源互补植株盐胁迫前后的鲜重、干重测定结果
2.4 BvM14-GAI基因拟南芥异源表达植株及异源互补植株盐胁迫前后K+、Na+及甜菜碱含量的测定
由图8A和8B可知,以WT和KO植株作为对照,OX与CO植株在150 mmol/L NaCl胁迫后K+/Na+与对照的差异均不显著,维持了K+、Na+稳态。由图8C和8D可知,OX与CO植株150 mmol/L NaCl胁迫前后甜菜碱含量差异不显著,但胁迫后甜菜碱含量比对照组略高。说明BvM14-GAI基因的转入能够维持K+、Na+稳态,增加甜菜碱含量,改善植株的渗透调节能力,从而提高BvM14-GAI基因拟南芥异源表达植株及异源互补植株的耐盐性。


图8 BvM14-GAI基因拟南芥异源表达及异源互补植株盐胁迫前后K+/Na+及甜菜碱含量测定结果
2.5 BvM14-GAI基因拟南芥异源表达植株及异源互补植株盐胁迫前后SOD、POD活性
由图9A和9C可知,150 mmol/L NaCl胁迫后OX植株SOD活性和POD活性均显著高于WT;CO植株SOD活性和POD活性变化与OX植株表现相同趋势(图9B和9D)。说明BvM14-GAI基因的转入增强了活性氧的清除能力,减少了NaCl带来的氧化损伤,从而提高异源表达植株及异源互补植株的耐盐性。
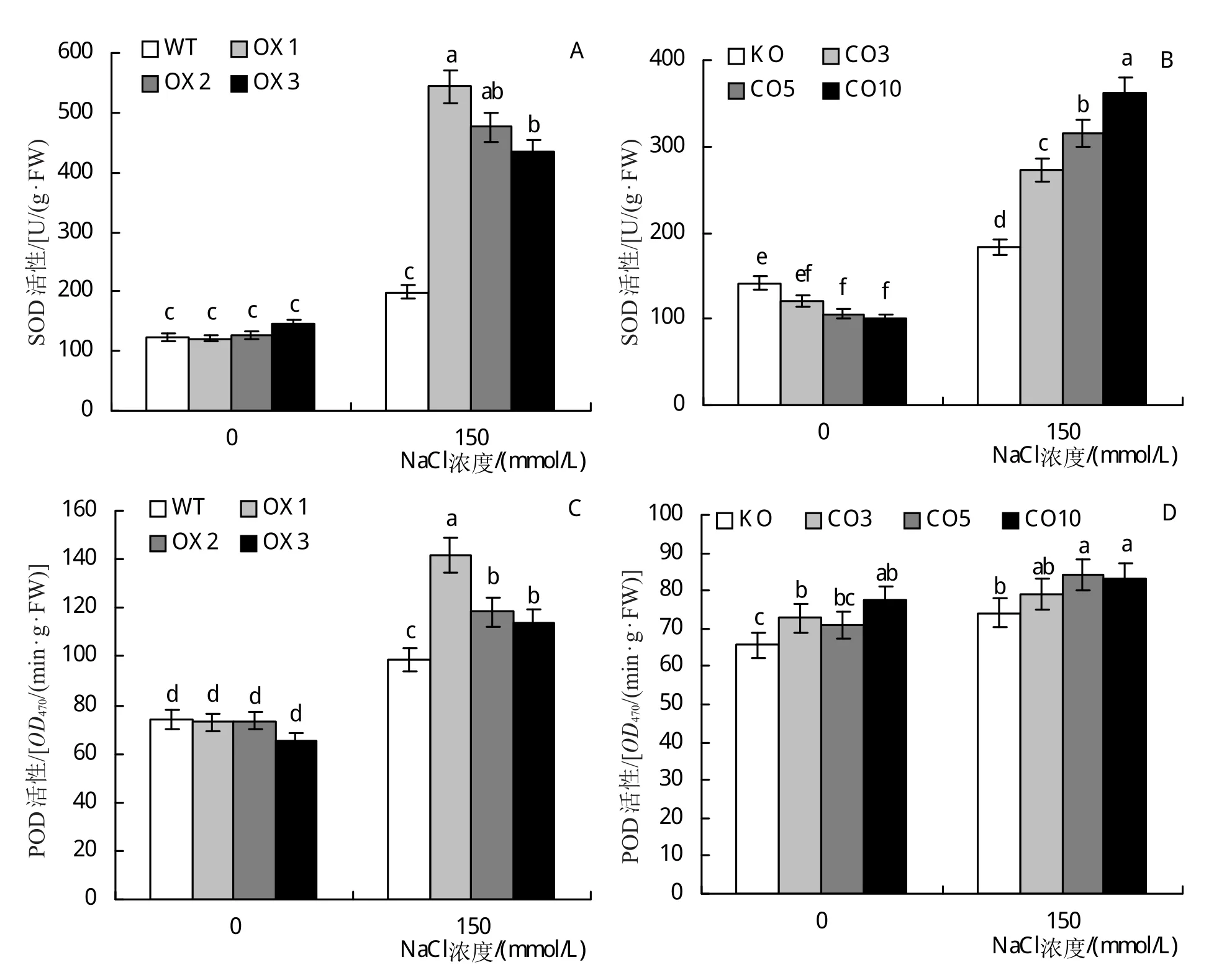
图9 BvM14-GAI基因拟南芥异源表达及异源互补植株盐胁迫前后SOD、POD活性测定结果
3 结论
笔者构建了BvM14-GAI基因的植物表达载体,利用农杆菌介导的花序浸染法转化拟南芥野生型和GAI基因突变株,通过对150 mmol/L NaCl胁迫下拟南芥异源表达和异源互补植株的表型和生理生化水平检测分析,说明BvM14-GAI可以提高拟南芥异源表达植株及异源互补植株的耐盐性。本研究结果对BvM14-GAI基因的生物学功能研究进行了有效补充,加深了甜菜M14品系耐盐分子机理的研究,也为下一步甜菜耐盐遗传育种提供参考。
4 讨论
GAI蛋白属于GRAS家族中的DELLA亚家族,目前GAI基因序列已经在多种植物中克隆,在植物的生长发育、光信号传导通路、激素信号通路和对逆境响应的生理过程中发挥着重要的作用[14],但甜菜中GAI基因功能研究尚未开展。Patrick等[15]曾发现盐胁迫处理拟南芥DELLA四缺突变体(GAI、RGA、RGL1、RGL2)与拟南芥野生型时,DELLA四缺突变体的存活率显著低于野生型;也有研究表明,拟南芥DELLA蛋白含量多时,植物耐盐性增强[16]。DELLA蛋白作为赤霉素(GA)调节植物生长过程的负反馈蛋白,对大豆的生长发育以及开花起阻遏作用,同时DELLA蛋白也参与拟南芥幼苗的光形态建成[17-18]。本研究以拟南芥野生型植株(WT)和GAI基因突变株(KO)作为对照,0 mmol/L NaCl处理时,BvM14-GAI基因异源表达拟南芥植株(OX)根长显著短于WT植株,异源互补拟南芥植株(CO)的根长也出现相同的表型,同样影响了拟南芥幼苗形态建成,苗期生长趋势缓慢,因而DELLA的过量积累会抑制植物的生长[19];150 mmol/L NaCl处理后,相比WT和KO植株,OX、CO植株的根长与对照差异不显著,因而DELLA蛋白的增加确实提高了拟南芥植株的耐盐性。前期BvM14-GAI基因结构分析表明,甜菜M14品系中的GAI基因具有GRAS和DELLA 2个保守结构域,属于GRAS家族中的DELLA亚家族,因而表现出相似的生物学功能[7]。
一般情况下,植物受到盐胁迫时,主要是Na+过量累积造成离子毒害,Na+含量不断增加导致K+含量呈下降趋势,因而K+/Na+是衡量植物受到盐胁迫损伤程度的重要指标之一,维持适宜的K+/Na+比是缓解植物盐胁迫的关键所在[20]。本研究中150 mmol NaCl胁迫处理后,BvM14-GAI基因的异源表达维持了拟南芥细胞内K+、Na+稳态,增强了异源表达和异源互补拟南芥植株的耐盐性。甜菜碱是保护植物免受非生物胁迫,如盐[21-23]、干旱[24-25]、冷[26-27]、高温[28-29]等最通用的渗透保护剂之一。相比WT和KO植株,150 mmol/L NaCl胁迫处理后OX和CO植株的甜菜碱含量均表现为增加,表明BvM14-GAI基因的转入使拟南芥植株的渗透调节能力得到了改善,从而提高BvM14-GAI基因拟南芥异源表达植株及异源互补植株的耐盐性。
当植物暴露于不利环境(如高盐、干旱、高温或寒冷)中时,通常以O2-和H2O2形式存在的ROS可以在植物中快速生成,过量的ROS会导致细胞成分(如蛋白质、脂质、碳水化合物和核酸)的氧化损伤[30]。较高的ROS水平也干扰蛋白质合成和细胞膜,导致细胞和组织损伤。本研究中BvM14-GAI基因的异源表达均增加了SOD和POD酶的活性说明BvM14-GAI基因可能通过提高抗氧化酶系统和调节渗透物质,增强拟南芥异源表达及异源互补植株对ROS的清除能力和离子稳态平衡,提高拟南芥异源表达及异源互补植株的耐盐能力。
