广泛型线粒体肌酸激酶基因在结直肠癌中的表达及生物学意义
2021-12-13唐兴奎林玉坤何嘉琳罗喜俊梁俊杰朱显军
唐兴奎,林玉坤,何嘉琳,罗喜俊,梁俊杰,朱显军
结直肠癌(colorectal cancer,CRC)是全球范围内影响人类健康与生活质量的常见恶性胃肠道肿瘤之一。据统计分析,结直肠癌占所有恶性肿瘤死亡原因的第5位[1]。目前,结直肠癌的根治性治疗方法迄今仍首推外科手术治疗,然而其5年生存率仅为50%左右[2]。全身放化疗是中晚期结直肠癌肿瘤患者手术前新辅助和术后治疗的标准有效的方法之一,但药物不良反应大并且容易产生耐药而导致治疗效果差甚至失败[3]。肿瘤复发转移是治疗失败的关键原因,因此,分析结直肠癌的生物学特性,探索其复发转移机制具有重要的临床价值。
肿瘤的发生发展过程中,肿瘤细胞往往需要摄取大量的能量以维持其快速增殖代谢特性,而肌酸激酶(Creatine kinase,CK)则是细胞能量代谢中的关键酶,可逆地催化磷酸基团从三磷酸腺苷向肌酸的转移。目前在哺乳动物中已发现了五种不同的亚型的CK,包括在细胞质中有的CKB(脑型),CKM(肌肉型)和CKMB(混合型),以及线粒体中普遍存在的线粒体肌酸激酶(uMtCK)和线粒体肌酸激酶(sMtCK)[4⁃6]。uMtCK作为细胞能量稳态的中央控制器,可与许多细胞中的胞质CK共表达,特别是在脑,胎盘,肾脏,睾丸,精子和内皮细胞等高能量需求的组织中[4,5]。既往研究发现:uMtCK在肺癌、胃癌、前列腺癌及乳腺癌等肿瘤中呈高表达状态,并且与肿瘤细胞的增殖、凋亡、转移能力息息相关[6-12]。然而,目前尚缺少uMtCK对结直肠癌生物学作用影响的报道,本文将探究uMtCK在结直肠癌组织中的表达特点,并研究其对结直肠癌细胞增殖、迁移及侵袭能力的影响及潜在机制。
1 资料与方法
1.1 组织标本
选取2017年01月至2019年12月期间在我院行结直肠癌根治性手术的患者60例,收集其新鲜癌组织和配对癌旁组织标本以及临床资料。
1.2 主要试剂和仪器
RNAiso Plus(9180)、逆转录试剂盒(RR036)、荧光定量PCR试剂盒(RR820)购自日本Takara公司,细胞培养基、胎牛血清及Matrigel胶均购自美国Corning公司,CCK⁃8细胞增殖试剂盒(KGA317)、细胞周期检测试剂盒(KGA512)购自上海凯基公司,PI3K、AKT、p⁃AKT、mTOR、p⁃mTOR、GAPDH兔抗人单克隆抗体购自美国CST公司。
1.3 方法
1.3.1 实时荧光定量PCR反应RNAiso Plus提取组织或细胞的总RNA,按照逆转录试剂盒说明书将总RNA逆转录成cDNA,以cDNA为模板按照荧光定量PCR试剂盒说明书进行目的基因的实时荧光定量PCR反应。反应条件设置:预变性95℃30 s,共40个循环(95℃5 s,65℃30 s,95℃5 s)。引物序列由上海生工公司合成:uMtCK引物上游:5′⁃CTACTCCAGGATCCCGTAGC⁃3′,uMtCK引物下游5′⁃TCGGAGGTCTGGGTACTCAG⁃3′;GAPDH引物上游:5′⁃CTCCTCACAGTTGCCATGTA⁃3′,下游5′⁃GTTGAGCACAGGGTACTTTATTG⁃3′。采用2⁃ΔΔCT法计算目的基因相对表达水平,内参为GAPDH。
1.3.2 细胞培养与转染人正常结直肠粘膜细胞(FHC)以及结直肠癌细胞(HT⁃29、SW620、LoVo、HCT116、RKO、SW480)置于37℃5% CO2培养箱中进行培养,均使用含10%胎牛血清的DMEM高糖培养基。
收集处于对数生长期的结直肠癌细胞接种于6孔板(5×105/孔),按照Lipofectamine 3000说明书进行小干扰RNA(siRNA)转染处理,实验分组为si⁃NC、si⁃uMtCK⁃1和si⁃uMtCK⁃2。
1.3.3 CCK⁃8细胞增殖实验采用CCK⁃8法进行细胞增殖实验。收集转染24 h后的结直肠癌细胞接种于96孔板(1000/孔),分别接种后24 h、48 h、72 h加入10μL CCK⁃8试剂,避光孵育2 h,450 nm波长下测定OD值,绘制生长曲线。
1.3.4 Transwell实验采用Transwell法分别检测细胞迁移和侵袭。收集转染48 h后的结直肠癌细胞,以不含胎牛血清的DMEM培养基重悬细胞,按2×105/100μL接种于Transwell培养板上室(侵袭实验所用上室经10% Matrigel胶预包被处理),下室加入500μL含10%胎牛血清的DMEM培养基,培养24 h后取出小室,4%多聚甲醛固定细胞,0.5%结晶紫溶液染色,显微镜下选取随机选择5个高倍视野进行拍照,统计细胞数量。
1.3.5 Western blot实验收集转染48 h后的结直肠癌细胞,提取细胞总蛋白,BCA法进行蛋白定量,取等量的蛋白样品进行SDS⁃PAGE电泳,接着电转至PVDF膜,分别进行5%脱脂奶粉封闭非特异性抗原,PI3K(1∶1000)、AKT(1∶1000)、p⁃AKT(1∶1000)、mTOR(1∶1000)、p⁃mTOR及GAPDH(1∶5 000)等一抗孵育过夜,次日孵育HRP标记的二抗(1∶5 000),ECL试剂发光显色后进行半定量分析。
1.4 统计学分析
统计学分析采用GraphPadPrism 7.0软件。计数资料比较则采用卡方检验,计量资料中两组间比较采用t检验,多组间比较采用单因素方差分析,组间比较采用LSD⁃t检验。生存分析采用Kaplan⁃Meier法,组间比较采用log⁃rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 uMtCK高表达与结直肠癌患者的预后有关
为了验证uMtCK高表达与结直肠癌患者临床病理特征和生存时间的相关性,我们收集了上述临床病例的病理特征资料和随访资料,并分析uMtCK表达量与临床病理特征和生存时间的关系。结果表明:uMtCK在结直肠癌中呈高表达现象(图1A);Kaplan⁃Meier生存分析显示,高表达uMtCK的患者无瘤生存时间较低表达者明显缩短(图1 B);uMtCK高表达与T分期、N分期和TNM分期密切相关(表1)。以上结果表明,uMtCK高表达可能影响肿瘤进展,并提示患者的不良预后。
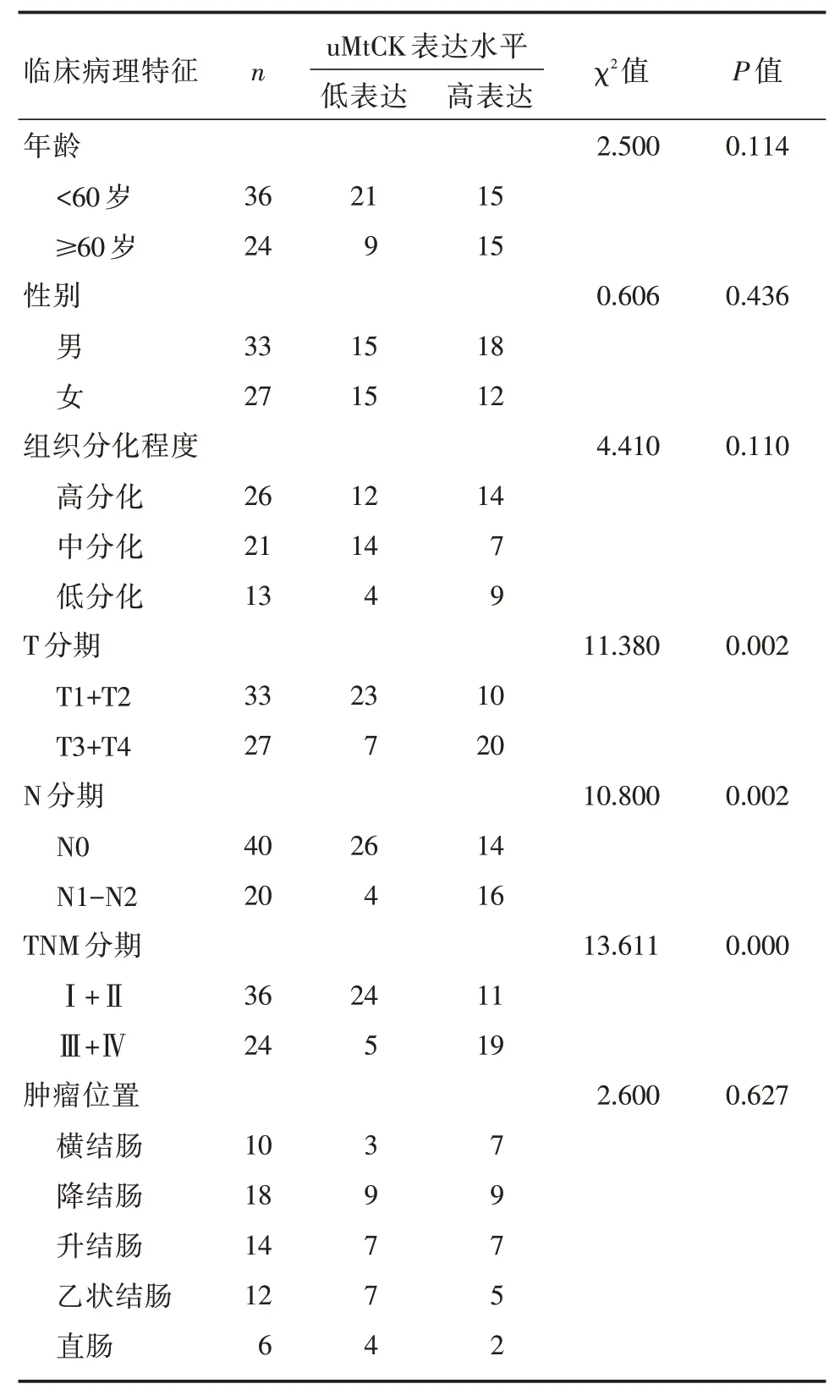
表1 uMtCK表达水平与结直肠患者临床病理特征的相关性(n)
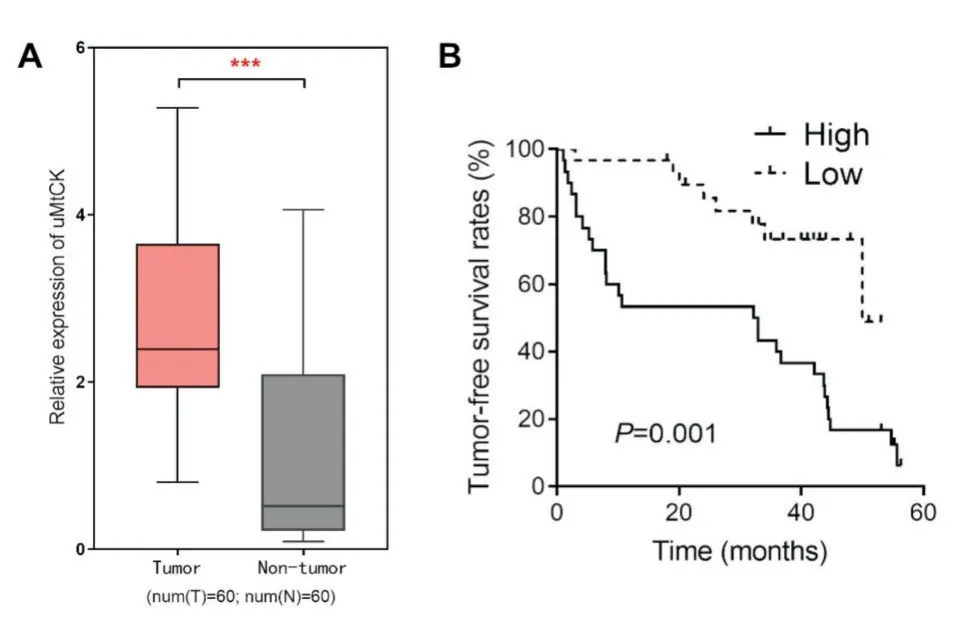
图1 uMtCK高表达与结直肠癌患者的预后A:uMtCK在
2.2 uMtCK在结直肠癌细胞株表达升高
荧光定量PCR检测5株结直肠癌细胞(HT⁃29、SW620、LoVo、HCT116、RKO、SW480)内uMtCK的表达,以人正常结直肠粘膜细胞(FHC)作为对照组。结果显示,uMtCK在结直肠癌细胞中的表达均高于人正常结直肠粘膜细胞(图2A,P<0.001);选择表达水平较高HT⁃29和RKO细胞构建uMtCK低表达细胞模型,荧光定量PCR检测发现,转染siRNA后HT⁃29和RKO细胞内LINC00239表达显著受到抑制(图2B,P<0.001),提示模型构建成功。
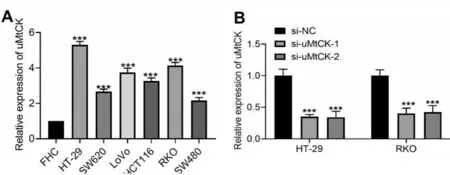
图2 uMtCK在人结直肠癌细胞、正常结直肠粘膜细胞A:及siRNA转染后的结肠癌细胞;B:中的表达情况,***P<0.001
2.3 敲低uMtCK表达抑制结直肠癌细胞的增殖能力
为了探究uMtCK对结直肠癌细胞增殖特性的影响,我们利用uMtCK低表达细胞进行了CCK⁃8增殖实验。结果显示,si⁃uMtCK⁃1和si⁃uMtCK⁃2组细胞的增殖能力较siNC组明显减弱(图3,P<0.001)。说明敲低uMtCK表达抑制细胞增殖能力。

图3 敲低uMtCK表达对结直肠癌细胞增殖能力的影响A:HT⁃29细胞;B:RKO细胞;***P<0.001
2.4 敲低uMtCK表达抑制结直肠癌细胞迁移及侵袭能力
为了探究uMtCK对结直肠癌细胞转移能力的影响,我们通过Transwell实验检测发现,si⁃uMtCK⁃1和si⁃uMtCK⁃2组细胞迁徙数量和侵袭数量均较siNC组显著减少(图4,P<0.001)。说明敲低uMtCK表达抑制细胞迁移及侵袭能力。
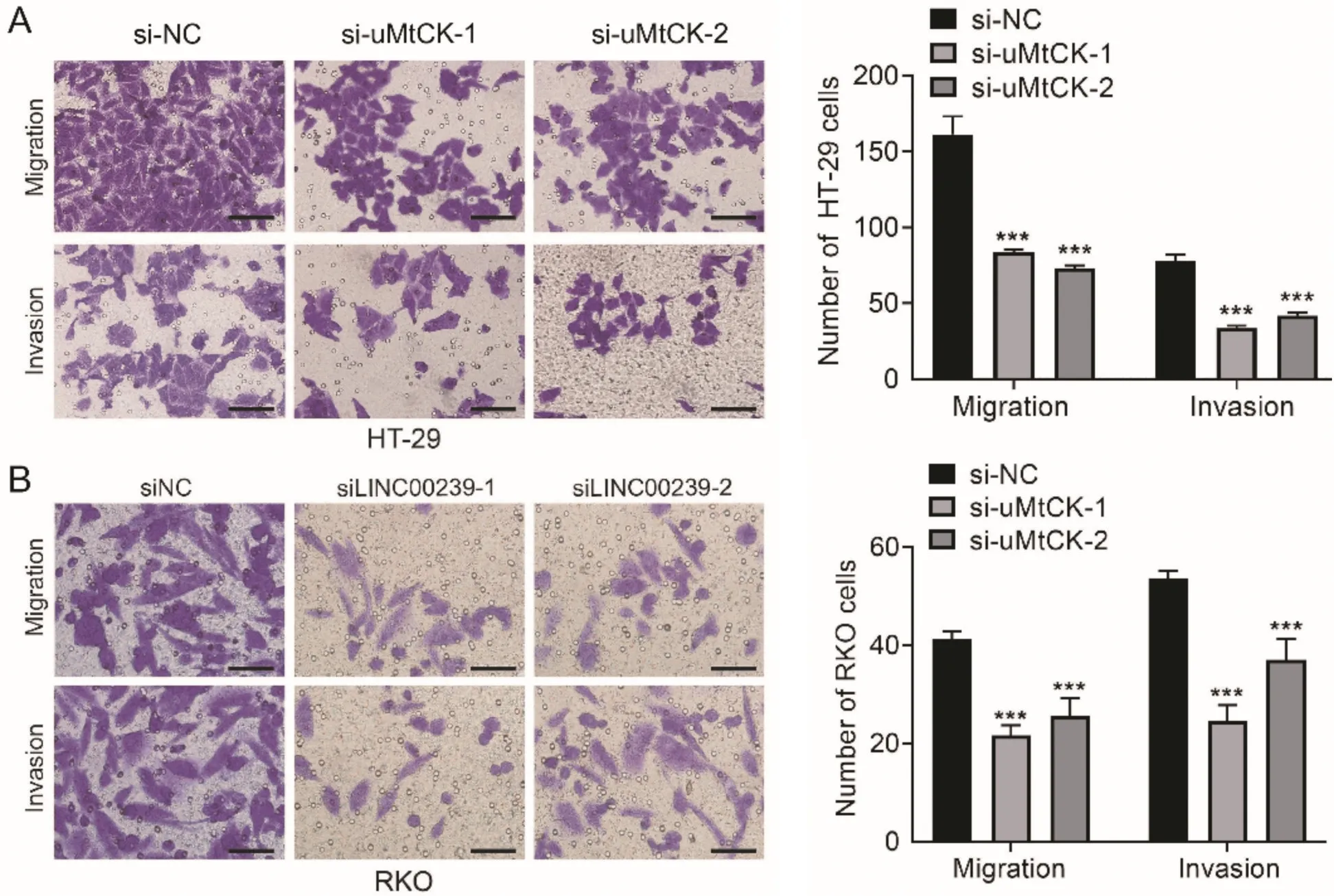
图4 敲低uMtCK表达对结直肠癌细胞迁移及侵袭能力的影响A:HT⁃29细胞;B:RKO细胞;***P<0.001
2.5 敲低uMtCK表达抑制结直肠癌细胞PI3K/AKT/mTOR信号通路活性
PI3K/Akt/mTOR信号通路与结直肠癌的发生发展密切相关。为了验证uMtCK和PI3K/Akt/mTOR信号通路活性的相关性,我们利用Western blot实验检测发现,si⁃uMtCK⁃1和si⁃uMtCK⁃2组细胞内PI3K、p⁃AKT、p⁃mTOR蛋白表达量较siNC组明显下调。说明敲低uMtCK表达抑制PI3K/AKT/mTOR信号通路活性(图5)。

图5 敲低uMtCK表达对结直肠癌细胞PI3K/Akt/mTOR信号通路活性的影响A:HT⁃29细胞;B:RKO细胞;***P<0.001
3 讨论
恶性肿瘤的发生是由于促癌基因被激活和/或抑癌基因下调/失活所诱发,近年研究发现,肿瘤组织和正常组织中不同基因表达量存在显著差异,提示其在肿瘤演进过程中起着重要作用,既可能是促癌基因的推动肿瘤演进的重要因素,又可能对肿瘤演进起到抑制作用[13]。同样地,部分特异基因可通过各种机制的表达失调参与结直肠癌的演进,与肿瘤演进及复发转移密切相关,有望成为具有结直肠癌诊断、治疗及预测预后的生物学标志物[14]。本研究首次发现uMtCK高表达于结直肠癌组织,其表达量与患者的肿瘤分期存在紧密联系,高表达uMtCK提示患者无瘤生存率降低。因此,我们认为uMtCK是结直肠癌潜在的促癌基因,有望成为新型的肿瘤标志物和预后判断指标。
分子蛋白可在结直肠癌组织中构建复杂而又精密的调控体系,其表达失调能够引起结直肠癌细胞内的各种生物学变化,在不同层次精细的调控肿瘤细胞的增殖、分化和转移[15]。已有研究显示,uMtCK高表达能够促进乳腺癌、胃癌等恶性肿瘤的增殖或转移能力[6-12]。本研究也发现uMtCK能够调控结直肠癌细胞的增殖特性,敲低uMtCK表达能够降低结直肠癌细胞的增殖能力,提示靶向抑制uMtCK表达可以发挥抗肿瘤作用。肿瘤细胞迁移和侵袭是恶性肿瘤的关键特征,是导致恶性肿瘤患者死亡的直接因素[16]。本研究揭示uMtCK是结直肠癌细胞迁移和侵袭的重要调控因子,敲低uMtCK表达可以同时抑制结直肠癌细胞的迁徙及侵袭能力。
研究发现,PI3K/Akt/mTOR信号通路在肿瘤细胞转移复发过程中发挥关键作用[17]。PI3K是PI3K/Akt信号通路关键蛋白之一,它广泛存在于各类肿瘤细胞,参与调节肿瘤细胞的生长、迁移、侵袭等恶性生物学行为[18]。PI3K/Akt/mTOR信号通路传导链上另一个关键性调节蛋白是Akt,它是PI3K最重要的下游底物,当PI3K被诱导激活后,肿瘤细胞的细胞膜将迅速产生PIP3蛋白,PIP3蛋白充当第二信使,它和肿瘤细胞内与生长因子受体后,进一步促进Akt蛋白磷酸化,最后使后者活化[17]。活化Akt再通过蛋白磷酸化作用激活其下游靶蛋白mTOR,最终对肿瘤细胞的增殖、周期及转移等恶性行为发挥调节作用[19]。本研究通过Western blot检测uMtCK低表达细胞模型中PI3K/Akt/mTOR信号通路关键蛋白的表达,结果发现,敲低uMtCK能够下调PI3K蛋白及Akt磷酸化、mTOR磷酸化蛋白的表达,提示PI3K/Akt/mTOR信号通路活性受到抑制。由此可见,uMtCK在结直肠癌细胞中介导PI3K/Akt/mTOR信号通路转导,这可能是uMtCK调控结直肠癌细胞增殖、迁徙及侵袭的分子调控机制之一,具体机制仍需进一步研究。
综上所述,本研究首次证实uMtCK高表达于结直肠癌,其高表达与患者的肿瘤分期及临床预后有关。更重要的是,本研究细胞实验表明uMtCK能够调控结直肠癌细胞的增殖、迁移及侵袭能力,并揭示uMtCK与PI3K/Akt/mTOR信号通路异常激活密切相关。总的来说,本研究提示了uMtCK可能成为结直肠癌预后及靶向治疗的潜在肿瘤标志物。
