Cyp4v3基因敲除小鼠模型的表型分析
2021-12-13贾睿璇姜尚伟杨丽萍
贾睿璇,姜尚伟,赵 琳,杨丽萍
(北京大学第三医院眼科,眼部神经损伤的重建保护与康复北京市重点实验室,北京 100191)
结晶样视网膜变性(Bietti crystalline dystrophy,BCD)是一种相对罕见的视网膜变性,典型改变为黄白色闪光结晶样物质沉积于视网膜,并伴有视网膜色素上皮(retinal pigment epithelium,RPE)细胞和脉络膜毛细血管层萎缩,部分患者角膜缘也可见黄白色结晶沉积[1]。该病是一种常染色体隐性遗传病,由Bietti[2]医生在1937年描述。BCD在世界范围内是一种罕见的遗传病,在东亚人群中发病率较高,尤其是在中国和日本[3-5]。
临床上,绝大多数BCD患者20~40岁发病,双眼受累。临床表现为进行性中心视力下降,或夜盲,或两者兼有,亦有无自觉症状,因眼底检查才被发现者。色觉早期正常,晚期可有红绿色盲或全色盲。通常在患者50~60岁时由于严重的视力下降和视野缩小成为法定盲人[6]。眼部检查发现,BCD患者的特征性表现为眼底有大量黄白色结晶沉积,主要位于视网膜后极部,伴不同程度的色素沉积,但在晚期患者中结晶沉积减少甚至不明显[3,7-9]。光学相干成像(optical coherence tomography,OCT)检查显示RPE和脉络膜可呈现出高反射性[10-12]。眼底荧光血管造影(fundus fluorescein angiography,FFA)检查显示RPE和脉络膜毛细血管萎缩[13]。视网膜电生理(electroretinogram,ERG)检查早期可表现为轻中度异常,甚至可无异常,但在晚期ERG波幅下降甚至记录不到波形[10,14-15]。
2004年,Li等[16]确定BCD的致病基因为CYP4V2基因,随后不断有新的CYP4V2突变位点被报道,进一步扩大了CYP4V2的致病突变谱[3-4,17-20]。CYP4V2基因位于4q35,共包含11个外显子,基因组全长19 kb,编码525个氨基酸。其编码的蛋白属于细胞色素P450家族成员,广泛表达于人体的多个组织器官,包括肝脏、角膜、视网膜、淋巴细胞等,在脂肪酸代谢中发挥重要作用。有研究显示BCD患者血清中脂肪酸含量异常,推测其与CYP4V2蛋白所具有的催化中长链脂肪酸羟化反应有关[21-24]。在中国患者中,三个已知突变位点c.802-8_810del17bp、c.1091-2A>G和c.992A>C出现的频率最高,共占73.5%,是中国汉族BCD患者的突变热点,其中c.802-8_810del17bp突变导致mRNA水平外显子7缺失,进而突变后的mRNA以无义介导的mRNA降解(nonsense-mediated mRNA decay,NMD)途径降解,其发病机制为蛋白功能缺失,基因替代治疗通过外源途径补充缺失蛋白的功能,理论上可有效控制患者病情。CYP4V2蛋白结构在不同物种间具有高度保守性,小鼠CYP4V3蛋白与人类具有高达92%的相似度,因此,为更好地了解BCD发病机制,本研究建立了Cyp4v3基因敲除小鼠模型,以模拟BCD患者的症状,并加以研究。我们通过眼底彩照检查观察Cyp4v3-/-小鼠眼底是否存在结晶沉积,ERG检查小鼠视网膜功能是否改变,免疫荧光染色观察小鼠视网膜形态结构是否发生改变,鬼笔环肽染色观察小鼠RPE形态结构是否发生改变,以观察该小鼠模型是否可模拟患者BCD临床改变,为后续发病机制和基因治疗研究提供有效动物模型。
1 材料与方法
1.1 实验动物
无特定病原体(specific pathogen free,SPF)级6~8周C57BL/6J野生型(wild type,WT)小鼠购于北京维通利华实验动物技术有限公司,Cyp4v3-/-小鼠委托北京百奥赛图基因生物技术有限公司构建。以上小鼠均饲养于北京大学医学部实验动物科学部SPF级实验动物室中。
1.2 主要试剂和仪器
超微量分光光度计(ND2000)购自美国Thermo Fisher Scientific 公司,PCR扩增仪(EDC810,ETC 811)购自北京东胜创新生物科技有限公司,测序仪(3130XL)购自美国ABI公司,小动物视网膜影像系统(Micro III)购自美国Phoenix Research Laboratory 公司,视觉电生理仪(Espion E2)购自美国Diagnosis 公司,眼科手术显微镜购自美国Alcon公司,冰冻切片机(CM3050)购自德国Leica公司,激光共聚焦显微镜(A+/AIR+)购自日本NICON 公司,荧光显微镜(Leica)购自德国 Leica 公司。血液基因组 DNA 抽提试剂盒(D3392-02)购自美国 OMEGA 公司,2×Taq Master Mix(Dye Plus,P112-01)购自南京诺唯赞生物科技有限公司,1%(质量分数)阿托品购自美国Alcon公司,2%(质量分数)羟甲基纤维素购自天津晶明新技术开发有限公司,三溴乙醇购自美国Sigma公司,抗视紫红质抗体(anti-rhodopsin antibody,1D4,ab5417)购自美国Abcam 公司,花生凝集素抗体(peanut agglutinin antibody,PNA,B-1075)购自美国Vector 公司,驴抗小鼠IgG(H+L)二抗Alexa Fluor 488(A21202)购自美国Thermo Fisher Scientific公司,罗丹明标记链霉亲和素(123126)购自美国Jackson Immunology 公司,罗丹明标记鬼笔环肽(CA1610)和4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)溶液(C0060)购自北京索莱宝科技有限公司。
1.3 Cyp4v3-/-小鼠模型构建
利用clustered regularly interspaced short palindromic repeats(CRISPR)/Cas9技术,针对Cyp4v3基因第一外显子设计sgRNA序列,选定其靶位点为CGCAGCGAGCGCGGTCTCCC(图1),构建Cas9/sgRNA质粒并将其显微注射入C57BL/6J小鼠受精卵内,选定F0代Cyp4v3-/-小鼠与WT小鼠交配繁殖并进行后续实验。

WT,wild type.图1 Cyp4v3-/-小鼠基因组DNA缺失11 bp c.278_288delCGCGGTCTCCCFigure 1 Genomic DNA of Cyp4v3-/-mouse deleting 11 bp c.278_288delCGCGGTCTCCC
1.4 小鼠基因型鉴定
1.4.1小鼠DNA提取 取0.5 cm长度小鼠尾巴,按照血液基因组 DNA 抽提试剂盒相应步骤提取小鼠基因组DNA。取2 μL DNA提取物于ND2000超微量分光光度计的检测小孔中进行DNA纯度和浓度的检测。DNA提取物可用于聚合酶链式反应PCR扩增或置于-20 ℃保存。
1.4.2PCR 扩增相应片段 在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)基因库中找到小鼠Cyp4v3基因的基因组DNA序列(NC_000074.6),按照相应的引物设计原则设计上下游引物,并交由北京睿博兴科生物技术有限公司合成。上游引物序列为5′-TGGTGCAGACG-CTACAGATT-3′,下游引物序列为5′-AGGTGT-CTCTGACTGACGAGG-3′,产物长度为494 bp。PCR反应采用25 μL体系,含有12.5 μL 2×Taq Master Mix,上下游引物各1 μL(10 μmol/L),DNA模板50 ng,用无RNA酶的水补齐25 μL体系。使用下列程序进行PCR扩增:95 ℃ 3 min预变性;然后进入循环95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,循环35次;72 ℃ 5min彻底延伸。
1.4.3测序分析 将PCR产物进行一代测序,使用Chromas软件对测序峰图进行分析,确定突变位点。
1.5 小鼠眼底彩照检查
实验开始前15 min小鼠用1%阿托品散瞳,后用1.25%(质量分数)三溴乙醇麻醉剂腹腔注射,并再一次散瞳。使麻醉后的小鼠平躺于Micro Ⅲ小动物视网膜影像系统的实验台,在小鼠眼球上滴加适量2%羟甲基纤维素以改善镜头及角膜的接触效果。升降、旋转实验台使小鼠眼球位于合适位置,调整焦距与光强得到清晰小鼠眼底图像,用Micro Ⅲ软件拍摄采集图像。
1.6 小鼠ERG检查
将小鼠暗适应16 h后准备用于电生理检查,所有操作均在暗红色光下进行。实验开始前15 min,用1%阿托品将小鼠散瞳,后用1.25%三溴乙醇麻醉剂腹腔注射麻醉小鼠并再一次散瞳。将麻醉后的小鼠置于加热的视觉电生理仪的动物实验平台上,将地电极插入小鼠尾巴根部,参考电极插入小鼠下颌,两个金箔电极轻微接触小鼠左右眼角膜缘处,滴加适量2%羟甲基纤维素,改善电极与角膜接触效果。计算机系统内运行程序,分别为暗适应闪光强度为0.003、0.01、0.1、1、3、10、100 cd·s/m2(背景光强度为0 cd·s/m2,刺激间隔为15 s,记录3个ERG信号的平均值);明适应闪光强度为3、10、30、100 cd·s/m2(明适应时间为5 min,背景光强度为30 cd·s/m2,刺激间隔为15 s,记录5个ERG信号的平均值)以及明适应闪光强度为3、10 cd·s/m2,频率为10 Hz闪烁ERG。
1.7 小鼠眼球冰冻切片免疫荧光染色
用眼科剪将小鼠眼球小心取下,放入4%(质量分数)多聚甲醛4 ℃固定2 h后在体视显微镜下去前节,继续在4%多聚甲醛固定,然后使用30%(质量分数)蔗糖溶液脱水。将小鼠眼球放入冷冻包埋剂中,用镊子将小鼠眼球摆好方向后放入液氮内迅速冷冻,后可进行冰冻切片。切片厚度7 μm,4 ℃预冷的丙酮固定10 min后晾干放入-80 ℃保存。切片恢复室温用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗3次后,用5%(质量分数)血清室温封闭1 h,在组织上滴加一抗工作液,4 ℃过夜孵育。取出玻片恢复室温后,PBS清洗3次,滴加二抗工作液,室温孵育1 h。PBS清洗3次后,滴加DAPI稀释液,室温孵育10 min,PBS清洗3次后滴加防荧光淬灭封片剂,盖上盖玻片后采集图像。
1.8 小鼠RPE铺片鬼笔环肽染色
用眼科剪将小鼠眼球取下,浸入预冷的PBS中15 min,将小鼠眼球转移至4%多聚甲醛中固定1 h,在体视显微镜下去前节,将神经视网膜与RPE层分离,并将RPE层均匀剪成4瓣。将RPE铺片用预冷的PBS清洗3次后放入0.1%(质量分数)Triton中通透20 min,后用PBS清洗3次。将RPE铺片放入96孔板的一个孔内,加入鬼笔环肽工作液,室温孵育1 h,PBS清洗3次后将RPE铺片置于载玻片上展平,滴加少量封片剂用盖玻片封片后采图。
1.9 统计学分析
采用SPSS 20.0统计学软件和Excel 2016软件进行统计学分析。不同月龄Cyp4v3-/-小鼠和WT小鼠组间ERG各波幅差异比较均采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠基因型鉴定
小鼠DNA提取物的PCR产物测序结果显示,与WT小鼠相比,得到三种基因型小鼠,分别为c.285del1bp、c.285_286del2bp、c.278_288del11bp,选择Cyp4v3基因第一外显子c.278_288del11bp(CGCGGTCTCCC,图1)小鼠进行后续实验。上述变异导致CYP4V3蛋白读码框发生移码,形成提前出现的终止密码子,所转录的mRNA将发生NMD途径降解,导致该模型小鼠体内CYP4V3蛋白缺失,进而影响其功能。
2.2 不同月龄小鼠眼底彩照检查
我们分别在Cyp4v3-/-小鼠3、6、12月龄时进行眼底彩照检查(图2)。与WT小鼠相比(图2D),Cyp4v3-/-小鼠在3月龄时眼底彩照未出现明显变化(图2A),随着年龄增长,6月龄时可以在眼底观察到散在的、主要分布于后极部视网膜的黄白色结晶,且伴随着轻微的色素沉积(图2B),到12月龄时,眼底彩照显示Cyp4v3-/-小鼠眼底结晶减少甚至很难发现,但是色素沉积情况严重,且出现斑块状改变,可以观察到RPE-脉络膜毛细血管萎缩(图2C)。
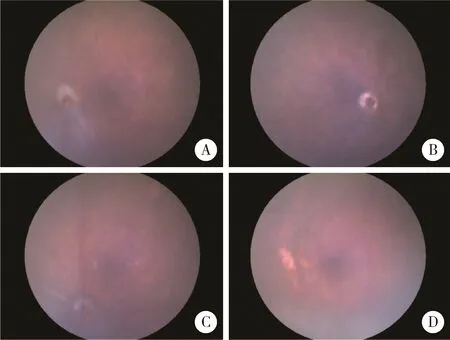
A,color fundus photography of WT mouse;B,color fundus photography of Cyp4v3-/-mouse in 3 months;C,color fundus photography of Cyp4v3-/-mouse in 6 months;D,color fundus photography of Cyp4v3-/-mouse in 12 months.WT,wild type.图2 不同月龄Cyp4v3-/-小鼠与WT小鼠眼底彩照Figure 2 Color fundus photography of different ages of Cyp4v3-/-mouse and WT mouse
2.3 不同月龄小鼠ERG检查
我们分别在3、6、12月龄时取Cyp4v3-/-小鼠和对应的WT小鼠同时进行ERG检查,结果显示在3月龄时,与WT小鼠相比,Cyp4v3-/-小鼠在暗适应各刺激强度下的a波和b波振幅没有明显降低(图3A);在6月龄时,Cyp4v3-/-小鼠暗适应各刺激强度下的a波振幅总体低于WT小鼠,且有4个刺激强度差异有统计学意义,而暗适应所有刺激强度下的b波振幅均低于WT小鼠,且差异均有统计学意义(图3B);在12月龄时,Cyp4v3-/-小鼠在暗适应和明适应的所有刺激强度下的a波和b波的振幅均明显低于WT小鼠,且差异均有统计学意义。明适应的闪烁光ERG同样也是Cyp4v3-/-小鼠在两个强度刺激下的b波振幅均低于WT小鼠,且差异均有统计学意义(图3C)。
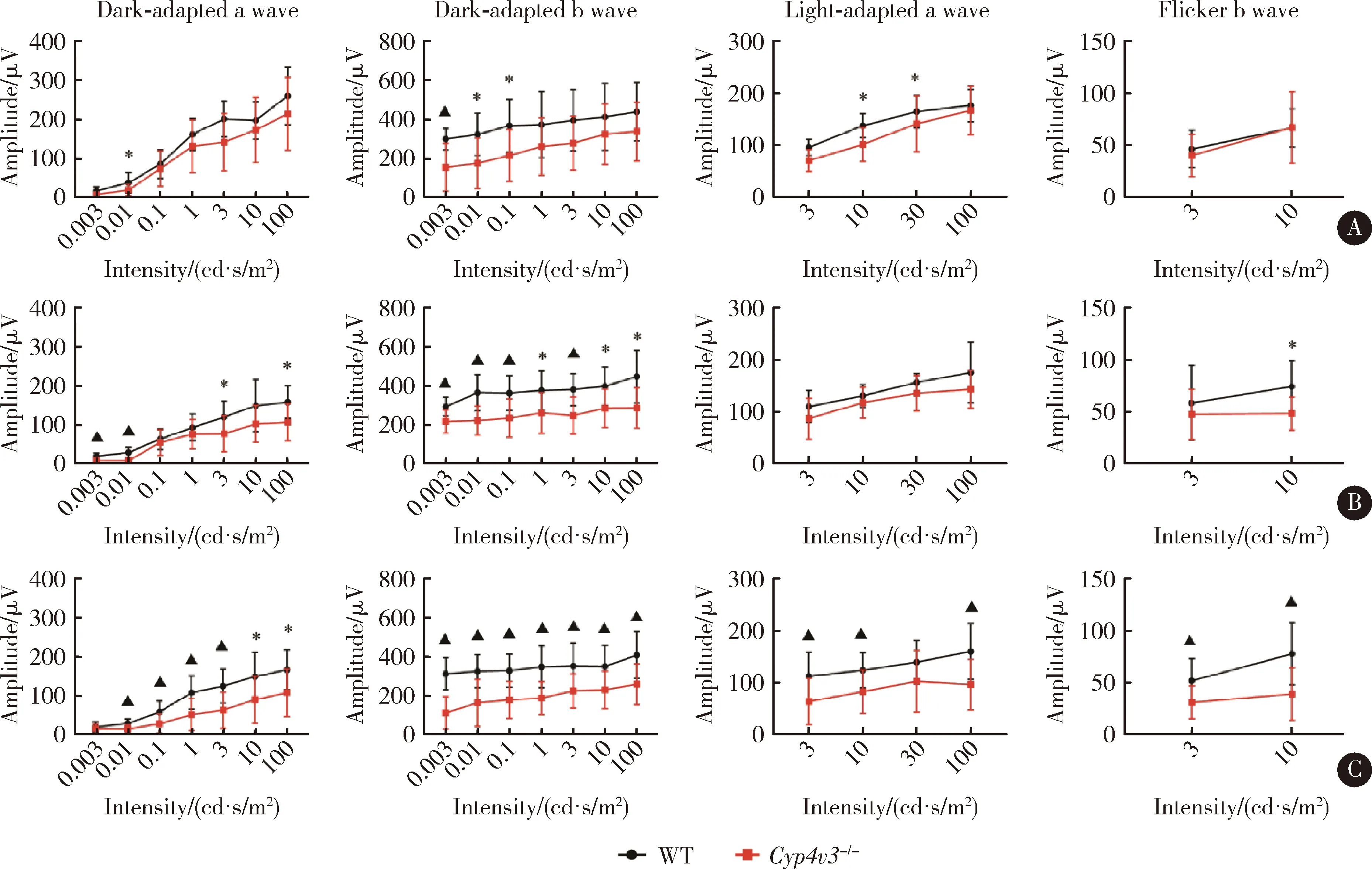
A,ERG responses of Cyp4v3-/-mouse and WT mouse in 3 months(n=6);B,ERG responses of Cyp4v3-/-mouse and WT mouse in 6 months(n=5);C,ERG responses of Cyp4v3-/-mouse and WT mouse in 12 months(n=7).*P<0.05,▲P<0.01,WT mouse vs.Cyp4v3-/-mouse.WT,wild type;ERG,electroretinogram.图3 不同月龄Cyp4v3-/-小鼠与WT小鼠ERGFigure 3 ERG responses of different ages of Cyp4v3-/-mouse and WT mouse
2.4 不同月龄小鼠与WT小鼠比较神经视网膜变化
分别在Cyp4v3-/-小鼠3、6、12月龄时取材进行冰冻切片免疫荧光染色,与相应的WT小鼠进行比较。分别用1D4抗体结合的视紫红质标记视杆细胞,PNA抗体标记视锥细胞,观察Cyp4v3-/-小鼠神经视网膜层尤其是感光细胞变化,结果显示,与WT小鼠相比,Cyp4v3-/-小鼠的视杆细胞数量及形态没有明显变化,视锥细胞数量和视锥细胞外节形态也未发现明显改变(图4)。

WT,wild type;PNA,peanut agglutinin antibody.图4 不同月龄Cyp4v3-/-小鼠与WT小鼠1D4和PNA抗体免疫荧光染色(×40)Figure 4 Immunofluorescence staining of different ages of Cyp4v3-/-mouse and WT mouse in 1D4 and PNA antibody(×40)
2.5 不同月龄小鼠与WT小鼠比较RPE结构变化
取3、6、12月龄Cyp4v3-/-小鼠和对应月龄的WT小鼠进行鬼笔环肽染色以观察其特异标记的F-actin蛋白,以此来评估Cyp4v3-/-小鼠RPE的形态结构。鬼笔环肽染色结果显示,与WT小鼠相比,Cyp4v3-/-小鼠随着年龄增长,RPE细胞形态逐渐发生改变。3月龄时,未见明显变化;6月龄时,Cyp4v3-/-小鼠的RPE细胞六边形结构稍松散,且变形;到12月龄时,Cyp4v3-/-小鼠的RPE细胞六边形形状明显扩大且不规则(图5A)。我们选取同等大小视野计数其中RPE细胞的数量进行统计分析,结果显示在3和6月龄时,Cyp4v3-/-小鼠的RPE细胞数量均少于WT小鼠,但是差异没有统计学意义,在12月龄时Cyp4v3-/-小鼠的RPE细胞数量明显少于WT小鼠,而且差异有统计学意义(图5B)。
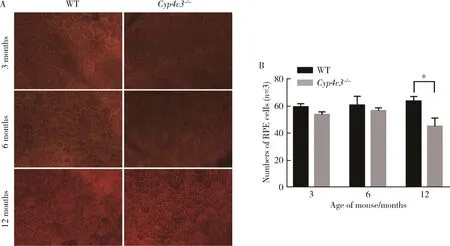
A,phalloidin staining of 3,6,12 months old Cyp4v3-/-mouse and WT mouse(×40);B,analysis of the RPE cells(n=3).*P<0.05,WT mouse vs.Cyp4v3-/-mouse.WT,wild type;RPE,retinal pigment epithelium.图5 不同月龄Cyp4v3-/-小鼠与WT小鼠鬼笔环肽染色及RPE细胞统计结果Figure 5 Phalloidin staining of different ages of Cyp4v3-/-mouse and WT mouse and statistics analysis of RPE cells
3 讨论
本研究建立了一个Cyp4v3-/-小鼠模型,随着年龄增长,该小鼠模型可模拟BCD患者的一些临床症状,包括眼底结晶样物质沉积、视网膜电生理功能下降、RPE细胞-脉络膜毛细血管萎缩,为研究BCD发病机制和基因治疗提供了有效模型。
此前,Lockhart等[25]于2014年创建了部分外显子1到外显子11以及全部的外显子2到外显子10大片段缺失的Cyp4v3-/-小鼠模型,与该模型相比,(1)本研究所建立的小鼠模型同样可模拟患者BCD的临床改变,比如存在眼底黄白色结晶样沉积;(2)Lockhart等[25]的研究未对RPE细胞进行鉴定,本研究中我们发现该小鼠存在RPE细胞病变,为后续进行BCD机制研究提供借鉴;(3)与大片段缺失Cyp4v3-/-小鼠模型相比,本研究建立的小鼠模型由于仅缺失11 bp,有利于进行基因编辑治疗的研究。
根据Yuzawa等[7]的研究,将BCD分为三个阶段:第一阶段,在黄斑区域观察到RPE萎缩,并伴有均匀的细小白色结晶沉积物;第二阶段,RPE萎缩范围逐渐扩大,脉络膜毛细血管也开始在后极萎缩,病变中的晶体沉积物的形状和大小各不相同,并且有融合的趋势;第三阶段,在整个眼底观察到RPE-脉络膜毛细血管萎缩,但是结晶样沉积逐渐减少甚至消失。此时,疾病晚期的BCD患者眼底改变与严重的视网膜色素变性患者很难区分。本研究中Cyp4v3-/-小鼠的眼部病理改变均与BCD患者的临床症状变化过程非常相似。
许多研究发现,BCD患者的症状严重程度与RPE萎缩区域大小以及脉络膜厚度相关[14,26]。Rossi等[10]发现,在一些具有相同基因型的患者中视网膜内结晶样沉积的积累程度不同,ERG结果也各有不同。OCT结果显示有3例患者尽管存在神经视网膜紊乱和高反射性,但是其中央凹中保留了外界膜,RPE和脉络膜毛细血管萎缩情况好于其他患者,这3例患者的视力好于其他患者。我们据此推测,BCD患者的临床表现严重程度可能与RPE和脉络膜毛细血管的萎缩相关,因此,本研究用鬼笔环肽染色标记RPE的F-actin蛋白以显示六边形边界,观察到Cyp4v3-/-小鼠的RPE在疾病后期形状改变,排列松散,且单位面积内数量减少,这与Xiong等[27]发现RPE对腺相关病毒(adeno-associated virus,AAV)毒性反应的表现相似,而且Xiong等[27]发现,RPE比感光细胞对AAV的毒性反应更敏感,所受损伤更明显。
目前已知RPE在眼的正常发育、视网膜正常结构的维持等方面都起着重要作用[28]。RPE对感光细胞脱落的外节碎片的吞噬以及后续的消化处理对维持感光细胞乃至整个视网膜的结构有重要作用。RPE在视循环中同样起重要,其中存在许多参与视循环的重要的蛋白以及酶[29]。Nakano等[30]发现在ARPE-19细胞中,CYP4V2是其表达的主要细胞色素P450,并且发现CYP4V2蛋白存在于视网膜和角膜的上皮细胞中,定位于内质网,他们还发现CYP4V2是一种饱和中链脂肪酸的选择性ω-羟化酶,N-羟基-N′-(4-正丁基-2-甲基苯基甲,HET0016)是该酶的抑制剂。Hata等[31]建立了BCD患者来源的诱导多能干细胞(induced pluripotent stem cells,iPSC)并分化成人的RPE细胞,且该患者特异性iPSC-RPE细胞可以出现空化细胞质的类似于BCD患者死后标本中出现的变性,在该研究中发现,BCD患者来源的iPSC-RPE细胞表现出溶酶体功能障碍和自噬通量受损,随后细胞死亡。根据以上研究我们可以发现,CYP4V2在人的RPE细胞中表达丰富,并在BCD疾病进程中发挥重要作用。本研究中我们尚未对BCD发病机制进行深入研究,对BCD中RPE受损机制也需要进一步研究探讨。
本研究中,我们进一步证明Cyp4v3-/-小鼠同样以RPE细胞变性受损为主要特征,感光细胞变性不明显。本研究的重要意义是建立了模仿人类BCD疾病的小鼠模型,并将疾病的主要损伤部位定位于RPE细胞,为后续BCD的致病机制及基因治疗研究奠定了基础。
