树突状细胞疫苗特异肿瘤多肽联合树突状细胞体外刺激淋巴细胞功能评估
2021-12-13周心娜王小利袁艳华杨化兵耿会珍李子博
杨 朵,周心娜,王 硕,王小利,袁艳华,杨化兵,耿会珍,彭 兵,李子博,李 彬,任 军△
(1.首都医科大学附属北京世纪坛医院肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038;2.河北博海生物工程开发有限公司,石家庄 050035)
近年来,免疫疗法已成为肿瘤治疗的研究热点,而肿瘤疫苗是免疫治疗重要的选择之一。由于树突状细胞(dendritic cell,DC)具有高效的抗原递呈能力,选择其作为载体制备DC肿瘤疫苗已成为有效的肿瘤免疫治疗手段[1]。DC疫苗在使用中需要对其进行适宜的肿瘤抗原负载,其所负载的肿瘤抗原决定了DC疫苗应用的成败[2]。同时由于肿瘤生物学的高度异质性,进行个体化治疗也是肿瘤治疗的重要发展方向[3]。利用个体化的、有效的肿瘤抗原负载DC细胞,将能更有效强化DC疫苗的抗肿瘤特性。
树突状细胞疫苗特异肿瘤多肽库(专利号CN 104655849 B,2016-08-24)包含360个多肽序列,每个序列分别含有15~30个氨基酸。这些多肽分子具有肿瘤特异性,特异多肽涉及26种肿瘤类型。患者外周血通过蛋白质谱分析并与多肽库中序列进行比较,检测得出患者特异肿瘤多肽靶点,据此体外合成该患者的特异肿瘤多肽序列。体外合成的患者特异多肽小分子同时具有患者特异性和肿瘤特异性。本研究利用DC细胞作为抗原递呈载体,检测了患者特异肿瘤多肽在体外对淋巴细胞的激活功能,为未来树突状细胞疫苗特异肿瘤多肽负载DC疫苗在肿瘤治疗中的应用提供实验依据。
1 资料与方法
1.1 实验材料及患者肿瘤特异多肽检测合成
研究使用的外周血来自于2019年12月至2021年1月北京世纪坛医院肿瘤内科住院治疗患者,本研究开始前已经北京世纪坛医院医学伦理委员会审查批准(批件编号:2019-科研51),所有研究对象均签署知情同意书。本研究使用的肿瘤细胞系(包括A549、TCCSUP、SGC-7901、BGC-823、CFPAC-1、MCF-7、MDA-MB-453、HCT-116)均购自中国科学院细胞库。患者外周血特异肿瘤多肽由河北博海生物工程开发有限公司检测并提供合成。患者一般信息及肿瘤多肽检测结果见表1,不同患者检测并合成的多肽序列类别数不同,体外实验采用患者细胞及其各自特异的肿瘤多肽。
1.2 试剂
DC细胞培养基采用德国CellGenix 树突细胞培养基(货号20801-0500),淋巴细胞培养基Lymphocyte serum-free medium(LSFM)为美国Corning公司生产,胎牛血清、RIPM-1640、DMEM高糖培养基为美国ThermoFisher公司生产,细胞因子白介素-4(interleukin-4,IL-4)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-ɑ)购自美国R&D公司,白介素-2(interleukin-2,IL-2)、巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulation factor,GM-CSF)购自厦门特宝生物工程有限公司,细胞因子检测试剂购自瑞典Mabtech公司,淋巴细胞分离液购自天津灏洋生物科技有限公司,CCK-8检测试剂盒购自广州赛国科技生物有限公司。
1.3 患者体外DC细胞培养及细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)培养
外周血DC细胞分离及培养采用贴壁法[4],用含自体血浆的RIPM-1640培养液在37 ℃ 5%(体积分数)CO2条件下静置培养2 h,移除非贴壁细胞用于后续CIK细胞培养,贴壁细胞用含TNF-α 2.5 mg/L、GM-CSF 0.4 mg/L和IL-4 0.02 mg/L的新鲜CellGenix 树突细胞培养基,37 ℃ 5%CO2培养,每2~3天补液并补充细胞因子。实验组DC细胞培养体系中依据前期动物预实验结果,按照每种肿瘤多肽2.5 mg/L的工作(质量)浓度加入患者特异肿瘤多肽。
患者体外CIK细胞的培养中,原始细胞为上述贴壁法移除的非贴壁细胞,培养方法依照文献[5]的方法进行。
外周血DC细胞培养5 d后,按照数量比DC ∶CIK=1 ∶8的比例进行混合,继续培养≥3 d后进行淋巴细胞功能检测。实验分为实验组[DC细胞(经树突状细胞疫苗特异肿瘤多肽刺激)+CIK细胞联合培养:肽-DC-CIK]、对照组1[DC细胞(无肿瘤多肽刺激)+CIK细胞联合培养:DC-CIK]和对照组2(单纯CIK细胞:CIK)。
1.4 增殖功能检测
采用CCK-8法检测不同组CIK细胞的增殖活性:采用96孔板进行接种,每孔肿瘤细胞接种浓度为6×103,每组设4个复孔,37 ℃分别培养2 d、4 d和6 d后每孔加10%体积的CCK-8,继续培养2 h后,450 nm测定光密度值。培养体系设为两组,一组含有终浓度为1 000 IU/mL的 IL-2,一组不含IL-2。
1.5 细胞因子分泌功能检测
采用酶联免疫斑点法检测不同组CIK细胞分泌细胞因子的功能,每组设3个复孔,按试剂操作指南进行操作,细胞接种量为2.5×105/孔,孵育18 h后进行细胞因子分泌量检测。
1.6 杀肿瘤细胞功能检测
采用CCK-8法检测不同组CIK细胞对肿瘤细胞株的杀伤作用。采用96孔板进行接种,每孔肿瘤细胞接种浓度为1×103,贴壁培养2 h后,按比例加入不同浓度效应细胞,并使效靶比为10 ∶1、20 ∶1、30 ∶1。同时设单独效应细胞组和单独靶细胞组,每组设3个复孔,37 ℃培养18 h和24 h后每孔加10%体积的CCK-8,继续培养2 h后,450 nm测定光密度值,计算效应细胞对肿瘤细胞的杀伤率。杀伤率=[1-(实验孔-效应孔)/靶细胞孔]×100%。
1.7 统计学分析
采用SPSS 19.0软件,计量资料采用均数±标准差表示,组间增殖光密度比较、细胞因子分泌量比较及杀肿瘤效率的比较均采用秩和检验。存在多组间比较时,组间两两比较采用Kruskal-Wallis 检验,统计结果均采用双侧检验。P<0.05认为差异有统计学意义。
2 结果
2.1 患者外周血特异肿瘤多肽检测
本体外研究涉及肿瘤类型包括非小细胞肺癌、胃癌、乳腺癌、膀胱癌、胰腺癌、结肠癌等(表1)。

表1 患者一般信息及肿瘤特异多肽检测结果Table 1 Patient characters and specific tumor polypeptide information
2.2 体外淋巴细胞增殖
采用CCK-8 法体外测量肿瘤多肽对淋巴细胞增殖作用,测量时间点分别为当日、第2天、第4天、第6天。在培养体系中IL-2存在的情况下(图1A),实验组与对照组均增殖明显,但肿瘤多肽组在第4天(Z=-3.79,P<0.001)、第6天(Z=-2.95,P<0.01)时光密度显著高于单纯CIK组,差异有统计学意义,并在第4天时光密度显著高于DC-CIK组(Z=-2.02,P<0.05),提示在有IL-2存在的情况下,肿瘤多肽可刺激淋巴细胞的增殖。培养体系中无IL-2时,各组淋巴细胞均增殖缓慢,在各时间点光密度差异无统计学意义(图1B)。
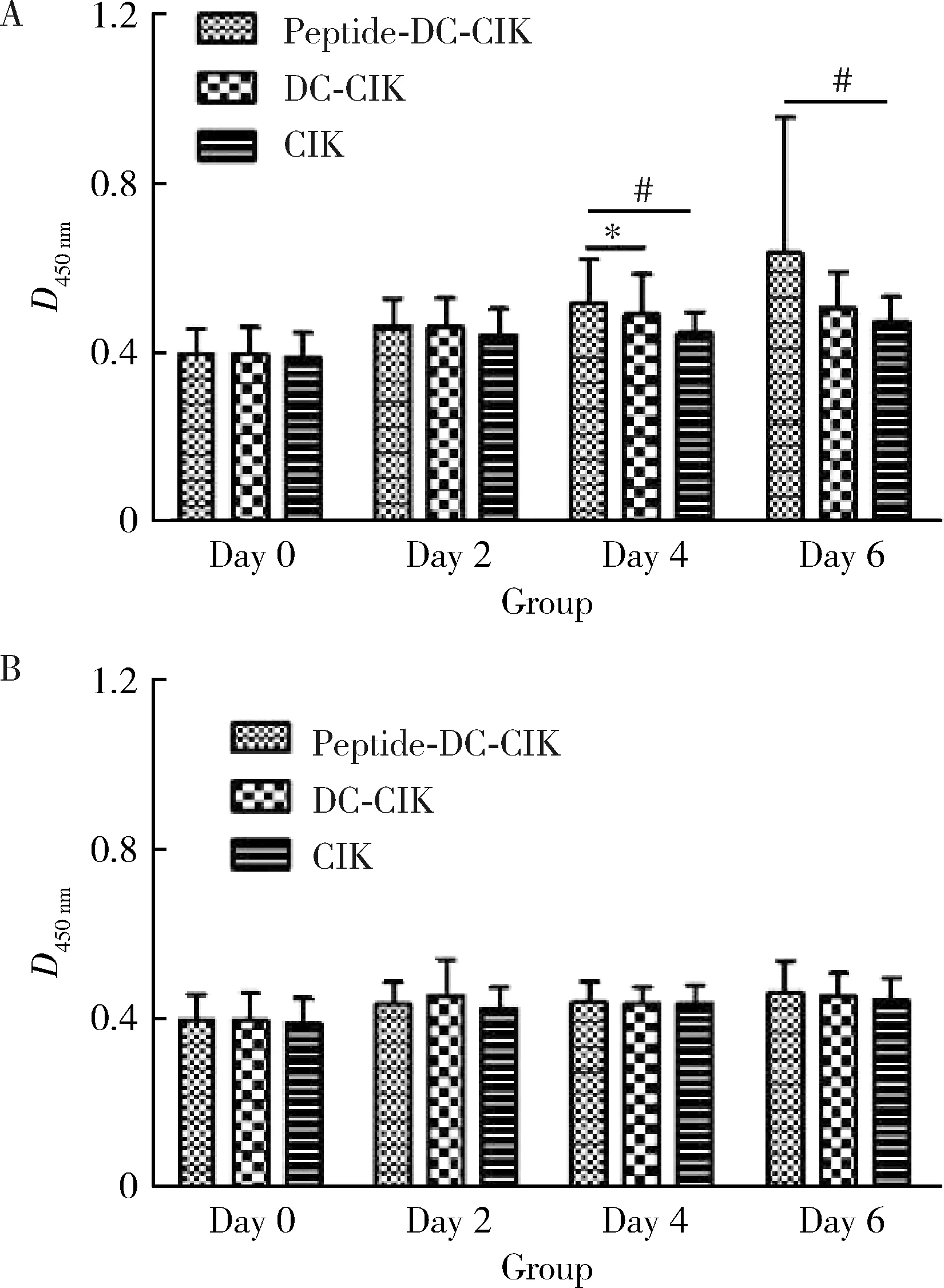
* P<0.05,# P<0.001.A,in the presence of IL-2,the absorbance at 450 nm of different groups at different time point;B,the absorbance at 450 nm of different groups at different time point without IL-2.图1 肿瘤多肽刺激淋巴细胞增殖情况Figure 1 Lymphocyte proliferation when stimulated by specific tumor polypeptides
2.3 细胞因子分泌功能
经18 h孵育后,肿瘤多肽刺激组CIK细胞的多种细胞因子产生量高于单纯CIK组,其中IL-4(Z=-2.61,P<0.01)、GM-CSF(Z=-3.85,P<0.001)、IFN-γ(Z=-3.56,P<0.001)和TNF-α(Z=-3.40,P<0.001)的分泌量与单纯CIK组相比,差异有统计学意义。肿瘤多肽刺激组与DC-CIK组相比,除IL-4分泌量差异有统计学意义外(Z=-2.15,P<0.05),其余各项细胞因子分泌量差异均无统计学意义。DC-CIK组与单纯CIK组相比,IFN-γ(Z=-2.44,P<0.05)、TNF-ɑ(Z=-2.26,P<0.05)和GM-CSF(Z=-3.73,P<0.001)分泌量差异有统计学意义(图2)。

*P<0.05,△P<0.01,# P<0.001.图2 不同组细胞因子的分泌量Figure 2 Cytokine secretion of CIK cells in different groups
2.4 杀肿瘤细胞功能
不同效靶比例下,肿瘤多肽组与DC-CIK组、单纯CIK组在18 h与24 h的杀伤效率差异无统计学意义,但肿瘤多肽组有高于其他两个对照组的趋势(图3)。
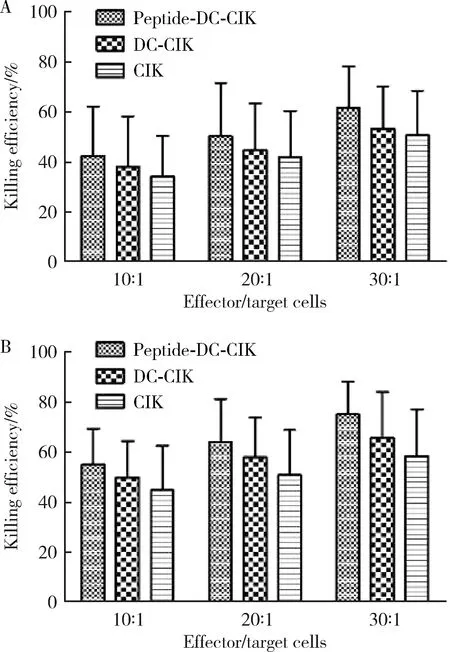
图3 不同效应细胞/靶细胞比共孵育18 h(A)及24 h(B)各组CIK细胞对肿瘤细胞的杀伤效率Figure 3 The killing efficiency of CIK cells to tumor cells at 18 h(A) and 24 h(B)time point with different effector/target cells ratio
3 讨论
DC细胞具有强大的抗原递呈功能,DC肿瘤疫苗能够激活原始T细胞,同时激活先天免疫和获得性免疫,并可通过同时负载多种肿瘤抗原实现多种肿瘤抗原的递呈,基于DC细胞的肿瘤疫苗在肿瘤治疗中取得了良好的疗效[6-7]。目前,用于负载DC的抗原可以是肿瘤特异性抗原、肿瘤相关抗原或肿瘤全细胞抗原等[8],如采用个体化肿瘤抗原进行DC细胞负载,可达到DC疫苗的个体化治疗特性,将更好地发挥DC肿瘤疫苗的治疗效果。本研究采用的个性化肿瘤特异多肽,为一组患者个性化定制肿瘤多肽,通过DC细胞递呈给T淋巴细胞,最终刺激机体产生特异性抗肿瘤免疫反应。
本研究发现经肿瘤多肽负载的DC细胞组与CIK细胞共培养后,相比较于DC+CIK组、单纯CIK组,在有IL-2存在的情况下,能够显著刺激诱导淋巴细胞的增殖,增殖效果随孵育时间延长而明显提高,提示树突状细胞疫苗特异肿瘤多肽可增强CIK细胞的增殖功能。培养体系中IL-2对维持T 细胞生存与增殖具有重要作用[9],IL-2的存在可显著促进淋巴细胞的增殖。本研究结果也显示培养体系中如没有IL-2,肿瘤特异多肽对淋巴细胞的增殖没有显著影响。肿瘤特异多肽需要在有IL-2存在的情况下,才能发挥促进淋巴细胞增殖的功能。
DC细胞呈递肿瘤抗原给T淋巴细胞后,活化的T淋巴细胞可分泌相应细胞因子。本研究发现,树突状细胞疫苗特异肿瘤多肽负载组可显著提高IFN-γ的分泌量,与单纯CIK组相比,IFN-γ分泌量差异有统计学意义(P<0.001)。IFN-γ可由活化的Th1细胞分泌,具有调节Th1细胞活化、分化、成熟,促进DC 细胞及巨噬细胞 MHC 类分子表达和抗原递呈功能,并能激活 NK 细胞增强其细胞毒性[10]。本研究还发现,树突状细胞疫苗特异肿瘤多肽负载组的TNF-α、GM-CSF与IL-4分泌量显著高于单纯CIK组。有学者报道[11],高浓度TNF-α可以破坏肿瘤血管引起细胞坏死,并可促进MHC-1类分子表达,增强NK、CTL对肿瘤的杀伤作用,TNF-α已成功应用于临床肿瘤治疗。GM-CSF可由活化的Th1淋巴细胞分泌,有学者发现GM-CSF可改善放化疗引起的T淋巴细胞损伤,改善机体免疫功能,并可刺激特异性细胞毒性T细胞向肿瘤组织浸润[12-13]。而IL-4在不同的细胞类型中参与调节不同的生物过程,如细胞的增殖、分化和凋亡等。有研究报道[14],非小细胞肺癌患者中,IL-4可通过增强 CD8+T 细胞的细胞毒作用,以及活化嗜酸性粒细胞、嗜碱性粒细胞等参与机体的抗肿瘤免疫反应。此外,它还可通过协同TNF-α来活化内皮细胞,增加机体血管的通透性,从而有利于淋巴细胞的浸润并诱导自然杀伤细胞的活化。本研究结果提示肿瘤特异多肽负载组,在体外可显著提高多种细胞因子的分泌量,可潜在提高CIK细胞的抗肿瘤功能。
本研究不同实验组在体外对肿瘤细胞的杀伤实验发现,负载了树突状细胞疫苗特异肿瘤多肽的实验组,其对相应肿瘤细胞系的杀伤效率在两个时间点及多个靶/效浓度的杀伤效率均显著高于DC-CIK组及单纯CIK组,但也有部分患者3组免疫细胞对肿瘤细胞系的杀伤效率无显著差别。总体杀伤效率经统计学分析后显示,在不同时间点以及不同的效/靶浓度比,3组虽然差异无统计学意义,但肿瘤多肽负载组仍有高于其他两组的趋势。分析杀伤效率统计学无差异的原因可能为:(1)不同患者负载的肿瘤多肽均为患者特异的定制肿瘤肽,其与肿瘤细胞系之间不存在交叉抗原的可能;(2)可能有样本量不够大导致的统计偏差。另外,有研究者报告多种具有抗肿瘤效应的多肽,其抗肿瘤机制为诱导了肿瘤细胞的凋亡,从而达到抗肿瘤目的[15]。本研究并未检测多肽的体外诱导肿瘤细胞凋亡功能,有待后续研究探索。
综上所述,树突状细胞疫苗特异肿瘤多肽联合DC细胞,在体外可有效增强T淋巴细胞的增殖能力及多个细胞因子的分泌功能。
